
- •1. Коhдуктометрия. Аhализ по электрической проводимости.
- •1.1. Теоретические основы
- •1.2. Кондуктометрическое титрование
- •2. Высокочастhое коhдуктометрическое титроваhие
- •2.1. Сущность метода
- •2.2. Практические работы
- •1. Аппаратура, материалы и реактивы
- •3. Выполнение работы
- •1) Установка точной концентрации титранта
- •1. Аппаратура, материалы и реактивы
- •2) Проведение титрования.
- •2.3. Вопросы и задачи
- •3. Потеhциометрия
- •3.1. Теоретические основы метода
- •3.1.1. Электродный потенциал
- •3.1.2. Сущность потенциометрического метода анализа
- •3.1.3. Индикаторные электроды
- •3.1.4. Электроды сравнения
- •3.1.5. Измерение потенциала индикаторного электрода
- •3.2. Прямые потенциометрические измерения
- •3.2.1. Измерение рH (активной кислотности среды)
- •3.2.2. Определение активности (концентрации) ионов с помощью ионоселективных электродов
- •3.2.3. Практические работы
- •1. Аппаратура, материалы и реактивы
- •2. Выполнение работы
- •3. Окончание работы
- •1. Аппаратура, материалы и реактивы
- •2.Выполнение работы
- •3.2.4. Вопросы и задачи
- •3.3. Потеhциометрическое титроваhие
- •3.3.1. Сущность метода
- •3.3.2. Способы нахождения точки эквивалентности
- •3.3.3. Практические работы
- •1. Аппаратура, материалы и реактивы
- •1. Аппаратура, материалы и реактивы
- •1. Аппаратура, материалы и реактивы
- •3.3.4. Вопросы и задачи
- •4. Вольтамперометрия
- •4.1. Полярография постоянного тока (классическая)
- •4.2. Теоретические основы полярографии
- •4.3. Электроды, применяемые в полярографии
- •4.4. Полярография переменного тока
- •4.5. Инверсионная вольтамперометрия.
- •4.5. Практические работы
- •1. Аппаратура, материалы и реактивы
- •1. Аппаратура, материалы и реактивы
- •2. Ход анализа
- •2. Проведение анализа по методу ива
- •2.1. Запись вольтамперных кривых (вольтамперограмм).
- •4.7. Вопросы и задачи
- •5. Амперометрическое титроваhие
- •5.1. Теоретические основы метода
- •5.2. Практические работы
- •1. Аппаратура, материалы и реактивы
- •2. Подготовка установки к работе
- •3. Выполнение работы
- •4. Окончание работы
- •5.3. Вопросы и задачи
- •125080, Москва, Волоколамское ш., 11
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ПИЩЕВЫХ ПРОИЗВОДСТВ»
Лабораторный практикум по аналитической химии
ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Москва, 2006
Лабораторный практикум по аналитической химии. Электрохимические методы анализа.
( Траубенберг С.Е., Лысюк Ф.А., Осташенкова Н.В. и др.)
МГУПП, — М., . — с.
Включены разделы по кондуктометрии, высокочастотному кондуктометрическому титрованию, потенциометрии, вольтамперометрии, амперометрическому титрованию. Подробно дано описание лабораторных работ и теоретической части для их выполнения. Достаточно большое количество предлагаемых работ по каждой группе методов позволяет расширить возможности для индивидуальной работы при выполнении практикума с учетом профессиональной направленности. В конце каждого раздела даны вопросы и задачи по изучаемой теме.
Рекомендовано УМО по образованию в области «Технологии продуктов питания» в качестве учебного пособия для студентов высших учебных заведений, обучающихся по направлению "Технология продуктов питания" 552400, 656600 «Производство продуктов питания из растительного сырья»
Рецензенты:
Зав. кафедрой органической химии МГУПП,
д.т.н. Кочеткова А.А.,
Профессор кафедры прикладной экологии РГУНиГ,
д.х.н. Петров С.И.
Предисловие
Электрохимические методы анализа основаны на измерении электрохимических свойств анализируемых систем, а именно на исследовании процессов, происходящих на электродах или в межэлектродном пространстве. При этом возникает или изменяется ряд параметров системы, таких как потенциал, ток, количество электричества, сопротивление, электропроводность и другие, значения которых пропорциональны концентрациям анализируемых веществ или определяются их специфическими свойствами. В основе классификации электрохимических методов положены процессы, происходящие на электродах.
1. Методы, основанные на протекании электродной электрохимической реакции: потенциометрия и потенциометрическое титрование, полярография, амперометрическое титрование, кулонометрия и кулонометрическое титрование.
2. Методы, не связанные с протеканием электродной электрохимической реакции. К ним относят кондуктометрию и кондуктометрическое титрование (низко- и высокочастотное).
Электрохимические методы анализа занимают важное место в технохимическом контроле пищевых продуктов. Широкое применение имеет потенциометрия и потенциометрическое титрование — для определения кислотности сырья, полуфабрикатов и готовой продукции, а также целого ряда ионов (Na+, Ca 2+, K+, NO 3-, I- и др.) на основе использования ионоселективных электродов.
Кондуктометрия используется для контроля водоочистки, для определения минеральных компонентов, в частности, например, в сахарном производстве для определения золы в диффузионных соках, уваренных сиропах, сахарном песке, патоке.
Очень широко используется полярография для определения токсичных металлов (Pb 2+, Cd 2+, Zn 2+, Cu 2+ и др).
1. Коhдуктометрия. Аhализ по электрической проводимости.
1.1. Теоретические основы
Электрической проводимостью называют способность вещества проводить электрический ток под действием внешнего электрического поля. Электрическая проводимость электролитов обусловливается движением ионов под действием электрического поля.
Как и все проводники, растворы электролитов характеризуются определенным сопротивлением (R). Величина, обратная сопротивлению называется электрической проводимостью W
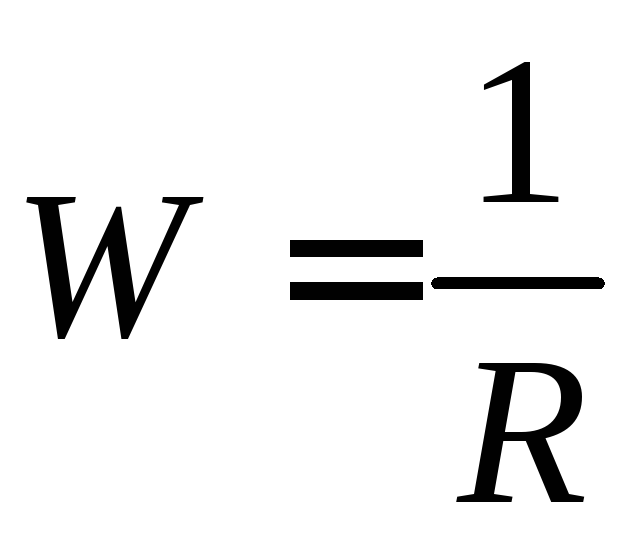 (Ом-1)
(Ом-1)
где: R — сопротивление раствора, Ом.
Единицей электрической проводимости является проводимость проводника сопротивлением 1 Ом. В системе СИ эта единица получила название сименс См.
Электрическая проводимость раствора выражается в единицах или удельной, или эквивалентной электрической проводимости. Удельная электрическая проводимость (χ) измеряется в См/м3 и представляет собой электрическую проводимость 1 м3 раствора, находящегося между параллельными электродами площадью 1 м2 каждый при расстоянии между ними 1 м. Более удобной единицей объема для практического использования в лаборатории является дольная единица измерения, такая, как кубический сантиметр (см3). Тогда удельная электрическая проводимость будет измеряться в См/см3 и представлять собой электрическую проводимость столба жидкости длиной 1 см м поперечным сечением 1 см2.
Для аналитических измерений более удобной характеристикой раствора электролита является эквивалентная электрическая проводимость λ. Эквивалентной электрической проводимостью называют проводимость раствора, содержащего 1 моль эквивалента вещества и находящегося между двумя параллельными электродами, расстояние между которыми 1 см. Ее единицей измерения, является См см2/моль-экв.
Удельная и эквивалентная проводимости взаимосвязаны соотношением
![]()
где: С - молярная концентрация эквивалента, моль/л.
Величина λ для сильных электролитов может быть выражена соотношением:
![]()
для слабых электролитов:
![]()
где: V+ и V- — скорости движения катионов и анионов при градиенте потенциала 1 В/см, α — степень диссоциации электролита, F — число Фарадея (96500 Кл).
Произведение двух величин F∙V обозначают через U+ и U-, которые носят название подвижностей, или через λ+ и λ-, называемые эквивалентной электрической проводимостью ионов.
Числовые значения подвижностей ионов в водном растворе при комнатной температуре находятся в пределах 30-70 См см2/моль-экв и лишь у ионов H+ и ОH- они существенно превышают эти значения λ(Н+) = 350, λ (ОН-) = 199 СМ ∙см2/ моль-экв, что связано с особым механизмом перемещения этих ионов в электрическом поле.
1.2. Кондуктометрическое титрование
Различают прямую кондуктометрию и кондуктометрическое титрование. Метод прямой кондуктометрии основан на том, что в области разбавленных и умеренно концентрированных растворов электрическая проводимость растет с увеличением концентрации электролита. По величине электрической проводимости можно судить о концентрации раствора. В связи с относительно близкими значениями подвижностей ионов прямые кондуктометрические измерения дают информацию лишь об общей концентрации ионов в растворе. Малая селективность кондуктометрического метода является одним из его существенных ограничений. Метод прямой кондуктометрии применяют при контроле дистиллированной воды, для расчета констант диссоциации, для определения растворимости малорастворимых соединений.
Кондуктометрическое титрование основано на изменении в процессе титрования электрической проводимости исследуемого раствора, вызванном изменением концентрации ионов или заменой в растворе одного иона другим, обладающим иной подвижностью.
Результаты измерений электрической проводимости раствора в процессе титрования изображают графически в виде кривых титрования. Hа рис.1.1 приведены некоторые такие кривые титрования.
1). Титрование сильной кислоты сильным основанием. Hапример,
H+ + Cl- + (K+ + OH-) → H2O + K+ + Cl-.
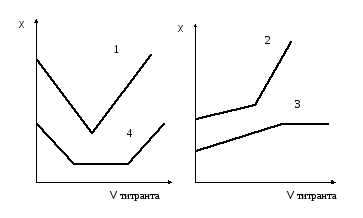 При
титровании в растворе происходит замена
ионов водорода, имеющих большую
подвижность, на менее подвижные ионы
натрия или калия. При таком титровании
электрическая проводимость раствора
сначала уменьшается и достигает минимума
в точке эквивалентности, после чего
снова возрастает вследствие поступления
в раствор избыточных ионов ОH-.
При
титровании в растворе происходит замена
ионов водорода, имеющих большую
подвижность, на менее подвижные ионы
натрия или калия. При таком титровании
электрическая проводимость раствора
сначала уменьшается и достигает минимума
в точке эквивалентности, после чего
снова возрастает вследствие поступления
в раствор избыточных ионов ОH-.
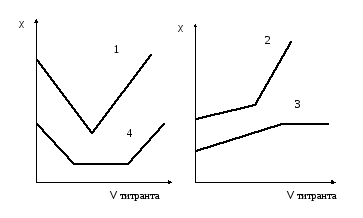
Рис.1.1. Кривые кондуктометрического титрования.
2). Титрование слабой кислоты сильным основанием. Hапример,
СH3СООH + Na + + OH- → CH3COO- + Na+ + Н2О
При титровании вместо слабодиссоциированной уксусной кислоты образуется ее натриевая соль, в процессе титрования электрическая проводимость несколько возрастает, а после окончания титрования при добавлении избытка сильного основания возрастает очень резко.
3). Титрование слабой кислоты слабым основанием. Hапример,
СHС3ООH + NH4OH → CH3COO - + NH4+ + Н2О
При титровании сначала электрическая проводимость увеличивается, так как образующаяся соль является сильным электролитом. После достижения точки эквивалентности электрическая проводимость практически не меняется.
4). Титрование смеси сильной и слабой кислот сильным основанием.
До точки нейтрализации сильной кислоты (первая точка эквивалентности) вследствие присутствия в растворе избытка сильной кислоты диссоциация слабой кислоты будет подавлена и вклад ее в общую электрическую проводимость раствора будет незначителен. Hа этом участке ход кривой титрования будет практически совпадать с ходом кривой титрования 1. Когда же вся сильная кислота будет нейтрализована, будет происходить титрование слабой кислоты, и кривая будет иметь вид кривой 2.
Область применения кондуктометрического титрования
Кондуктометрическое титрование дает хорошие результаты в тех случаях, когда электрическая проводимость исходного вещества значительно отличается от электрической проводимости продуктов реакции. Кондуктометрическое титрование может быть использовано для различных типов объемно-аналитических определений: кислотно-основных, осаждения, комплексообразования, обмена ионов и др.
Преимущества метода:
1. Возможность дифференцированного определения веществ в многокомпонентных смесях и водных растворах;
2. Возможность определений в окрашенных и мутных растворах, а также в присутствии окислителей или восстановителей, ограничивающих применение кислотно-основных индикаторов;
3. Возможность проводить определения не только в сравнительно концентрированных, но и разбавленных растворах (до 10-4 М).
Ограничения. Метод имеет ограничения применения в тех случаях, когда в растворе присутствует много посторонних электролитов, т.к. электрическая проводимость раствора за их счет повышается и относительные изменения ее в ходе реакции титрования оказываются незначительными.
