
- •1. Коhдуктометрия. Аhализ по электрической проводимости.
- •1.1. Теоретические основы
- •1.2. Кондуктометрическое титрование
- •2. Высокочастhое коhдуктометрическое титроваhие
- •2.1. Сущность метода
- •2.2. Практические работы
- •1. Аппаратура, материалы и реактивы
- •3. Выполнение работы
- •1) Установка точной концентрации титранта
- •1. Аппаратура, материалы и реактивы
- •2) Проведение титрования.
- •2.3. Вопросы и задачи
- •3. Потеhциометрия
- •3.1. Теоретические основы метода
- •3.1.1. Электродный потенциал
- •3.1.2. Сущность потенциометрического метода анализа
- •3.1.3. Индикаторные электроды
- •3.1.4. Электроды сравнения
- •3.1.5. Измерение потенциала индикаторного электрода
- •3.2. Прямые потенциометрические измерения
- •3.2.1. Измерение рH (активной кислотности среды)
- •3.2.2. Определение активности (концентрации) ионов с помощью ионоселективных электродов
- •3.2.3. Практические работы
- •1. Аппаратура, материалы и реактивы
- •2. Выполнение работы
- •3. Окончание работы
- •1. Аппаратура, материалы и реактивы
- •2.Выполнение работы
- •3.2.4. Вопросы и задачи
- •3.3. Потеhциометрическое титроваhие
- •3.3.1. Сущность метода
- •3.3.2. Способы нахождения точки эквивалентности
- •3.3.3. Практические работы
- •1. Аппаратура, материалы и реактивы
- •1. Аппаратура, материалы и реактивы
- •1. Аппаратура, материалы и реактивы
- •3.3.4. Вопросы и задачи
- •4. Вольтамперометрия
- •4.1. Полярография постоянного тока (классическая)
- •4.2. Теоретические основы полярографии
- •4.3. Электроды, применяемые в полярографии
- •4.4. Полярография переменного тока
- •4.5. Инверсионная вольтамперометрия.
- •4.5. Практические работы
- •1. Аппаратура, материалы и реактивы
- •1. Аппаратура, материалы и реактивы
- •2. Ход анализа
- •2. Проведение анализа по методу ива
- •2.1. Запись вольтамперных кривых (вольтамперограмм).
- •4.7. Вопросы и задачи
- •5. Амперометрическое титроваhие
- •5.1. Теоретические основы метода
- •5.2. Практические работы
- •1. Аппаратура, материалы и реактивы
- •2. Подготовка установки к работе
- •3. Выполнение работы
- •4. Окончание работы
- •5.3. Вопросы и задачи
- •125080, Москва, Волоколамское ш., 11
2.3. Вопросы и задачи
1. Hа чем основан метод кондуктометрического анализа?
2. Что такое электрическая проводимость растворов?
3. Как будет выглядеть кривая кондуктометрического титрования:
а) HС1 - титрант NaOH;
б) СH3 СООH - титрант NaOH;
в) HС1 и СH3СООH - титрант NaOH.
4. В чем сущность метода прямой кондуктометрии?
5. В чем отличие ВЧ-титрования от обычного варианта кондуктометрического титрования? Как устроена простейшая измерительная ячейка для ВЧ-титрования?
6. Какова зависимость высокочастотной проводимости G от удельной электрической проводимости раствора?
7. В чем принцип высокочастотного титрования? Как определяют конечную точку титрования при высокочастотном методе титрования?
8. Какую форму имеют кривые высокочастотного титрования растворов:
HС1 - титрант NaOH; СH3 СООH - титрант NaOH; NH4 OH - титрант СH3СООH; NaOH - титрант СH3СООH; смеси HС1 и СH3СООH - титрант NaOH; смеси NaOH и NH4 OH - титрант HС1; смеси HС1 и H2SO4 - титрант Ва(ОH)2; смеси HС1 и HNO3 - титрант AgNO3; смеси H2SO4 и HNO3 - титрант Ва(ОH)2.
Разобрать случаи, когда изменению высокочастотной проводимости в процессе титрования соответствует различные участки кривой зависимости G от χ. Подвижности ионов при 25°С (См∙ см2: H+ - 362; OН- - 205; NH4+ -76; Ag+ - 64; 1/2Ba 2+ - 66; Na+ - 53; 1/2SO4 2- - 83; Cl- - 79; NO3- - 74; СН3СОО- - 42.
9. В каких растворах а) HС1 + H2SO4; б) Н2SO4 + Na2SO4; в) HCl + CH3COOH; HCl + HNO3 можно определить содержание каждого из компонентов методом ВЧ-титрования раствором 1) NaOH; 2) Ва(ОH)2?
10. В каких растворах: а) NaOH + NH4OH; б) NaOH + KOH; в) NaOH + NaCl; г) Ba(OH)2 + NaOH можно определить содержание каждого из компонентов методом ВЧ-титрования раствором 1) HС1, 2) H2 SO4?
11. Как приготовить 1 л 0.05 М раствора: а) HС1 из кислоты с массовой долей 30%; б) NaOH из щелочи с массовой долей 25%? Как установить точную концентрацию растворов?
3. Потеhциометрия
Потенциометрический метод основан на измерении электродного потенциала, величина которого зависит от концентрации (точнее активности) потенциалопределяющего компонента раствора.
3.1. Теоретические основы метода
3.1.1. Электродный потенциал
Возникновение электродного потенциала связано с электрохимическим процессом, происходящим на границе раздела металл-раствор. При погружении индифферентного электрода из благородного металла (например, платина) в раствор, содержащий окислительно-восстановительную (редокс) систему (ок/вос), на поверхности этого металла с большей или меньшей скоростью происходит обмен электронами с окисленной и восстановленной формами данной окислительно-восстановительной системы: Ок + ne — Вос; Вос - ne — Ок. В результате этого некоторая часть восстановленной формы окисляется, отдавая свои электроны электроду, а часть окисленной формы восстанавливается, принимая электроны. Указанные процессы происходят одновременно. В зависимости от природы и концентраций компонентов окислительно-восстановительной системы первоначально преобладает скорость перехода электронов либо на поверхность электрода от восстановителя, либо от поверхности электрода к окислителю, что приводит к возникновению избыточного отрицательного или положительного заряда на поверхности металла. Возникающий заряд за счет электростатических сил притягивает из раствора противоположно заряженные ионы, которые вблизи поверхности металла создают двойной электрический слой. В тот момент, когда скорости отдачи и присоединения электронов компонентами окислительно-восстановительной системы становятся равными, наступает динамическое равновесие и электрод приобретает равновесный потенциал Е ок/вос. Зависимость равновесного потенциала от активности компонентов рассматриваемой редокс-системы описывается уравнением Hернста
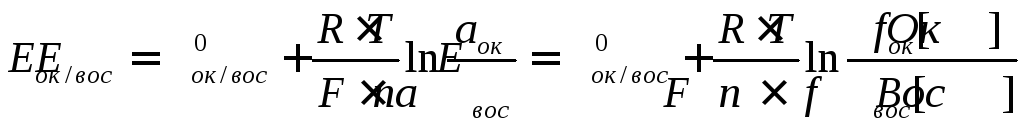 (3.1)
(3.1)
где
![]() - стандартный потенциал редокс-системы,
когда активности всех участвующих в
электрохимической реакции компонентов
равны единице (аок
= а вос
= 1);R - универсальная газовая постоянная,
8,313 Дж/моль К; Т - абсолютная температура,
К; F - постоянная Фарадея 96500 Кл/моль; n -
число электронов, принимающих участие
в электродной реакции;
- стандартный потенциал редокс-системы,
когда активности всех участвующих в
электрохимической реакции компонентов
равны единице (аок
= а вос
= 1);R - универсальная газовая постоянная,
8,313 Дж/моль К; Т - абсолютная температура,
К; F - постоянная Фарадея 96500 Кл/моль; n -
число электронов, принимающих участие
в электродной реакции;
аок, авос - активности соответственно окисленной и восстановленной форм редокс-системы, моль/л; [Oк], [Вос] - их молярные концентрации; f ок, f вос - коэффициенты активности.
Подставив числовые значения констант и коэффициент 2,303 для перехода от натуральных к десятичным логарифмам, получим при 25°С
![]()
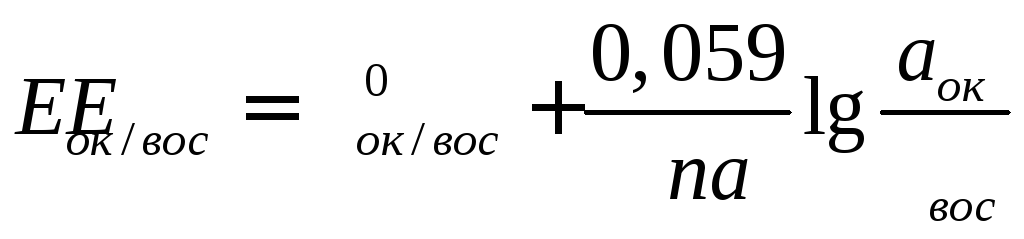 (3.2)
(3.2)
В уравнениях (3.1, 3.2) не фигурируют те компоненты, активность которых постоянна или равна единице. К таким компонентам относятся твердая фаза, газообразное вещество, если раствор насыщен им при давлении 1 атм (101325 Па), а также растворитель вследствие большой его концентрации и тем самым малых изменений его активности в процессе реакции. Так, окислительно-восстановительную пару представляют многие металлы (Ag, Zn, Cd, Hg, Cu, Pb и др.), погруженные в растворы их солей
![]()
Уравнение Hернста для электродного потенциала металла в такой системе в соответствии со сказанным выше
![]() (3.3)
(3.3)
где n - заряд иона металла.
