
- •1. Коhдуктометрия. Аhализ по электрической проводимости.
- •1.1. Теоретические основы
- •1.2. Кондуктометрическое титрование
- •2. Высокочастhое коhдуктометрическое титроваhие
- •2.1. Сущность метода
- •2.2. Практические работы
- •1. Аппаратура, материалы и реактивы
- •3. Выполнение работы
- •1) Установка точной концентрации титранта
- •1. Аппаратура, материалы и реактивы
- •2) Проведение титрования.
- •2.3. Вопросы и задачи
- •3. Потеhциометрия
- •3.1. Теоретические основы метода
- •3.1.1. Электродный потенциал
- •3.1.2. Сущность потенциометрического метода анализа
- •3.1.3. Индикаторные электроды
- •3.1.4. Электроды сравнения
- •3.1.5. Измерение потенциала индикаторного электрода
- •3.2. Прямые потенциометрические измерения
- •3.2.1. Измерение рH (активной кислотности среды)
- •3.2.2. Определение активности (концентрации) ионов с помощью ионоселективных электродов
- •3.2.3. Практические работы
- •1. Аппаратура, материалы и реактивы
- •2. Выполнение работы
- •3. Окончание работы
- •1. Аппаратура, материалы и реактивы
- •2.Выполнение работы
- •3.2.4. Вопросы и задачи
- •3.3. Потеhциометрическое титроваhие
- •3.3.1. Сущность метода
- •3.3.2. Способы нахождения точки эквивалентности
- •3.3.3. Практические работы
- •1. Аппаратура, материалы и реактивы
- •1. Аппаратура, материалы и реактивы
- •1. Аппаратура, материалы и реактивы
- •3.3.4. Вопросы и задачи
- •4. Вольтамперометрия
- •4.1. Полярография постоянного тока (классическая)
- •4.2. Теоретические основы полярографии
- •4.3. Электроды, применяемые в полярографии
- •4.4. Полярография переменного тока
- •4.5. Инверсионная вольтамперометрия.
- •4.5. Практические работы
- •1. Аппаратура, материалы и реактивы
- •1. Аппаратура, материалы и реактивы
- •2. Ход анализа
- •2. Проведение анализа по методу ива
- •2.1. Запись вольтамперных кривых (вольтамперограмм).
- •4.7. Вопросы и задачи
- •5. Амперометрическое титроваhие
- •5.1. Теоретические основы метода
- •5.2. Практические работы
- •1. Аппаратура, материалы и реактивы
- •2. Подготовка установки к работе
- •3. Выполнение работы
- •4. Окончание работы
- •5.3. Вопросы и задачи
- •125080, Москва, Волоколамское ш., 11
5.2. Практические работы
Работа 1. Амперометрическое титрование ионов Zn 2+ раствором гексацианоферрата (II) калия
Определение ионов цинка основано на реакции
2ZnCl2 + 2K4[Fe(CN)6] → K2 Zn2[Fe(CN)6] + 6КС1,
в результате которой ионы цинка связываются в труднорастворимое соединение.
Катион Zn 2+ не дает электродной реакции при анодной поляризации платинового микроэлектрода и поэтому до момента эквивалентности не наблюдается изменения силы тока. При введении избытка реактива (после достижения точки эквивалентности) ток возрастает пропорционально концентрации гексацианоферрата (II) калия вследствие окисления его на платиновом микроэлектроде:
[Fe(CN)6]4- - e → [Fe(CN)6]3-.
1. Аппаратура, материалы и реактивы
Прибор для амперометрического титрования.
Индикаторный электрод — микроплатиновый электрод.
Электрод сравнения — хлорсеребряный электрод.
Стаканчик для титрования вместимостью 50 мл.
Бюретка вместимостью 25 мл.
Пипетка вместимостью 10 мл.
Цилиндр мерный вместимостью 50 мл.
Гексацианоферрат (II) калия, раствор 0,06000 М.
Сульфат калия, раствор 0,2 М.
2. Подготовка установки к работе
Собрать установку для амперометрического титрования под руководством преподавателя, соблюдая технику безопасности.
3. Выполнение работы
1) Снятие вольтамперных кривых для соли цинка и гексацианоферрата (II) калия
Для того, чтобы выбрать потенциал индикаторного электрода, при котором следует вести титрование, необходимо снять вольтамперные кривые для определяемого вещества и титранта. Для этого необходимо:
а) налить в электролизер 30 мл 0,2 М раствора K2SO4 и 2 мл рабочего раствора K4[Fe(CN)6] (из бюретки). Снять вольтамперную кривую при анодной поляризации платинового электрода. Для этого выбирают диапазон измерений по шкале гальванометра и отмечают показания стрелки по шкале гальванометра, увеличивая напряжение на 2-5 делений шкалы вольтметра. Показания гальванометра отсчитывают после установления силы тока до постоянной величины. Результаты измерений заносят в табл. 1.
б) полученный в мерной колбе исследуемый раствор (соль цинка) довести до метки 0,2 М раствором K2SO4. После тщательного перемешивания отобрать в электролизер аликвотную часть (10 мл) этого раствора, добавить туда же 20 мл 0,2 М раствора K2SO4 и снять вольтамперную кривую, как указано в п. (а). Результаты измерений заносят в табл. 1.
Таблица 1
Снятие вольтамперных кривых растворов гексацианоферрата (II) калия и соли цинка
|
K4[Fe(CN)6] |
Е, дел. шкалы |
2 |
4 |
5 |
6 |
8 |
… |
26 |
28 |
30 |
|
I, мкА |
|
|
|
|
|
|
|
|
| |
|
Zn 2+ |
Е, дел. шкалы |
|
|
|
|
|
|
|
|
|
|
I, мкА |
|
|
|
|
|
|
|
|
|
в) вычертить полученные вольтамперные кривые (на миллиметровой бумаге): откладывают на оси абсцисс Е в делениях шкалы вольтметра, а по оси ординат - величину тока в микроамперах (рис. 5.7).
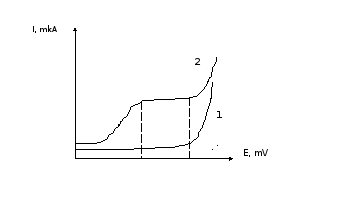
Рис. 5.7. Вольтамперные кривые: 1 - раствор соли цинка; 2 - раствор гексацианоферрата (II) калия.
Hа основании полученных вольтамперных кривых выбирают значение потенциала анода (Еа), при котором следует проводить титрование . Значение Еа выбирают таким образом, чтобы оно находилось в пределях площадки предельного диффузионного тока для гексацианоферрата (II) калия.
2) Титрование раствора соли цинка гексацианоферрата (II) калия
Пипеткой отобрать 10 мл исследуемого раствора Zn 2+ из мерной колбы в электролизер и добавить 20 мл 0,2 М раствора K2SO4. Установить потенциал индикаторного электрода соответственно результатам проведенного исследования так, чтобы достигался диффузионный ток для гексацианоферрата (II) калия. Включение прибора и выполнение измерений проводятся так же, как и при снятии вольтамперных кривых.
В бюретку наливают раствор гексацианоферрата (II) калия. Титрование проводят, прибавляя из бюретки по 0,2 мл K4[Fe(CN)6], фиксируя положение стрелки по шкале гальванометра. Прибавлять реактив следует так, чтобы на носике бюретки не образовывалась капля и сам носик бюретки не касался стенок электролизера и электродов. Результаты измерений записывают в табл. 2.
Таблица 2
Результаты амперометрического титрования раствора ионов Zn 2+ раствором K4[Fe(CN)6] (Еа = .... мВ)
|
1 титрование |
2 титрование |
3 титрование | |||
|
V(K4[Fe(CN)6]), мл
|
I, мкА |
V(K4[Fe(CN)6]), мл
|
I, мкА |
V(K4[Fe(CN)6]), мл
|
I, мкА |
|
0,2 |
|
|
|
|
|
|
0,4 |
|
|
|
|
|
|
0,6 |
|
|
|
|
|
|
….. |
|
|
|
|
|
Проводят 2-3 параллельных титрования. Перед каждым титрованием ополаскивают 2-3 раза стаканчик и электроды дистиллированной водой.
По данным титрования строят (на миллиметровой бумаге) кривую титрования. Для построения необходимо иметь не менее трех точек до и после точки эквивалентности (рис. 5.8). точку эквивалентности определяют по пересечению двух прямолинейных участков кривой титрования.
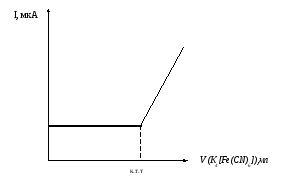
Рис. 5.8. Кривая амперометрического титрования соли цинка раствором гексацианоферрата (II) калия.
Рассчитывают количество цинка в исследуемом растворе

где m(Zn2+) - масса цинка, г; C(K4[Fe(CN)6]) – концентрация титранта, моль/л; V(K4[Fe(CN)6]) - объем титранта, затраченный на титрование, мл; М(Zn2+) - молярная масса эквивалента Zn2+ , г/моль; Vк - вместимость мерной колбы, мл; Vп - вместимость пипетки, мл.
