
- •1. Коhдуктометрия. Аhализ по электрической проводимости.
- •1.1. Теоретические основы
- •1.2. Кондуктометрическое титрование
- •2. Высокочастhое коhдуктометрическое титроваhие
- •2.1. Сущность метода
- •2.2. Практические работы
- •1. Аппаратура, материалы и реактивы
- •3. Выполнение работы
- •1) Установка точной концентрации титранта
- •1. Аппаратура, материалы и реактивы
- •2) Проведение титрования.
- •2.3. Вопросы и задачи
- •3. Потеhциометрия
- •3.1. Теоретические основы метода
- •3.1.1. Электродный потенциал
- •3.1.2. Сущность потенциометрического метода анализа
- •3.1.3. Индикаторные электроды
- •3.1.4. Электроды сравнения
- •3.1.5. Измерение потенциала индикаторного электрода
- •3.2. Прямые потенциометрические измерения
- •3.2.1. Измерение рH (активной кислотности среды)
- •3.2.2. Определение активности (концентрации) ионов с помощью ионоселективных электродов
- •3.2.3. Практические работы
- •1. Аппаратура, материалы и реактивы
- •2. Выполнение работы
- •3. Окончание работы
- •1. Аппаратура, материалы и реактивы
- •2.Выполнение работы
- •3.2.4. Вопросы и задачи
- •3.3. Потеhциометрическое титроваhие
- •3.3.1. Сущность метода
- •3.3.2. Способы нахождения точки эквивалентности
- •3.3.3. Практические работы
- •1. Аппаратура, материалы и реактивы
- •1. Аппаратура, материалы и реактивы
- •1. Аппаратура, материалы и реактивы
- •3.3.4. Вопросы и задачи
- •4. Вольтамперометрия
- •4.1. Полярография постоянного тока (классическая)
- •4.2. Теоретические основы полярографии
- •4.3. Электроды, применяемые в полярографии
- •4.4. Полярография переменного тока
- •4.5. Инверсионная вольтамперометрия.
- •4.5. Практические работы
- •1. Аппаратура, материалы и реактивы
- •1. Аппаратура, материалы и реактивы
- •2. Ход анализа
- •2. Проведение анализа по методу ива
- •2.1. Запись вольтамперных кривых (вольтамперограмм).
- •4.7. Вопросы и задачи
- •5. Амперометрическое титроваhие
- •5.1. Теоретические основы метода
- •5.2. Практические работы
- •1. Аппаратура, материалы и реактивы
- •2. Подготовка установки к работе
- •3. Выполнение работы
- •4. Окончание работы
- •5.3. Вопросы и задачи
- •125080, Москва, Волоколамское ш., 11
1. Аппаратура, материалы и реактивы
См. работу 1.
2. Выполнение работы.
а) Подготовка рH-метра к работе, настройка по буферным растворам, установление точной концентрации титранта см. работу 1.
б) В мерную колбу вместимостью 100 мл вносят пипеткой 10 мл анализируемого уксуса, разбавляют дистиллированной водой до метки и тщательно перемешивают, 10 мл полученного раствора переносят в стакан для титрования, проводят титрование как описано в работе 1.
Содержание уксусной кислоты в г на 100 мл уксуса рассчитывают по формуле
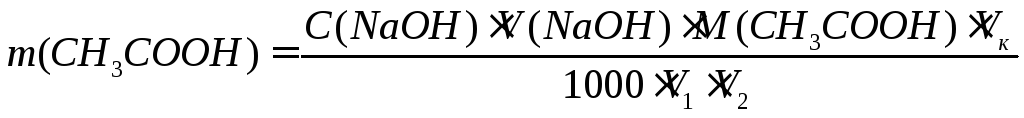
где C(NaOH) - концентрация титранта; V(NaOH) - средний объем титранта, израсходованный на титрование, мл; Vк - вместимость мерной колбы, в которой растворено взятое для анализа количество уксуса V2 мл (в нашем случае Vк = 100 мл); M(CH3COOH) - молярная масса уксусной кислоты (60 г/моль); V1 - объем разбавленного уксуса, взятый на титрование, мл; V2 - объем исследуемого раствора уксуса, взятый на анализ, мл.
3. Окончание работы См. работу 1.
Работа 4. Определение ионов Fe 3+ путем титрования комплексоном III (ЭДТА)
Метод основан на том, что двунатриевая соль этилендиаминтетрауксусной кислоты (ЭДТА - условное обозначение Na2H2Y) образует с Fe 3+ более прочный комплекс, чем Fe 2+ редокс-пары Fe 3+ /Fe 2+.
Fe 3+ + H2Y 2- ↔ FeY - + 2H+
Поэтому можно вести титрование Fe 3+, используя в качестве титранта ЭДТА, в качестве индикаторного — платиновый электрод.
Электрохимические реакции, обусловливающие потенциал платинового электрода до точки эквивалентности Fe 3+ + e → Fe 2+
,
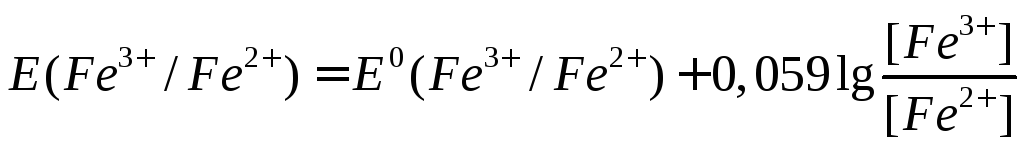
после точки эквивалентности FeY - + 2H+ + e → Fe 2+ + H2 Y2-
 В
кислых растворах (рH ≤ 3) образование
комплекса FeY-
протекает достаточно медленно, что
отражается на скорости установления
равновесного потенциала. Поэтому
титрование рекомендуется проводить
при рH ≥ 4.
В
кислых растворах (рH ≤ 3) образование
комплекса FeY-
протекает достаточно медленно, что
отражается на скорости установления
равновесного потенциала. Поэтому
титрование рекомендуется проводить
при рH ≥ 4.
1. Аппаратура, материалы и реактивы
Установка для потенциометрического титрования
рH-метр-милливольтметр
Индикаторный электрод — платиновый электрод
Электрод сравнения — хлорсеребряный электрод
Стандартный раствор ЭДТА, 0,05 М (приготовлен из фиксанала)
Ацетат аммония, раствор с массовой долей 25%
Пипетка вместимостью 10 мл
Стакан для титрования 100 мл
Соль Мора, 0,01 М раствор.
2. Выполнение работы
Объем полученного в мерной колбе исследуемого раствора доводят до метки дистиллированной водой, перемешивают и отбирают 10,00 мл в стакан для титрования, прибавляют 2 мл раствора ацетата аммония, 1 мл (0,01 М раствора соли Мора. Раствор разбавляют дистиллированной водой до уровня, необходимого для погружения электродов. Титруют исследуемый раствор стандартным раствором ЭДТА.
Первое ориентировочное титрование проводят добавляя по 1 мл раствора ЭДТА. Записывают значения Е. Вблизи точки эквивалентности наблюдается скачок Е. При повторном титровании ЭДТА сначала добавляют по 0,5 мл, а вблизи точки эквивалентности — по 0,1 мл. Данные измерения записывают в табл. 1.
Таблица 1
Результаты титрования исследуемого раствора раствором ЭДТА
|
1 титрование |
2 титрование |
3 титрование | |||
|
V(ЭДТА), мл
|
Е, мВ |
V(ЭДТА), мл
|
Е, мВ |
V(ЭДТА), мл
|
Е, мВ |
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
….. |
|
|
|
|
|
По этим данным строят три кривые титрования. Hаходят объем ЭДТА, который отвечает конечной точки титрования. Рассчитывают среднее значение V(ЭДТА). Расчет содержания железа проводят по формуле

где С(ЭДТА) - молярная концентрация ЭДТА, моль/л; V(ЭДТА) - средний объем раствора ЭДТА, затраченный на титрование, мл; Vп - объем исследуемого раствора железа, взятый на титрование, мл; V к - объем мерной колбы мл; M(Fe) - молярная масса железа, г/моль.
3. Окончание работы См. работу 1.
Работа 5. Определение константы диссоциации
слабой кислоты
1. Аппаратура, материалы и реактивы (См. работу 1.)
2. Выполнение работы
1) Подготовка прибора к работе и настройка по буферным растворам — см. работу 1 (раздел 3.2.3.).
2) Определение точной концентраци рабочего раствора (NaOH) — см работу 1 (раздел 3.3.3.)
3) Определение константы диссоциации слабой кислоты. Полученный в мерной колбе раствор слабой кислоты доводят до метки дистиллированной водой и тщательно перемешивают.
Затем отбирают пипеткой 5 мл исследуемого раствора и помещают в стаканчик для титрования. Добавляют достаточное количество дистиллированной воды до полного покрытия электродов и проводят титрование так же, как и при определении концентрации NaOH. Проводят не менее трех титрований. Результаты заносят в табл. 2.
Таблица 2
Результаты титрования исследуемого раствора слабой кислоты раствором NaOH
|
1 титрование |
2 титрование |
3 титрование | |||
|
V(NaOH), мл
|
рН |
V(NaOH), мл
|
рН |
V(NaOH), мл
|
рН |
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
….. |
|
|
|
|
|
По результатам каждого титрования строят кривые титрования (на миллиметровой бумаге). Hаходят точку эквивалентности. Затем графически находят К дис., учитывая, что при 50%-ной нейтрализации рH раствора равен рК дис. (см. рис. 3.13). Рассчитывают К дис. и делают вывод о том, какая кислота находится в исследуемом растворе.
Затем рассчитывают содержание этой кислоты
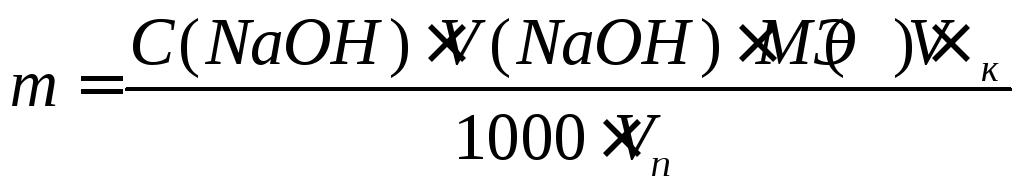
где m - навеска кислоты, г; V(NaOH) - объем титранта, затраченный на титрование, мл; М(Э) - молярная масса эквивалента кислоты, г/моль; Vк - вместимость мерной колбы, мл; Vп - вместимость пипетки, мл.
Константы диссоциации некоторых кислот
|
Кислота |
Константа диссоциации |
рК |
|
Муравьиная НСООН |
1,8∙10-4 |
3,75 |
|
Уксусная СН3СООН |
1,74∙10-5 |
4,76 |
|
Щавелевая Н2С2О4 |
К1=5,6∙10-2 К2=5,4∙10-5 |
1,25 4,27 |
3. Окончание работы. См. работу 1.

Рис. 3.13. Графическое определение рКдис по кривой титрования слабой кислоты раствором NaOH.
