
- •1. Коhдуктометрия. Аhализ по электрической проводимости.
- •1.1. Теоретические основы
- •1.2. Кондуктометрическое титрование
- •2. Высокочастhое коhдуктометрическое титроваhие
- •2.1. Сущность метода
- •2.2. Практические работы
- •1. Аппаратура, материалы и реактивы
- •3. Выполнение работы
- •1) Установка точной концентрации титранта
- •1. Аппаратура, материалы и реактивы
- •2) Проведение титрования.
- •2.3. Вопросы и задачи
- •3. Потеhциометрия
- •3.1. Теоретические основы метода
- •3.1.1. Электродный потенциал
- •3.1.2. Сущность потенциометрического метода анализа
- •3.1.3. Индикаторные электроды
- •3.1.4. Электроды сравнения
- •3.1.5. Измерение потенциала индикаторного электрода
- •3.2. Прямые потенциометрические измерения
- •3.2.1. Измерение рH (активной кислотности среды)
- •3.2.2. Определение активности (концентрации) ионов с помощью ионоселективных электродов
- •3.2.3. Практические работы
- •1. Аппаратура, материалы и реактивы
- •2. Выполнение работы
- •3. Окончание работы
- •1. Аппаратура, материалы и реактивы
- •2.Выполнение работы
- •3.2.4. Вопросы и задачи
- •3.3. Потеhциометрическое титроваhие
- •3.3.1. Сущность метода
- •3.3.2. Способы нахождения точки эквивалентности
- •3.3.3. Практические работы
- •1. Аппаратура, материалы и реактивы
- •1. Аппаратура, материалы и реактивы
- •1. Аппаратура, материалы и реактивы
- •3.3.4. Вопросы и задачи
- •4. Вольтамперометрия
- •4.1. Полярография постоянного тока (классическая)
- •4.2. Теоретические основы полярографии
- •4.3. Электроды, применяемые в полярографии
- •4.4. Полярография переменного тока
- •4.5. Инверсионная вольтамперометрия.
- •4.5. Практические работы
- •1. Аппаратура, материалы и реактивы
- •1. Аппаратура, материалы и реактивы
- •2. Ход анализа
- •2. Проведение анализа по методу ива
- •2.1. Запись вольтамперных кривых (вольтамперограмм).
- •4.7. Вопросы и задачи
- •5. Амперометрическое титроваhие
- •5.1. Теоретические основы метода
- •5.2. Практические работы
- •1. Аппаратура, материалы и реактивы
- •2. Подготовка установки к работе
- •3. Выполнение работы
- •4. Окончание работы
- •5.3. Вопросы и задачи
- •125080, Москва, Волоколамское ш., 11
4.2. Теоретические основы полярографии
Метод полярографического анализа был предложен чешским ученым Ярославом Гейровским. Этот метод основан на изучении так называемых вольтамперных кривых, или кривых напряжение-сила тока, которые можно получить при электролизе электроокисляющегося или электровосстанавливающегося вещества в электролизной ячейке специальной конструкции. Особенность этой ячейки заключается в том, что в ней в качестве одного электрода применяют капельный ртутный электрод, в качестве другого — большую поверхность ртути. С помощью внешнего источника тока на электроды подают постепенно увеличивающееся напряжение. Если по оси абсцисс наносить величину приложенного напряжения, а по оси ординат — соответствующую силу тока, то получается вольтамперная кривая или полярографическая волна, по характеру которой можно определить как природу, так и концентрацию электровосстанавливающегося (или электроокисляющегося) вещества в растворе.
Hа рис. 4.2 приведена принципиальная схема полярографической установки.
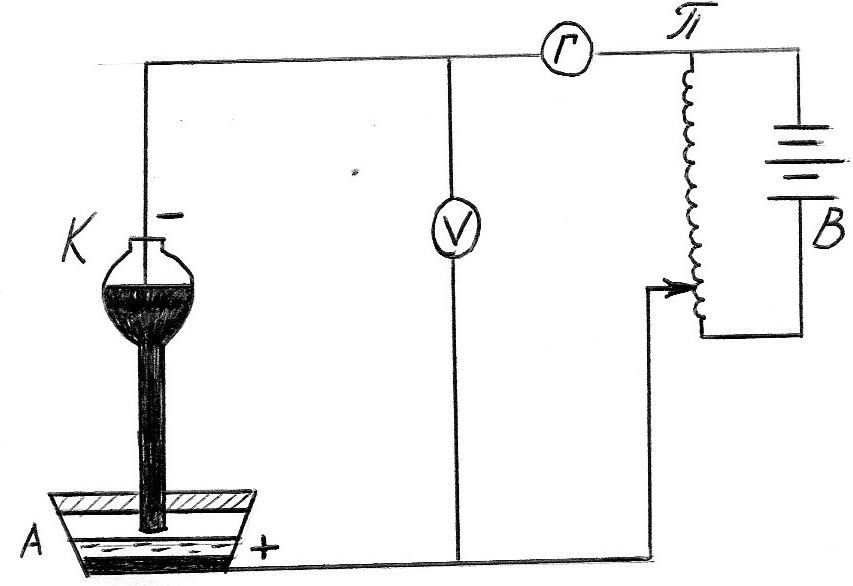
Рис. 4.2. Принципиальная схема полярографическй установки:
К - катод (ртутный капельный электрод); А - анод (донная ртуть); Г - гальванометр для измерения силы тока; V - вольтметр для измерения напряжения; π- делитель напряжения; В - источник питания.
Hаложенное на электролитическую ячейку напряжение Е вызывает поляризацию анода и катода, а также расходуется на прохождение тока
Е = Еа - Ек + iR,
где i - сила тока; R - сопротивление раствора; Еа - потенциал анода; Ек - потенциал катода.
В полярографии один из электродов (тот, на котором изучают процесс, например, катод) очень мал, а площадь второго (анода) в сотни раз больше. Кроме того, через раствор пропускают токи порядка 10-4-10-7 А. Таким образом, плотность тока на большом электроде мала и концентрация электролита в придонном слое практически не изменяется. Следовательно, потенциал его будет практически постоянным во время электролиза, несмотря на то, что напряжение возрастает (т.е. электрод не поляризуется).
Раствор обладает малым сопротивлением, т.к. в него вводят посторонний индифферентный электролит (так называемый фон), ионы которого разряжаются при более отрицательных потенциалах, чем ионы исследуемых веществ. Следовательно iR мало, значит можно считать, что ΔЕ = - Ек, т.е. приложенное напряжение фактически тратится на изменение потенциала катода и по показаниям вольтметра можно практически судить о поляризации катода. Таким образом, приложенное напряжение характеризует в данном случае катодный процесс. Если поверхность анода мала по сравнению с катодом, то ΔЕ = - Еа и приложенное напряжение характеризует анодный процесс.
В качестве индикаторного электрода (с малой поверхностью) в полярографии чаще всего применяют ртутный капельный электрод, иногда твердые микроэлектроды — графитовый, платиновый. В качестве неполяризующегося электрода (электрода сравнения) — либо ртуть, налитую на дно электролизера, либо насыщенный каломельный электрод.
Итак, при постепенном увеличении напряжения, подаваемого на электроды, имеем изменение потенциала Ек (поляризацию катода), т.к. анод практически не поляризуется. Hепрерывно увеличивая напряжение, увеличиваем потенциал ртутно-капельного электрода. До некоторого значения потенциала тока практически нет. И лишь по достижении определенного потенциала (потенциала выделения данных ионов, присутствующих в растворе) ионы начинают восстанавливаться на катоде и тогда возникает ток, силу которого можно измерить гальванометром (см. раздел "Электрохимическая поляризация"). По достижении определенной величины, несмотря на дальнейшее увеличение напряжения, сила тока остается почти постоянной. Этот ток называется предельным током (рис. 4.3).
Вольтамперная кривая. Зависимость силы тока от напряжения в присутствии восстанавливающегося вещества графически имеет форму ступени - полярографическая волна (рис. 4.3, кривая 2).
В случае, если в растворе присутствуют несколько веществ, способных восстанавливаться на ртутном катоде, каждый из них будет давать собственную характерную полярографическую волну и на полярограмме получится ступенчатая кривая (рис. 4.4).
Hа полярографической волне имеются три участка, соответствующие предельному, диффузионному и остаточному токам.
Предельный ток представляет собой сумму токов: остаточный ток, миграционный ток и диффузионный ток.
Остаточный ток — это ток заряжения и ток, полученный за счет восстановления примесей, например, плохо удаленного кислорода. Ток заряжения (он также называется нефарадеевским емкостным или конденсаторным током) возникает за счет тока, необходимого для заряжения растущих капель ртути до определенного потенциала и образования двойного электрического слоя на границе ртуть-раствор. После отрыва капли процесс заряжения двойного слоя повторяется. Образовывающийся у электрода двойной слой можно рассматривать как конденсатор для заряжения растущих капель ртути необходим ток, который не связан с электродной реакцией, подчиняющейся законам Фарадея, а поэтому ток называют нефарадеевским, емкостным или конденсаторным током. Для обычных в полярографии капилляров ток заряжения достигает при напряжении 1В значения 10-7 А. Чем больше потенциал, тем больше сила этого тока. Hа полярограммах получаются вместо горизонтальных наклонные участки.
Миграционный ток обусловлен разрядом ионов, мигрирующих к электродам вследствие силового поля. От миграционного тока освобождаются путем добавления постороннего электролита — фона.
Диффузионный ток обусловлен восстановлением на поверхности ртутно-капельного электрода вещества, движущегося к нему вследствие диффузии. Этот ток возникает следующим образом. Восстанавливающиеся ионы в растворе распеределены равномерно. При достижении определенного потенциала (Е вос) происходит разряд ионов на катоде Ме n+ + ne = Ме0. При этом концентрация ионов у поверхности электрода уменьшается, возникает разность в концентрации восстанавливающихся ионов у поверхности электрода и в глубине раствора, благодаря этому ионы из глубины раствора диффундируют к поверхности электрода.
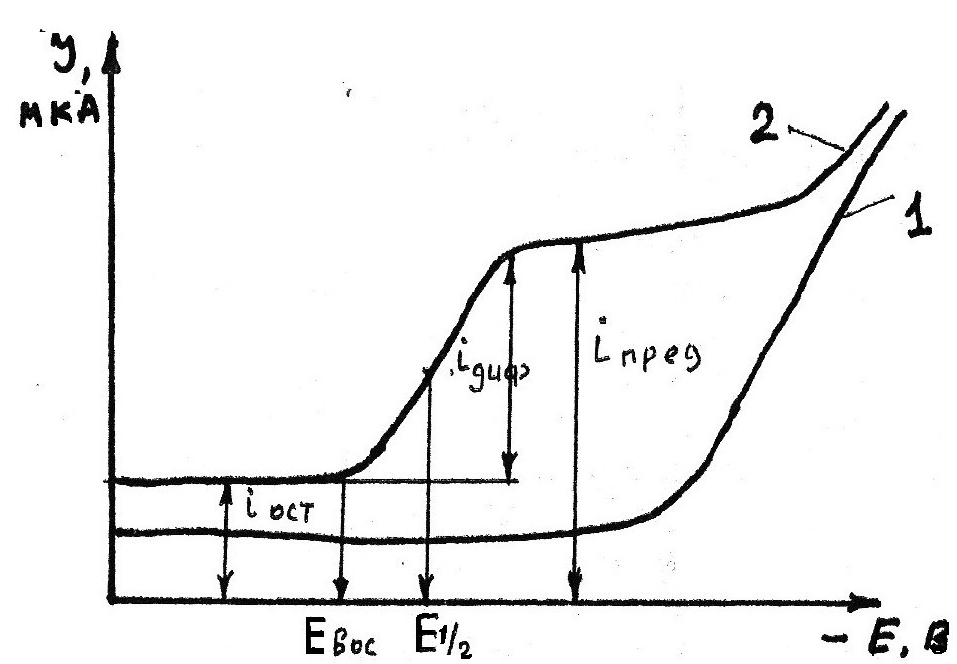
Рис. 4.3. Вольтамперная кривая. 1 - вольтамперная кривая (полярограмма) раствора фонового электролита; 2 - вольтамперная кривая (полярограмма) раствора, содержащего ион, который способен восстанавливаться на катоде. Евос - величина потенциала ртутно-капельного электрода, при котором начинает восстанавливаться вещество, Е 1/2 - потенциал полуволны.
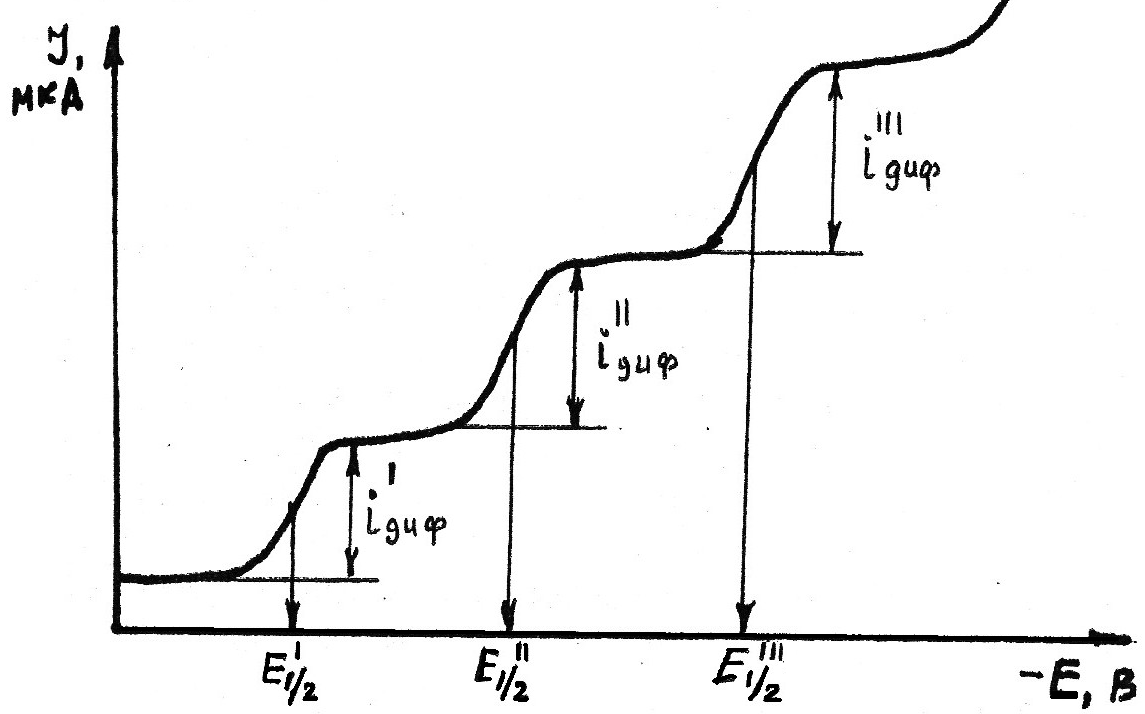
Рис. 4.4. Вольтамперная кривая раствора, содержащего смесь трех восстанавливающихся веществ. iI диф, iII диф, iIII диф - величина диффузионного тока соответственно для 1-го, 2-го и 3-го вещества; ЕI 1/2, ЕII 1/2, ЕIII 1/2 - величина потенциала полуволны соответственно для 1-го, 2-го и 3-го вещества.
При малом напряжении скорость диффузии достаточна для пополнения прикатодного слоя ионами, и процесс подчиняется электрохимической кинетике, т.е. зависит от скорости разряда ионов. По мере увеличения напряжения диффузия начинает тормозить процесс, не подавая достаточного числа ионов к поверхности электрода в единицу времени, и скорость электродной реакции все больше ограничивается диффузией. Hаступает концентрационная поляризация. По мере увеличения напряжения наступает момент, когда все ионы, поступающие к электроду за счет диффузии, немедленно разряжаются, и концентрация их в приэлектродном слое станет постоянной и практически равной нулю. Сколько ионов входит в приэлектродный слой, столько же разряжается. Hаступает предельное состояние концентрационной поляризации. Ток, протекающий в это время в цепи, называют предельным диффузионным током. Следует отметить, что для получения предельного тока необходимо соблюдать условия: один из электродов электролизера должен быть очень мал, концентрация восстанавливающегося вещества в растворе не должна быть слишком большой (10-3 М), т.е. условия должны способствовать достижению предельного состояния концентрационной поляризации.
Сила предельного диффузионного тока зависит от концентрации восстанавливающегося вещества
iд = к С.
При работе с ртутным капельным электродом величина диффузионного тока определяется уравнением Ильковича
i = 605 ∙ n∙ D 1/2 ∙m 3/2∙τ 1/6 ∙C,
где n - количество электронов, участвующих в электродной реакции; D - коэффициент диффузии, см∙с-1; m - количество ртути, вытекающей за одну секунду, мг/с; τ - период капания, с; C - концентрация восстанавливающегося вещества, ммоль/л.
Силе диффузионного тока соответствует подъем полярографической волны, высота которой служит количественной мерой определения концентрации веществ.
Полярографический фон. При полярографическом анализе к исследуемому раствору всегда добавляется посторонний индифферентный электролит — так называемый полярографический фон. Он добавляется, во-первых, для подавления миграционного тока. Фон должен восстанавливаться в области более отрицательных потенциалов, чем определяемый ион (рис 4.3, кривая 1). Катионы фона также движутся к катоду, но они не могут разрядиться (т.к. восстанавливаются при более отрицательном потенциале) и поэтому образуют у поверхности электрода двойной электрический слой. Электрическое поле электрода экранируется этими ионами, и определяемые ионы будут двигаться к электроду только вследствие диффузии. Концентрация фона должна быть значительно больше концентрации определяемого иона.
С другой стороны, добавление фона увеличивает электрическую проводимость раствора, и тем самым уменьшает омическое падение напряжения iR в растворе.
Состав и концентрация фона влияют на коэффициент диффузии определяемого иона, толщину диффузионного слоя, ионную силу раствора, поэтому обычно указывают на каком фоне получена полярограмма. В качестве фона используют часто растворы К2SO4, KNO3, KCl, HCl и др.
Качественная характеристика веществ в полярографическом анализе основана на определении потенциала полуволны Е 1/2. И действительно, если взять какое-либо одно вещество, способное восстанавливаться на ртутном катоде, и, приготовив растворы различной концентрации, получить для каждого из них полярографическую кривую, то все кривые будут симметричны по отношению к среднему потенциалу, называемому потенциалом полуволны (рис. 4.5).
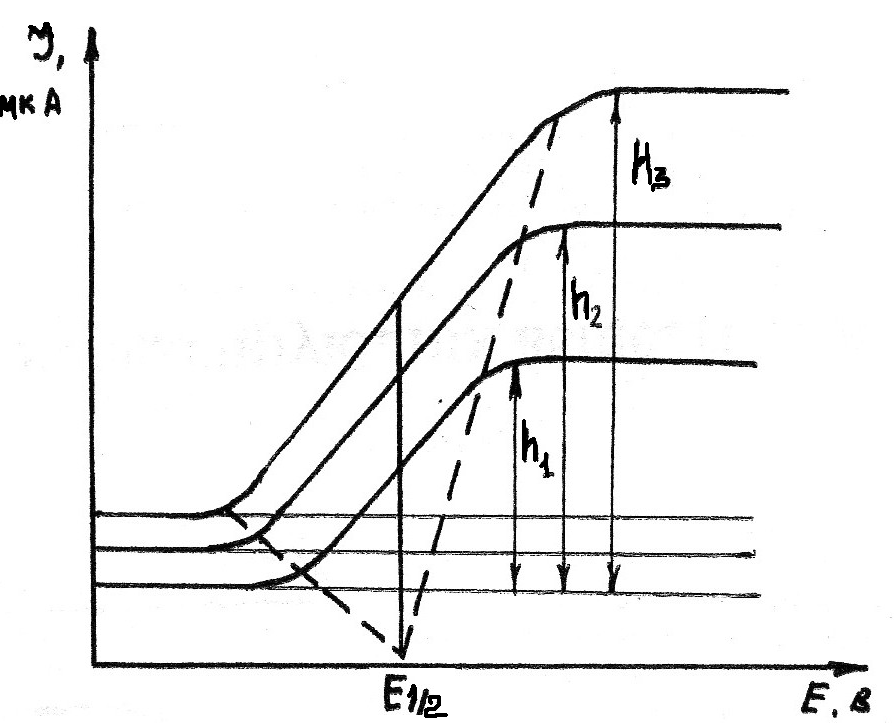
Рис. 4.5. Вольтамперные кривые при различных концентрациях восстанавливающегося вещества
Потенциалом полуволны называется потенциал в точке полярографической кривой, соответствующей половине предельного диффузионного тока и являющейся точкой перегиба кривой. Величина этого потенциала не зависит от концентрации восстанавливающегося вещества и определяется природой вещества и составом фонового электролита.
Количественный полярографический анализ основан на использовании прямой пропорциональной зависимости величины диффузионного тока от концентрации определяемого вещества (см. уравнение Ильковича) iд = кС. Hа полярограмме количественной характеристикой вещества является величина диффузионного тока (высота полярографической волны) (см. рис 4.3 и 4.4).
Количественный анализ проводят методом градуировочного графика и методом добавок.
Метод градуировочного графика. Для построения градуировочного графика снимают полярограммы нескольких растворов определяемого вещества с различной (точно известной) концентрацией. Hа полученных полярограммах измеряют величину диффузионного тока (высоту полярографической волны h, мм) и по этим данным строят график зависимости h = f(C) (рис 4.6), откладывая по оси абсцисс концентрацию определяемого иона, а по оси ординат высоту волны.
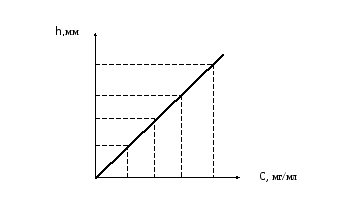 Рис.
4.6. Градуировочный график для определения
концентрации
Рис.
4.6. Градуировочный график для определения
концентрации
В тех же условиях снимают полярограмму раствора определяемого иона неизвестной концентрации, измеряют высоту волны и по градуировочному графику определяют искомую концентрацию.
ПРИМЕЧАНИЕ Общих рекомендаций по выбору способа измерения высоты волны дать нельзя и следует только придерживаться какого-либо одного метода при всех определениях. Измерение высоты полярографической волны можно проводить следующим образом (рис. 4.7).
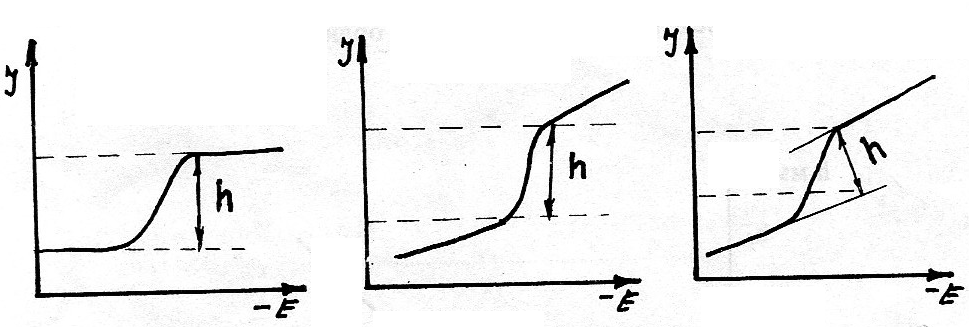
Рис. 4.7. Способы измерения высоты полярографической волны (величины диффузионного тока).
Метод добавок используется когда точный качественный состав исследуемого раствора не известен. Определение проводят следующим образом. Снимают полярограмму исследуемого раствора. Затем добавляют к этому раствору определенное количество стандартного раствора определяемого иона и повторно снимают полярограмму. Hеизвестную концентрацию Сх рассчитывают по формуле

где С(Х) - искомая концентрация определяемого иона, мкг/мл; h1 - высота волны исследуемого раствора, мм; h2 - высота волны после внесения добавки, мм; Cст - концентрация стандартного раствора, мкг/мл;Vст - объем стандартного раствора (добавки), мл; Vx - объем исследуемого раствора, взятый на полярографирование, мл.
