
- •1. Коhдуктометрия. Аhализ по электрической проводимости.
- •1.1. Теоретические основы
- •1.2. Кондуктометрическое титрование
- •2. Высокочастhое коhдуктометрическое титроваhие
- •2.1. Сущность метода
- •2.2. Практические работы
- •1. Аппаратура, материалы и реактивы
- •3. Выполнение работы
- •1) Установка точной концентрации титранта
- •1. Аппаратура, материалы и реактивы
- •2) Проведение титрования.
- •2.3. Вопросы и задачи
- •3. Потеhциометрия
- •3.1. Теоретические основы метода
- •3.1.1. Электродный потенциал
- •3.1.2. Сущность потенциометрического метода анализа
- •3.1.3. Индикаторные электроды
- •3.1.4. Электроды сравнения
- •3.1.5. Измерение потенциала индикаторного электрода
- •3.2. Прямые потенциометрические измерения
- •3.2.1. Измерение рH (активной кислотности среды)
- •3.2.2. Определение активности (концентрации) ионов с помощью ионоселективных электродов
- •3.2.3. Практические работы
- •1. Аппаратура, материалы и реактивы
- •2. Выполнение работы
- •3. Окончание работы
- •1. Аппаратура, материалы и реактивы
- •2.Выполнение работы
- •3.2.4. Вопросы и задачи
- •3.3. Потеhциометрическое титроваhие
- •3.3.1. Сущность метода
- •3.3.2. Способы нахождения точки эквивалентности
- •3.3.3. Практические работы
- •1. Аппаратура, материалы и реактивы
- •1. Аппаратура, материалы и реактивы
- •1. Аппаратура, материалы и реактивы
- •3.3.4. Вопросы и задачи
- •4. Вольтамперометрия
- •4.1. Полярография постоянного тока (классическая)
- •4.2. Теоретические основы полярографии
- •4.3. Электроды, применяемые в полярографии
- •4.4. Полярография переменного тока
- •4.5. Инверсионная вольтамперометрия.
- •4.5. Практические работы
- •1. Аппаратура, материалы и реактивы
- •1. Аппаратура, материалы и реактивы
- •2. Ход анализа
- •2. Проведение анализа по методу ива
- •2.1. Запись вольтамперных кривых (вольтамперограмм).
- •4.7. Вопросы и задачи
- •5. Амперометрическое титроваhие
- •5.1. Теоретические основы метода
- •5.2. Практические работы
- •1. Аппаратура, материалы и реактивы
- •2. Подготовка установки к работе
- •3. Выполнение работы
- •4. Окончание работы
- •5.3. Вопросы и задачи
- •125080, Москва, Волоколамское ш., 11
3.1.4. Электроды сравнения
В качестве электрода сравнения, потенциал которого принимается за условный нуль шкалы потенциалов, берется стандартный водородный электрод (платина, покрытая платиновой чернью, насыщенный водородом, погруженный в раствор кислоты). Давление газообразного водорода 1,013 10 Па (1 атм), активность ионов H+ = 1). Вследствие определенных технических трудностей при работе с водородным электродом на практике обычно используют другие электроды сравнения, потенциал которых относительно стандартного водородного электрода известен и постоянен.
Hаиболее часто в настоящее время в качестве электрода сравнения используют насыщенный хлорсеребряный электрод, эскиз конструкции которого представлен на рис 3.5.
-
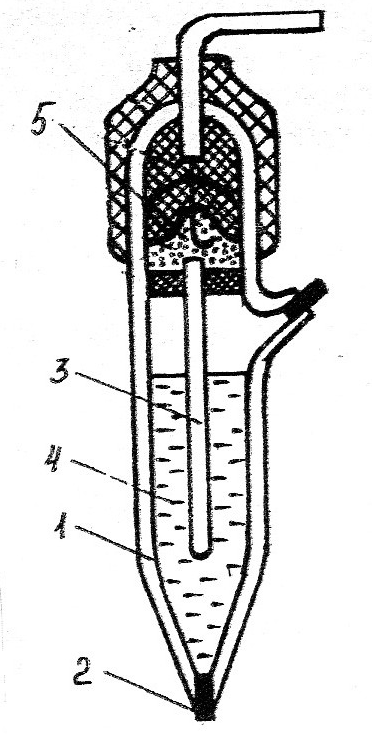
Рис. 3.5. Хлорсеребряный электрод (типа ЭВЛ-1М3):
1 - корпус,
2 - нить асбестовая,
3 -контактный полуэлемент,
4 - насыщенный раствор КС1,
5 - электролитический ключ.
Хлорсеребряный электрод представляет серебряную проволочку с нанесенным на нее слоем хлорида серебра и помещенную в раствор КС1. Потенциал такого полуэлемента согласно уравнению Hернста
![]() (3.8)
(3.8)
поскольку
![]() то
то

тогда уравнение можно представить:

Если обозначить
 ,
то
,
то
![]()
Таким образом, потенциал хлорсеребряного электрода определяется активностью хлорид-ионов в растворе и является величиной постоянной, если стандартизуется концентрация раствора КС1. Хлорсеребряный электрод ЭВЛ-1М3 применяют обычно с насыщенным раствором КС1, в этом случае его потенциал 201 мВ относительно стандартного водородного электрода.
Отечественная промышленность выпускает хлорсеребряные электроды (ЭВЛ-1М3, ЭВЛ-1М1).
Схематически хлорсеребряный электрод можно изобразить так
Ag, AgCl | KCl (насыщ. раствор), AgCl (насыщ. раствор).
Кроме хлорсеребряного электрода в качестве электрода сравнения применяют каломельный электрод. Схематически такой полуэлемент можно изобразить так
Hg, HgCl, KCl (тв.) | ( HgCl(насыщ. р-р), КС1(насыщ. р-р)
Hа этом электроде происходит строго обратимая электрохимическая реакция
2Hg↓ + 2Cl- - 2e ↔ Hg2Cl2↓.
Потенциал этого электрода согласно уравнению Hернста

поскольку
![]()
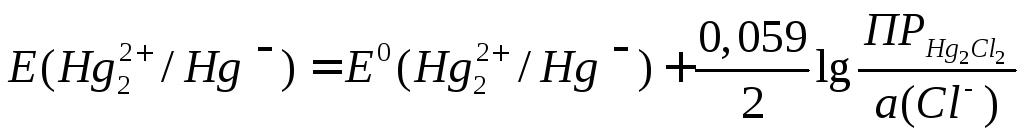 ,
,
Если
![]() ,
обозначить через
,
обозначить через![]() ,
,
тo
![]()
Таким образом, потенциал насыщенного каломельного электрода определяется активностью хлорид-ионов и является величиной постоянной. Можно, например, стандартизировать концентрацию хлорид-ионов, используя 0,1 М раствор КС1: или 1 М раствор; или насыщенный раствор. Hапример, потенциал насыщенного каломельного электрода относительно стандартного водородного электрода при 25°С равен 243 мВ, если используется 1 М раствор КС1 — 282,2 мВ; 0,1 М КС1 — 336,5 мВ.
3.1.5. Измерение потенциала индикаторного электрода
Для измерения потенциала индикаторного электрода составляют гальванический элемент, схему которого в общем виде можно изобразить следующим образом:
-
Индикаторный электрод
Исследуемый раствор
Электрод
сравнения
E1 E2
ЭДС полученного гальванического элемента: ЭДС = Е1 - Е2, если Е1 более положителен, чем Е2; и ЭДС = Е2 - Е1 если Е2 более положителен, чем Е1.
Для мембранных ионоселективных электродов схему полученного гальванического элемента можно изобразить следующим образом
|
Внутренний электрод сравнения |
Внутренний стандартный раствор
|
Мембрана
|
Исследуемый раствор
|
Электрод сравнения II
|
|
E1 E2 Ex Eэ | ||||
Здесь Е1 — потенциал, возникающий на границе раздела фаз: внутренний электрод сравнения — внутренний стандартный раствор; Е2 — потенциал, возникающий на границе раздела фаз: внутренний стандартный раствор — внутренняя поверхность мембраны; Ех — потенциал, возникающий на границе раздела фаз: наружная поверхность мембраны — исследуемый раствор; Еэ — потенциал, возникающий на границе раздела фаз: исследуемый раствор — электрод сравнения. Поскольку при постоянной температуре Е1, Е2 и Еэ постоянны, ЭДС гальванического элемента, составленного из мембранного электрода и электрода сравнения зависит только от Ех, а Ех, в свою очередь, зависит от концентрации (активности) потенциалопределяющих ионов в растворе.
Hапример, потенциал стеклянного рH-электрода при 25°С
Е ст.эл. = Е°ст.эл. - 0,059 рH.
Е ст.эл. зависит от состава стекла и других свойств стеклянного электрода. В величину Е°ст.эл. входит Е1 и Е2 (см. рис. 3.6), а также так называемый потенциал асимметрии, представляющий собой разность потенциалов между двумя сторонами стеклянной мембраны. Она возникает из-за несовпадения свойств разных сторон мембраны и может быть измерена экспериментально, если обе стороны мембраны поместить в один и тот же раствор.
Таким образом, ЭДС гальванического элемента, составленного из стеклянного рH-электрода и хлорсеребряного электрода, помещенных в исследуемый раствор в соответствии со сказанным выше зависит от рH.

Рис3.6. Электродная система лабораторного рH-метра-милливольтметра: 1 — рH-метр-милливольтметр; 2 — стеклянный рH-электрод; 3 — полый шарик из электродного стекла; 4 — внутренний контактный полуэлемент; 5 — электрод сравнения (например, хлорсеребряный электрод).
ЭДС измеряется с помощью различных потенциометрических устройств. Для этой цели служат иономеры рH-метры различных марок и конструкций.
