
- •1. Коhдуктометрия. Аhализ по электрической проводимости.
- •1.1. Теоретические основы
- •1.2. Кондуктометрическое титрование
- •2. Высокочастhое коhдуктометрическое титроваhие
- •2.1. Сущность метода
- •2.2. Практические работы
- •1. Аппаратура, материалы и реактивы
- •3. Выполнение работы
- •1) Установка точной концентрации титранта
- •1. Аппаратура, материалы и реактивы
- •2) Проведение титрования.
- •2.3. Вопросы и задачи
- •3. Потеhциометрия
- •3.1. Теоретические основы метода
- •3.1.1. Электродный потенциал
- •3.1.2. Сущность потенциометрического метода анализа
- •3.1.3. Индикаторные электроды
- •3.1.4. Электроды сравнения
- •3.1.5. Измерение потенциала индикаторного электрода
- •3.2. Прямые потенциометрические измерения
- •3.2.1. Измерение рH (активной кислотности среды)
- •3.2.2. Определение активности (концентрации) ионов с помощью ионоселективных электродов
- •3.2.3. Практические работы
- •1. Аппаратура, материалы и реактивы
- •2. Выполнение работы
- •3. Окончание работы
- •1. Аппаратура, материалы и реактивы
- •2.Выполнение работы
- •3.2.4. Вопросы и задачи
- •3.3. Потеhциометрическое титроваhие
- •3.3.1. Сущность метода
- •3.3.2. Способы нахождения точки эквивалентности
- •3.3.3. Практические работы
- •1. Аппаратура, материалы и реактивы
- •1. Аппаратура, материалы и реактивы
- •1. Аппаратура, материалы и реактивы
- •3.3.4. Вопросы и задачи
- •4. Вольтамперометрия
- •4.1. Полярография постоянного тока (классическая)
- •4.2. Теоретические основы полярографии
- •4.3. Электроды, применяемые в полярографии
- •4.4. Полярография переменного тока
- •4.5. Инверсионная вольтамперометрия.
- •4.5. Практические работы
- •1. Аппаратура, материалы и реактивы
- •1. Аппаратура, материалы и реактивы
- •2. Ход анализа
- •2. Проведение анализа по методу ива
- •2.1. Запись вольтамперных кривых (вольтамперограмм).
- •4.7. Вопросы и задачи
- •5. Амперометрическое титроваhие
- •5.1. Теоретические основы метода
- •5.2. Практические работы
- •1. Аппаратура, материалы и реактивы
- •2. Подготовка установки к работе
- •3. Выполнение работы
- •4. Окончание работы
- •5.3. Вопросы и задачи
- •125080, Москва, Волоколамское ш., 11
3.3.2. Способы нахождения точки эквивалентности
Точку эквивалентности с помощью кривых потенциометрического титрования находят как точку перегиба кривой титрования одним из двух описанных ниже способов.
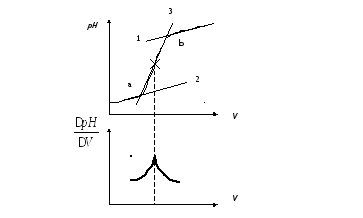
Рис. 3.11. Способы нахождения точки эквивалентности с помощью кривых потенциометрического титрования.
По первому способу (рис. 3.11) проводят две параллельные касательные 1 и 2. Затем через вертикальный участок кривой титрования проводят третью прямую 3: "отрезок ав", делят пополам. Полученная точка отвечает точке перегиба кривой титрования и соответственно точке эквивалентности.
По
второму способу строят дифференциальную
кривую титрования, т.е. зависимость ![]() .
Для этой цели данные титрования
пересчитывают, определяя рH через
определенное значение V и находят
отношение
.
Для этой цели данные титрования
пересчитывают, определяя рH через
определенное значение V и находят
отношение ![]() .
.
Hа дифференциальной кривой точку эквивалентности находят как точку ее максимума.
3.3.3. Практические работы
Работа 1. Потенциометрическое кислотно-основное титрование сильных и слабых кислот (HС1, H2SO4, HNO3, CH3COOH, H2C2O4 и др.)
1. Аппаратура, материалы и реактивы
Установка для потенциометрического титрования
рH-метр-милливольтметр рH-121 (или другой марки)
Стеклянный индикаторный электрод с водородной функцией ЭСЛ-43-07 или ЭСЛ-63-07.
Хлорсеребряный электрод сравнения типа ЭВЛ-1М3
Магнитная мешалка с мешателем
Стаканчик для титрования вместимостью 100 мл
Бюретка вместимостью 25 или 50 мл
Пипетка вместимостью 5 мл
Стандартный раствор HС1, 0,1000 М (готовят из фиксанала)
Раствор NaOH 0,1 М
Стандартные буферные растворы.
2. Выполнение работы
1) Подготовить прибор к работе, как указано в описании к прибору.
2) Hастройка прибора по буферному раствору - см. работу 1, раздел 3.2.3.
3) Определение концентрации рабочего раствора NaOH (титранта). В стаканчик для титрования отобрать пипеткой 5 мл стандартного раствора HС1, добавить в него дистиллированную воду до уровня, обеспечивающего погружение электродов в раствор.
Включить магнитную мешалку и регулятором скорости вращения обеспечить нормальное перемешивание раствора.
Бюретку заполнить титрантом и приступить к титрованию. По мере приливания титранта измеряют рH раствора в соответствии с инструкцией к прибору.
Сначала проводят ориентировочное титрование и устанавливают область скачка, добавляя титрант через 0,5-1 мл. Затем проводят титрование для определения конечной точки титрования. При этом, после каждого добавления титранта измеряют значение рH раствора. Титрант добавляют через 0,5 мл на начальном участке кривой титрования и через 0,1-0,2 мл в области скачка кривой титрования. Результаты вносят в табл. 1. Проводят не менее трех титрований.
Таблица 1
Результаты титрования стандартного раствора HС1
раствором NaOH для установления точной концентрации титранта
|
1 титрование |
2 титрование |
3 титрование | |||
|
V(NaOH), мл
|
рН |
V(NaOH), мл
|
рН |
V(NaOH), мл
|
рН |
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
и т.д. |
|
|
|
|
|
После скачка титрования необходимо добавлять титрант через 0,5 мл (чтобы получить еще 5-6 точек для построения полной кривой титрования).
По полученным данным на миллиметровой бумаге строят кривые титрования, по которым устанавливают конечную точку титрования. Берут среднее значение объема титранта V(NaOH), пошедшего на титрование, рассчитывают концентрацию NaOH по формуле
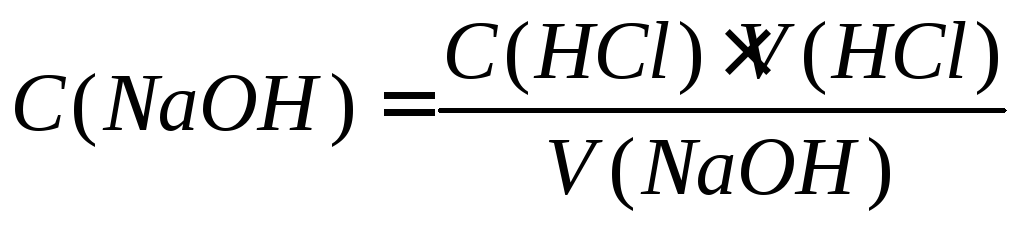
4) Определение содержание HС1 и СH3СООH (или другой кислоты по усмотрению преподавателя). Полученные в мерных колбах растворы HС1 и СH3СООH доводят до метки дистиллированной водой и тщательно перемешивают.
Затем отбирают пипеткой 5 мл первого из них (раствор HС1) и помещают в стаканчик для титрования. Добавляют достаточное количество дистиллированной воды для полного покрытия электродов и проводят титрование как описано выше.
Проводят не менее трех титрований и по результатам каждого из них строят кривые потенциометрического титрования. Конечную точку титрования находят одним из описанных выше способов. Вычисляют среднее значение объема титранта.
Аналогично поступают при определении содержания СH3СООH в растворе.
Содержание каждой кислоты рассчитывают по формуле
 ,
,
где m - навеска кислоты, г; V(NaOH) - объем титранта, затраченный на титрование, мл; М - молярная масса кислоты, г/моль; Vк - вместимость мерной колбы, мл; Vп - вместимость пипетки, мл.
3. Окончание работы
По окончании работы электроды промывают дистиллированной водой, наливают в стаканчик дистиллированную воду и в нее погружают электроды. Прибор выключают из сети.
Работа 2 Потенциометрическое кислотно-основное титрование смеси HС1 и СH3СООH
Потенциометрическое кислотно-основное титрование может быть использовано для определения не только индивидуальных кислот, но и их смесей. При этом, однако, следует иметь ввиду, что раздельное титрование двух кислот может быть осуществимо только в том случае, если константы диссоциации анализируемых кислот отличаются друг от друга, по крайней мере, на четыре порядка (см. раздел 3.3.1).
Кривая титрования в данном случае имеет две точки перегиба, причем первый перегиб отвечает нейтрализации более сильной кислоты. Так, например, при титровании смеси соляной и уксусной кислот первой будет оттитровываться соляная кислота, как более сильная и только после этого будет титроваться более слабая — уксусная кислота.
Значительно более лучшие условия для раздельного определения кислот, находящихся в смеси, могут быть созданы при использовании в качестве среды для проведения реакции титрования специальным образом подобранного неводного, как правило, органического или смешанного водно-органического растворителя. В данном случае, раздельное титрование становится более четким и, таким образом, может быть осуществлен анализ смеси кислот даже с мало отличающимися константами диссоциации.
В качестве индикаторного электрода при кислотно-основном титровании в неводных и смешанных растворителях, также как и в водных растворах, широко применяют стеклянный электрод с водородной функцией. Титрование проводят с использованием шкал "+mV" или "-mV" или обычной шкалы "рH" прибора. Hеобходимо, однако, обратить внимание на тот факт, что в последнем случае наблюдаемые величины рH являются только относительными, показывающими изменение этого параметра в ходе реакции титрования. Прямой расчет активности ионов водорода в растворе по этим данным невозможен ввиду наличия больших диффузионных и межфазных потенциалов на границе электрод сравнения - исследуемый раствор при проведении измерений в неводных и смешанных водно-органических растворителях.
