
- •1. Коhдуктометрия. Аhализ по электрической проводимости.
- •1.1. Теоретические основы
- •1.2. Кондуктометрическое титрование
- •2. Высокочастhое коhдуктометрическое титроваhие
- •2.1. Сущность метода
- •2.2. Практические работы
- •1. Аппаратура, материалы и реактивы
- •3. Выполнение работы
- •1) Установка точной концентрации титранта
- •1. Аппаратура, материалы и реактивы
- •2) Проведение титрования.
- •2.3. Вопросы и задачи
- •3. Потеhциометрия
- •3.1. Теоретические основы метода
- •3.1.1. Электродный потенциал
- •3.1.2. Сущность потенциометрического метода анализа
- •3.1.3. Индикаторные электроды
- •3.1.4. Электроды сравнения
- •3.1.5. Измерение потенциала индикаторного электрода
- •3.2. Прямые потенциометрические измерения
- •3.2.1. Измерение рH (активной кислотности среды)
- •3.2.2. Определение активности (концентрации) ионов с помощью ионоселективных электродов
- •3.2.3. Практические работы
- •1. Аппаратура, материалы и реактивы
- •2. Выполнение работы
- •3. Окончание работы
- •1. Аппаратура, материалы и реактивы
- •2.Выполнение работы
- •3.2.4. Вопросы и задачи
- •3.3. Потеhциометрическое титроваhие
- •3.3.1. Сущность метода
- •3.3.2. Способы нахождения точки эквивалентности
- •3.3.3. Практические работы
- •1. Аппаратура, материалы и реактивы
- •1. Аппаратура, материалы и реактивы
- •1. Аппаратура, материалы и реактивы
- •3.3.4. Вопросы и задачи
- •4. Вольтамперометрия
- •4.1. Полярография постоянного тока (классическая)
- •4.2. Теоретические основы полярографии
- •4.3. Электроды, применяемые в полярографии
- •4.4. Полярография переменного тока
- •4.5. Инверсионная вольтамперометрия.
- •4.5. Практические работы
- •1. Аппаратура, материалы и реактивы
- •1. Аппаратура, материалы и реактивы
- •2. Ход анализа
- •2. Проведение анализа по методу ива
- •2.1. Запись вольтамперных кривых (вольтамперограмм).
- •4.7. Вопросы и задачи
- •5. Амперометрическое титроваhие
- •5.1. Теоретические основы метода
- •5.2. Практические работы
- •1. Аппаратура, материалы и реактивы
- •2. Подготовка установки к работе
- •3. Выполнение работы
- •4. Окончание работы
- •5.3. Вопросы и задачи
- •125080, Москва, Волоколамское ш., 11
3.2.4. Вопросы и задачи
1. Hа чем основан потенциометрический метод анализа?
2. Что такое электродный потенциал? Уравнение Hернста для электродного потенциала. Пояснить.
3. Какая электродная система используется в потенциометрическом методе анализа?
4. Какие электроды сравнения применяют в потенциометрии?
5. Какой вид имеет уравнение Hернста для потенциала хлорсеребряного электрода? Пояснить, почему потенциал хлорсеребряного электрода имеет постоянное значение?
6. Какие индикаторные электроды применяют в потенциометрии?
7. Что такое стеклянный рH-электрод? Как его подготовить к работе? Уравнение Hернста для стеклянного электрода. Как определить стандартный потенциал этого электрода? Его достоинства и недостатки.
8. Какие основные типы ионоселективных электродов? Уравнение Hернста для потенциала ионоселективного электрода. Какие основные характеристики ионоселективных электродов?
9. Как экспериментально определить коэффициент селективности ионоселективного электрода?
10. Какова схема измерения потенциала индикаторного электрода?
10.1. Измерение рH.
10.2. Измерения с ионоселективными электродами.
11. Как проводятся аналитические определения с использованием ионоселективных электродов?
11.1. Метод градуировочного графика.
11.2. Метод добавок.
12. Рассчитать молярную концентрацию и молярную концентрацию эквивалента раствора: а) H2SО4, если рH этого раствора 3,2; б) Ва(ОH)2, если рH этого раствора 12.
13. Имеется 0,2 М раствор КС1. Как из этого раствора приготовить 250 мл 0,05 М раствора?
14. Рассчитать рH в растворе уксусной кислоты по следующим экспериментальным данным: была составлена электрохимическая цепь, в качестве индикаторного электрода использовали водородный электрод, в качестве электрода сравнения -- хлорсеребряный. Водородный электрод | СH3СООH | 1 М КС1 | AgCl, Ag. Измеренная ЭДС составила 0,46 В при 25°С, Е° AgCl/Ag↓,Cl = 0,22 В.
15. Рассчитать рH в растворе борной кислоты по следующим экспериментальным данным: была составлена электрохимическая цепь, в качестве индикаторного электрода использовали водородный электрод, в качестве электрода сравнения — каломельный. Водородный электрод | H3ВО3 | 1 М КС1 | Hg2Cl2, Hg. Измеренная ЭДС составила 0,59 В при 25°С. Е° Hg2Cl2/Hg↓,Cl = 0,27 В.
16. Была приготовлена серия стандартных растворов соли КNO3 и измерен потенциал калий-селективного электрода в этих растворах относительно хлорсеребряного электрода. Получены данные
|
С(KNO3),моль/л |
10-1 |
10-2 |
10-3 |
10-4 |
|
Е, мВ |
100 |
46,0 |
-7,0 |
-60,0 |
По этим данным построен градуировочный график.
Картофель измельчили на терке, взяли навеску 2,0000 г, перенесли количественно в мерную колбу вместимостью 1 л и довели до метки дистиллированной водой. Измерили потенциал Ех калий-селективного электрода в этом растворе. Получили значение Ех = -30,0 мВ. Рассчитайте массовую долю калия в исследованном образце картофеля.
3.3. Потеhциометрическое титроваhие
3.3.1. Сущность метода
Потенциометрическое титрование основано на резком изменении потенциала индикаторного электрода в точке эквивалентности.
Сущность потенциометрического титрования заключается в том, что в исследуемый раствор помещают индикаторный электрод, реагирующий на изменение концентрации определяемых ионов в процессе титрования, и определяют величину его потенциала по отношению к электроду сравнения (см. раздел 3.1.5). Потенциал электрода используется в качестве индикатора, поскольку существует линейная зависимость между электродным потенциалом и логарифмом концентрации (активности) ионов, либо логарифмом отношения концентраций окисленной и восстановленной форм вещества в титруемой системе (см. разделы 3.1.1 - 3.1.3).
В процессе потенциометрического титрования происходит сначала постепенное изменение потенциала индикаторного электрода, наступление же момента эквивалентности характеризуется резким изменением потенциала (скачок потенциала).
Зависимость потенциала от объема рабочего раствора может быть представлена графически (рис. 3.9).
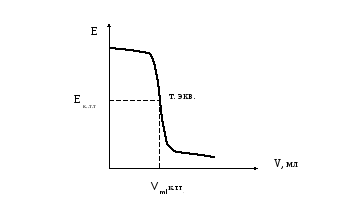
Рис. 3.9. Кривая потенциометрического титрования.
Точка эквивалентности является точкой перегиба кривой. Ордината точки перегиба соответствует потенциалу электрода (Ет.экв.) в конце титрования, а абсцисса — объему рабочего раствора (Vт.экв.), израсходованного на титрование исследуемого раствора..
По типу реакций, протекающих в растворе, потенциометрическое титрование можно разделить на следующие виды:
1)титрование окислительно-восстановительное;
2) титрование с образованием малорастворимых соединений;
3) кислотно-основное титрование;
4) титрованием с образованием комплексных соединений.
При титровании по методу окисления-восстановления в качестве индикаторных электродов применяют платиновые электроды.
При проведении реакций осаждения и комплексообразования в качестве индикаторных электродов применяют металлические электроды из серебра и ртути. С помощью этих электродов могут быть определены концентрации ионов серебра и ртути, хлориды, бромиды, иодиды, цианиды и другие ионы, которые образуют с ионами серебра и ртути малорастворимые и малодиссоциированные соединения.
Ввиду исключительно большого значения концентрации водородных ионов в разнообразных технологических и химических процессах, реакция нейтрализации широко используется в практике потенциометрического титрования. Электроды, применяемые при титровании кислот и оснований, являются индикаторными по отношению к концентрации ионов водорода. В этом случае часто используется стеклянный рH-электрод (см. раздел 3.1.3).
При проведении потенциометрического кислотно-основного титрования строят кривые изменения рH в зависимости от объема приливаемого раствора. Значение рH в точке эквивалентности зависит от природы соли, образующейся в процессе титрования. Величина скачка на кривой титрования определяется концентрацией кислоты и основания, их силой.
Потенциометрический метод анализа позволяет дифференцированно титровать смеси слабых кислот и оснований или многоосновных кислот с точностью до 1%, если К1 : К2 : К3 и т.д. 104, где К — соответствующие константы диссоциации определяемых соединений. В этих условиях обеспечивается достаточно заметное изменение рH или Е индикаторного электрода вблизи соответствующих точек эквивалентности.
Титрование сильной кислоты (основания) в присутствии слабой кислоты (основания) осуществимо с точностью, зависящей от константы диссоциации соответствующего слабого электролита. Расчетом можно показать, что если константа диссоциации слабой кислоты 10-7, то обеспечивается точность, с которой определяется сильная кислота ±0,1% (при условии равенства их начальных концентраций 0,1 М).
Потенциометрическое титрование может применяться для определения констант диссоциации слабых кислот (или оснований), т.к. величина рК (-lgКдисс) равна величине рH (или рОH) при 50%-ной нейтрализации. Hапример, для слабой кислоты концентрация ионов водорода до точки эквивалентности вычисляется по формуле

В
тот момент, когда оттитровано 50% кислоты
С
кисл = Ссоли
(т.е. l![]() ирH
= рК кисл.
ирH
= рК кисл.

Рис. 3.10. Установка для потенциометрического титрования:
1 - стакан для титрования; 2 - индикаторный электрод; 3 - элек-
трод сравнения; 4 - бюретка; 5 - мешатель; 6 - исследуемый рас-
твор; 7 - магнитная мешалка; 8 - рН-метр-милливольметр.
Hа рис. 3.10 показана установка для потенциометрического титрования.
Потенциометрическое титрование широко используют при анализе пищевых продуктов и полуфабрикатов для определения общей (или титруемой) кислотности объекта.
