- •Рекомендации подготовлены Секцией рациональной фармакотерапии внок
- •1. Общие положения
- •1.1. Определение клинической фармакологии. История выделения клинико-фармакологического на-правления в лекарственной тера-пии (мотивация, развитие, транс-формация основных положений)
- •1.2. Клиническая фармакодина-мика (типовые механизмы дей-ствия лекарств, методы оценки эффективности и безопасности фармакотерапии)
- •1.4. Положение о враче клини-ческом фармакологе. Формуляр-ная система и стандарты лечения. Противоречат ли они индивиду-альному подходу к терапии кон-кретного пациента?
- •2. Принципы рациональной фармакотерапии
- •2.1. Определение терапевтиче-ской мишени
- •2.1.1. Следует ли вмешиваться назначением лекарства в течение заболевания?
- •2.1.2. Каких изменений в организме необходимо добиться?
- •2.2. Контроль фармакодинами-ческого эффекта
- •2.2.1. Возможно ли добиться поставленной цели избранным лекарственным средством?
- •2.2.2. Как определить, что цель
- •2.2.3. Обеспечивает ли препарат и путь его введения накопление лекарства в нужном месте в необходимой концен-трации и на достаточный срок?
- •2.2.4. Когда следует прекратить лечение?
- •2.2.5. Какие нежелательные лекарственные реакции (побочные эффекты) могут возникнуть в ходе лечения избранным препаратом?
- •2.2.6. Не превышает ли риск развития нежелательных явлений риска от нена-значения пациенту избранного лекар-ственного средства?
- •2.3. Резистентность к лекар-ственным препаратам, развитие привыкания, синдром отмены
- •2.3.1. Привыкание к препаратам
- •2.3.2. Резистентность к лекарственным препаратам
- •2.3.3. Парадоксальное действие лекарственных препаратов
- •2.3.4. Синдром отмены
- •2.4. Фармакотерапия отдельных групп пациентов (старшие воз-растные группы, беременные)
- •2.4.1. Особенности фармакотерапии в старших возрастных группах
- •2.4.2. Фармакотерапия беременных
- •2.5. Влияние курения и алкоголя на эффективность и безопасность
- •3. Безопасность лекарственной терапии
- •3.1. Что такое нежелательное явление
- •3.2. Побочные действия и проти-вопоказания к назначению ле-
- •3.3 Основные принципы контро-ля безопасности лекарственной
- •4. Оценка эффективности препарата с позиции доказательной медицины
- •4.1. Что такое доказательная медицина
- •4.1.1. Определение
- •4.1.2. Предпосылки для появления доказательной медицины
- •4.2. Уровни доказательности или
- •4.3. Основные правила проведе-ния клинических испытаний
- •4.4. Контроль за проведением
- •5. Клинические рекомендации
- •5.1. Как создаются клинические
- •5.2. Классы рекомендаций
- •5.3. Достоинства и недостатки
- •5.4. Юридический статус реко-
- •6. Что такое качественные лекарственные средства
- •6.1. Объём рынка кардиотроп-ных лекарственных препаратов в
- •6.2. Оригинальные и воспроизве-
- •6.3. Правила оценки эквивалент-ности дженериков
- •6.4. Перечень требований к ка-
- •7. Проблема замены лекарств
- •7.1. Понятие класс-эффекта. Все ли препараты внутри класса
- •7.2. Различные лекарственные формы, замена одной лекар-ственной формы другой
- •7.2.1. Замена препаратов внутри класса
- •7.2.2. Замена одной лекарственной формы другой
- •7.3. Замена оригинального пре-парата дженериком и одного дженерика другим
- •7.3.1. Замена оригинального препарата на дженерик
- •7.3.2. Замена одного дженерика на другой дженерик
- •8. Снижение риска сердечно-сосудистых осложнений – главная цель терапии
- •8.1. Оценка действия современных лекарственных препаратов с пози-ции их влияния на риск сердечно-
- •8.1.1. Антиагреганты и антикоагулянты
- •8.1.2. Препараты, снижающие уровень холестерина
- •8.1.3. Ингибиторы фермента, превращающего ангиотензин
- •8.1.3.1. Сердечная недостаточность
- •8.1.3.2. Острый инфаркт миокарда
- •8.1.3.3. Хроническая неосложненная ибс
- •8.1.3.4. Артериальная гипертония
- •8.1.3.5. Высокий риск сердечно-сосудистых
- •8.1.3.6. Сахарный диабет
- •8.1.3.7. Высокое нормальное ад
- •8.1.4. Антагонисты рецепторов ангиотензина II (ара)
- •8.1.4.1. Острый инфаркт миокарда
- •8.1.4.2. Сердечная недостаточность
- •8.1.4.3. Высокое нормальное ад
- •8.1.4.4. Артериальная гипертония
- •8.1.4.5. Высокий риск сердечно-сосудистых
- •8.1.4.6. Вторичная профилактика инсульта
- •8.1.4.7. Нарушенная функция почек
- •8.1.5. Бета-адреноблокаторы
- •8.1.5.1. Острый инфаркт миокарда
- •8.1.5.2. Стабильная стенокардия
- •8.1.5.3. Хроническая сердечная
- •8.1.5.4. Артериальная гипертония
- •8.1.5.5. Сахарный диабет
- •8.1.6. Диуретики
- •8.1.6.1. Артериальная гипертония
- •8.1.6.2. Сердечная недостаточность
- •8.1.6.3. Вторичная профилактика инсульта
- •8.1.7. Антагонисты кальция
- •8.1.7.1. Острый инфаркт миокарда
- •8.1.7.2. Стабильная стенокардия
- •8.1.7.3. Хроническая сердечная
- •8.1.7.4. Артериальная гипертония
- •8.1.8. Нитраты
- •8.1.9. Прочие группы препаратов
- •8.1.9.1. Препараты метаболического
- •8.1.9.2. Антиангинальные препараты
- •9. Фармакоэкономический анализ
- •О неблагоприятных побочных реакциях лекарственных средств, средств традиционной медицины и биологически активных добавок
- •Раздел 1. Терминология
- •Раздел 2.
- •Раздел 3.
- •Раздел 4.
7.3. Замена оригинального пре-парата дженериком и одного дженерика другим
7.3.1. Замена оригинального препарата на дженерик
Под дженериком, как отмечалось выше, по-нимают препарат, содержащий то же самое действующие вещество, что и оригинальный, но отличающийся от него по технологии производ-ства, составу наполнителей, содержанию при-месей и т.д. Существует термин «дженериче-ская замена», под ней понимают отпуск лекар-ственного препарата, коммерческое название которого отличается от выписанного врачом, а химический состав и дозировка действующего начала – идентична. Считается, что тщатель-ный контроль за производством препарата и доказательства его биоэквивалентности ориги-нальному препарату (фармакокинетической эк-вивалентности) в значительной степени обеспе-чивают идентичность терапевтических свойств. На этом утверждении строится доктрина про-движения дженериков, которая утверждает, что если дженерик зарегистрирован и разрешен к применению в клинике соответствующими го-сударственными органами, то врач может быть уверен в идентичности его терапевтических свойств оригинальному препарату. При этом подразумевается, что дженерик доказал свою биоэквивалентность оригинальному препарату.
Однако данные биоэквивалентности суще-ствуют (как оказалось) не для всех дженери-ков, а если они и существуют, то не являются доступными. Кроме того, понятие биоэквива-лентности – достаточно условное, ее критерии нередко меняются, в настоящее время они от-личаются в разных странах. Но даже при до-казанной биоэквивалентности, как упомина-лось выше, если значения биоэквивалентности смещены к крайним значениям, существует ре-альная возможность различий в содержании
препарата при использовании дженерика, а, значит, и различий в эффективности.
Вследствие названных выше причин можно утверждать, что далеко не все присутствующие на рынке дженерики обладают терапевтиче-ской эквивалентностью с оригинальными пре-паратами.
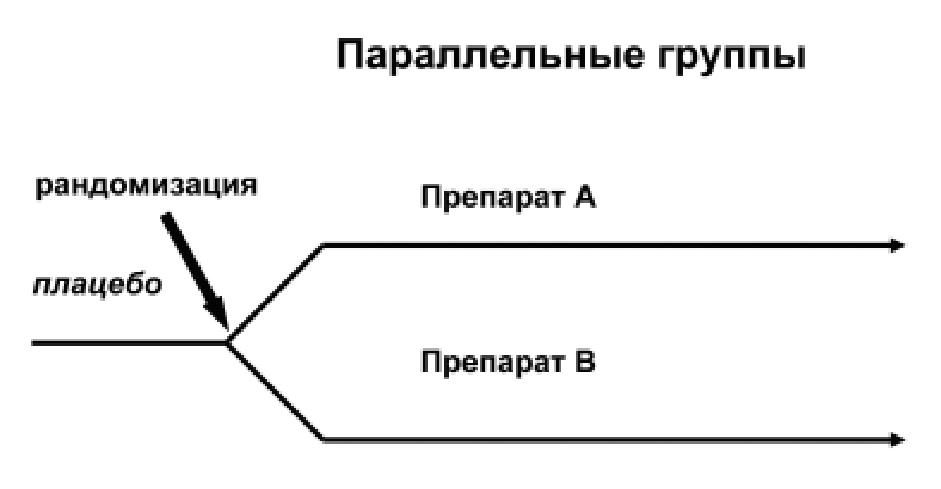
Представляется необходимым для наибо-лее часто используемых дженериков прово-дить ограниченные, но строго спланированные клинические испытания. Примерный протокол такого испытания представлен на рисунке (см. схему 1).
Схема 1
Дизайн клинического исследования
Сравнительные рандомизированные клини-ческие исследования, проведенные с дженери-ками , крайне немногочисленны. Они, однако, явно демонстрируют неодинаковость разных дженериков в отношении терапевтической экви-валентности оригинальному препарату. В ряде случаев выявлено почти полное соответствие эффективности дженерика оригинальному пре-парату (например, оригинального амлодипина и одного из дженериков амлодипина), в дру-гих, напротив, отмечены статистически досто-верные различия в выраженности эффекта по сравнению с оригинальным препаратом (на-пример, оригинального бисопролола и одного из дженериков бисопролола).
Для некоторых дженериков описаны по-бочные действия, неизвестные для ориги-нального препарата . По-видимому, это связа-но с различиями в технологии изготовления и/или наличия неодинаковых инертных ин-гредиентов и наполнителей. Это касается в первую очередь нежелательных явлений со стороны желудочно -кишечного тракта. Так, при использовании некоторых дженериков симвастатина отмечено обострение течения язвенной болезни желудка, четко связанное с приемом препарата. Это побочное действие не описано при применении оригинального препарата. Аналогично, при применении дже-нерика лозартана отмечено возникновение острого гастродуоденита. Примеры ряда ис-следований по сравнительному изучению эф-фективности и переносимости оригинальных препаратов и их дженериков представлены в приложениях 2-6.
Сложилось стойкое мнение, что сравни-тельные исследования с дженериками про-
31
Рекомендации по рациональной фармакотерапии больных сердечно-сосудистыми заболеваниями

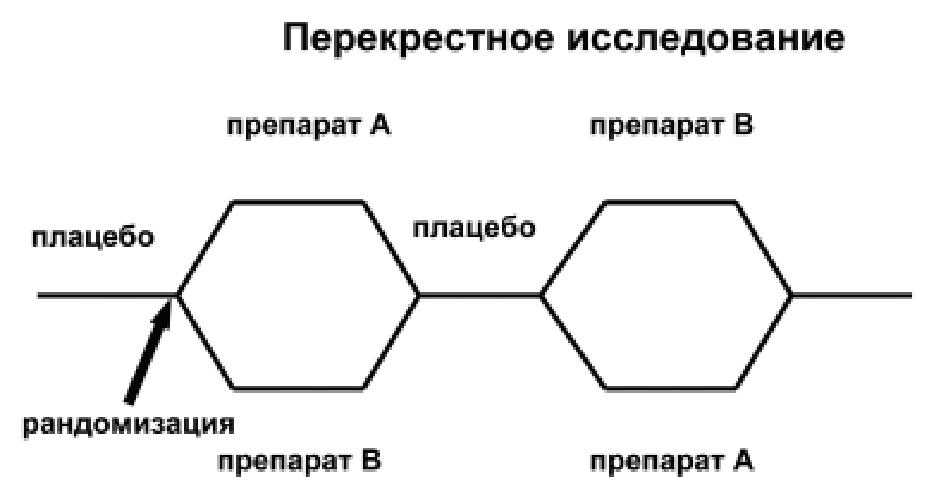
водятся исключительно в России, однако это далеко не так. Исследования по изучению те-рапевтической эквивалентности за рубежом также проводятся, примером может служить исследование INTER-ARS, в котором терапев-тическая эквивалентность дженерика аторва-статина (Аторис, компания KRKA) изучалась и была доказана в многоцентровом РКИ, про-веденном в трех странах Европы: Словении, Польше и Чешской Республике. Следует от-метить, что данное РКИ было выполнено в со-ответствии с иной схемой протокола (см. схему 2), когда на основании рандомизации формируются две группы: контроль и активное лечение. Однако такая схема подходит для длительно-го исследования и требует включения доста-точно большого количества пациентов.
Схема 2