
Марини. Медицина критических ситуаций
.pdf571
паратами. Признаки увеличенного внутричерепного давления (например, сонливость, отек диска зрительного нерва, паралич третьей пары черепных нервов, гемипарез) должны вы- звать подозрение на отек мозга или гидроцефалию, что проверяется КТ-сканированием. Гипонатриемия должна навести на мысль о синдроме неадекватной секреции АДГ.
Пациенты с трепанацией черепа в раннем послеоперационном периоде особенно подвержены развитию менингита, вызванного Staphylococcus spp. и грамотрицательными бактериями.
Pneumococcus ответствен более чем за 90 % поздних менингеальных инфекций у больных с постоянной посттравматической утечкой спинномозговой жидкости.
Септическую мозговую эмболию (например, обусловленную подострым бактериаль- ным эндокардитом) и параменингеальную инфекцию (эпидуральный абсцесс, абсцесс мозга, синусит и средний отит) часто путают с менингитом, потому что они имеют сход- ную семиологию и плеоцитоз в ликворе.
Повышенная параспинальная чувствительность, сопровождаемая корешковой болью или слабостью, должна наводить на мысль об эпидуральном абсцессе. Более чем в 50 % таких случаев возбудителем служит Staphylococcus au-reus. Абсцесс мозга чаще всего яв- ляется полимикробной инфекцией, обусловленной Staphylococcus spp., Streptococcus spp. и анаэробными микроорганизмами. Абсцесс может развиваться вследствие распространения инфекции из синусов и среднего уха, гематогенным путем (инфицированные диализные шунты, сердечные клапаны) или в результате давнего гнойного заболевания легких (абс- цесс, бронхоэктаз). Абсцесс мозга редко путают с неосложненным бактериальным менин- гитом, потому что он обычно сопровождается меньшей интоксикацией и в меньшей сте- пени вызывает очаговые неврологические проявления.
Для лечения следует применять пенициллин вместе с хлорамфениколом или метро- нидазолом, если результаты посевов не указывают на необходимость другой схемы. В оп- ределенных случаях может быть показан цефалоспорин третьего поколения или антиста- филококковые препараты. Хирургическое вмешательство в принципе осуществляется при сдавлении жизненно важных структур мозга, в случаях, когда не удается медикаментозное лечение, и при высокой вероятности злокачественного новообразования.
ИНФЕКЦИИ МЯГКИХ ТКАНЕЙ Большинство инфекций кожи, выявляемых в ОИТ, обусловлено многими микроорга-
низмами, так как они являются результатом ран, полученных при хирургических или слу- чайных травмах, пролежней, терапевтических или нелегальных пункций сосудов или по-
тому что они встречаются у пациентов с пониженной иммунной защитой и сосудистой недостаточностью (особенно при диабете). Наиболее опасные из этих инфекций газообра- зующие, которые обычно развиваются в условиях ишемии тканей или обширного загряз- нения. Факторы риска для газообразующей инфекции включают диабет, ранения нижних конечностей, заболевания периферических сосудов и открытую травму. Газообразующей инфекцией могут быть классическая газовая гангрена с мионекрозом или вызванные сме- шанными микроорганизмами (синергистами) некротические процессы в мягких тканях. Оба заболевания распространяются с тревожной быстротой. В большинстве случаев газо-
образующие инфекции мягких тканей бывают вызваны смесью аэробных и анаэробных микроорганизмов (грамположительными кокками и грамотрицательными палочками). Классическая клостридиальная гангрена встречается гораздо реже. Успешный исход ле- чения зависит от оперативности терапевтического или хирургического вмешательства. Необходимо получить посевы крови, а также материала биопсии или аспирации инфици- рованной ткани. При выборе антибиотиков следует руководствоваться результатами окра- ски по Граму и результатом посева, а эмпирические режимы обычно включают пеницил- лин и пенициллин G с аминогликозидом или без него. Чтобы остановить процесс, часто требуется широкая хирургическая обработка раны или ампутация. Нужны также иммуни- зация против столбняка и введение анатоксина, если это не было сделано раньше.
572
Большинство инфекций мягких тканей в области внутривенных инъекций и стояния катетеров — результат попадания Streptococcus spp. и Staphylococcus spp., существующих на коже пациентов. В ОИТ причиной инфицирования могут быть грамотрицательные ви- ды. Удаление катете-Ра, применение теплых компрессов и введение анальгезирующих средств и антибиотиков обычно быстро излечивают такие инфекции. В качестве антибио- тика обычно применяют пенициллин, устойчивый к пенициллиназе. В менее тяжелых случаях приемлема пероральная терапия. Если вероятно наличие стафилококков, устой- чивых к метициллину, для начальной терапии подходит ванкомицин.
Токсикогенный Staphylococcus aureus обусловливает уникальный набор проблем. Редкое, но смертельное осложнение, вызываемое стафилококковым токсином TSST-1, — синдром токсического шока. Он был впервые описан у менструирующих женщин, исполь- зующих тампоны с высокой абсорбцией, но, несомненно, может встречаться и у мужчин.
Источником токсина могут служить инфекции травматических или послеоперационных ран, даже когда сама хирургическая рана не выглядит инфицированной. Синдром токси- ческого шока нужно подозревать у любого больного с триадой, включающей лихорадку, эрите-матозное (в конечном счете, шелушащееся) высыпание и шок. Поэтому токсический шок можно спутать с "пятнистой лихорадкой Скалистых гор", синдромом Стивенса— Джонсона (Stevens—Johnson), лептоспирозом, корью или сыпью из-за лекарственного средства. Так как синдром токсического шока возникает под влиянием токсина, часто вы- севается культура Staphylococci, но посев крови обычно отрицательный. Лечение включа- ет соответствующий дренаж (хирургический дренаж ран, удаление тампонов), антистафи- лококковыё антибиотики (вначале лучше всего ванкомицин) и общую поддерживающую терапию жидкостями, кислородом и вазопрессорами.
ИНФЕКЦИИ У ПАЦИЕНТОВ С НАРУШЕННЫМ ИММУНИТЕТОМ ОБЩИЕ СООБРАЖЕНИЯ
Мало клинических состояний представляет такие диагностические трудности, как лихорадка у больного с нарушенным иммунитетом. Поскольку у таких больных часто
ухудшены функции многих органов и систем и они подвергаются лечению токсичными химиотерапевтическими средствами, возможная этиология охватывает широкий диапазон неинфекционных и инфекционных агентов. Часто одновременно существует много при- чин. У пациентов этой категории имеется первичный дефицит Т-лимфоцитов, В-клеток (антител) или функции гранулоцитов (фагоцитов). Знание типа иммунного дефицита по- зволяет сузить дифференциальный диагноз. Например, нарушения Т-клеток предрас- полагают больных к инфицированию вирусами и грибами, в то время как нарушения В- клеток и гранулоцитопения служат предпосылками к бактериальному инфицированию. В отсутствие гуморального иммунитета и при поражении функции Т-клеток легко возникает инфекция, но самую большую угрозу жизни представляет глубокая нейтропения (менее 1000 гранулоцитов в 1 мм3). Лихорадка в этом случае требует неотложного вмешательст- ва, и исход во многом зависит от быстрейшего начала соответствующей терапии. К сожа- лению, постановка конкретного диагноза часто затруднена, поскольку у больных данной группы нагноение возникает не всегда, как другие локальные признаки воспаления. Неза-
висимо от типа иммунного дефицита или участка воспаления патогенным микроорганизмом является чаще всего тот, ко-
торый обычно находится в организме "хозяина". Инфекция может развиваться на любом участке но есть несколько проблем, характерных для больных с нейтропенией.
Они включают инфекции слизистой оболочки (например, воспаление слизистой обо- лочки, воспаление десен), "первичную бактериемию", флегмоны мягких тканей (напри- мер, параректальный абсцесс) и атипичную легочную инфильтрацию.
ИНФИЛЬТРАТЫ ЛЕГКИХ
573
Проблема диагностики легочных воспалительных инфильтратов у больных с нару- шенным иммунитетом сложна, и здесь могут быть перечислены только отдельные сущест- венные особенности. У лихорадящих больных с нейтропенией следует прежде всего запо- дозрить инфекцию, однако существуют и другие частые причины легочных инфильт- ратов: прогрессирование первичного опухолевого процесса, кровотечение, отек легких, реакции "трансплантат против хозяина", радиация и реакции на лекарственные средства.
При нарушениях иммунной системы фактически любой микроорганизм может вызвать пневмонию, однако клиницист часто бывает в состоянии объединить знание иммунного дефекта, эпидемиологии, клинических и лабораторных данных, чтобы cyзить спектр веро- ятных возможностей и сформулировать логический подход. Вначале некоторый ключ к пониманию природы возбудителя может дать основное заболевание. Например, СПИД, при котором преобладает проблема хелперов Т-лимфоцитов, настолько предрасполагает больного к инфекции, вызванной Pneumocystis, микобактериями, грибковым вирусом и цитомегаловирусом, что к предполагаемому диагнозу часто приводят только рентгеногра- фия и клиническая картина. Тем не менее спектр возможностей остается широким, пока причина не подтверждена биопсией или исследованием жидкости. Не менее важно рас- смотреть эпидемиологические факторы.
Продолжительность госпитализации перед развитием пневмонии также влияет на микробиологию: например, инфекции, вызванные Pseudomonas spp., Candida spp. и Aspergillus spp., чаще всего развиваются через много дней после поступления в стационар, в то время как вероятность рутинного (внебольничного) патогенеза убывает после первых нескольких дней стационарного лечения. Реципиенты почечного трансплантата необы-
чайно склонны к инфекции цитомегаловирусом, Herpes simplex, Cryptococcus, Aspergil-lus
и Pneumocystis carinii в период максимального подавления Т-клеток, т. е. от 1 до 6 мес по- сле операции. Больные с нейтропенией очень восприимчивы к грамотрицательным бакте- риям и грибковым инфекциям (Aspergillus и Мисоr становятся частыми причинами инфи- цирования, если нейтропения держится более 3 нед). Параллельное инфицирование двумя или большим числом микроорганизмов встречается обычно у больных СПИДом и У тех, кто перенес трансплантацию почек или костного мозга. Цитомегаловирус, Ciyptococcus и Nocardia часто дают рост культуры вместе с другими патогенными микроорганизмами (обычно присутствуют цитомегаловирус и Pneumocystis). У пациентов с подавленным им- мунитетом часто встречаются суперинфекции, особенно во время продолжительной ней- тропении и длительной терапии высокими дозами иммунодепрессантов.
Некоторые клинические проявления стоит отметить особо. Legionella, Strongyloides и Cryptosporidium могут вызвать диарею и легочную инфильтрацию.
Одновременная инфильтрация легких и кожи может быть результатом инфицирова-
ния Pseudomonas, Aspergillus, Candida и Varicella zoster.
Заболевания печени и легких ассоциируются с инфекциями, обусловленными цито- мегаловирусом, Nocardia, микобактериями и некротизирующими бактериями (псевдомо- нады и стафилококки).
Оценка легочных инфильтратов и терапевтический подход К сожалению, эти проблемы порой не поддаются простым методам диагностики, и
нередко становится необходимой биопсия ткани. Заболевание может протекать очень бы- стро, поэтому терапия должна иметь широкую направленность, пока не установлена его специфическая этиология. Чтобы эффективно бороться с угрожающим жизни легочным процессом у больного с нарушенным иммунитетом, нужно ответить на два важных вопро- са. Во-первых, если процесс представляется инфекционным, а его течение определить не- легко, должен ли быть установлен точный диагноз или достаточно эмпирической тера- пии? Во-вторых, если требуется точный диагноз, какова наиболее рациональная методика помощи ослабленному пациенту в критическом состоянии? Эти вопросы решаются неод- нозначно и вызывают немалые споры. В принципе подход должен меняться в зависимости
574
от тяжести заболевания, скорости его прогрессирования, состояния коагуляции и легоч- ной вентиляции, достоверности вспомогательной информации и опыта персонала, вы- полняющего специфические инвазивные процедуры. Если диффузную картину на рентге- новском снимке грудной клетки нельзя с уверенностью отличить от отека легких, перед
переходом к инвазивным диагностическим приемам можно предпринять краткую оценку диуреза. Даже когда пневмонит очевиден, проницательный клиницист рассматривает по- тенциальное воздействие гипопротеинемии и гидростатических сил на плотность ин- фильтратов. Если нет противопоказаний, неплохо придерживаться принципа "диурез до биопсии". Очевидно, что по возможности следует начинать с анализа мокроты. В этой си- туации транстрахеальная аспирация и трансторакальная пункционная биопсия — опасные и малополезные процедуры, и от них, вероятно, нужно отказаться.
Вспомогательные данные Как единственный рентгеновский снимок грудной клетки на том или ином этапе бо-
лезни, так и скорость, с которой прогрессирует заболевание, могут обеспечивать полез- ную диагностическую информацию. Очаговые тени — сливные или разобщенные — наи- более характерны при бактериальной инфекции, микозе, кровотечении или тромбоэмбо- лии. С другой стороны, двусторонние "внутритканевые" инфильтраты указывают на пере- грузку объемом жидкости, Pneumocystis, микобактерии или вирус. Однако тяжелые легоч- ные инфекции могут и не вызвать пневмонических очагов, особенно у больных с нейтро- пенией. Молниеносное развитие свидетельствует о бактериальном процессе или неинфек- ционной этиологии (перегрузка жидкостью, эмболия, ОРДС). Наоборот, процесс, разви- вающийся не менее 1—2 нед, наводит на мысль о микобактериальном, паразитарном или системном грибковом заболевании. Другой важный признак — выраженность гипоксе- мии. Внезапные угрожающие жизни падения напряжения кислорода в артериальной крови типичны для бактериальных, вирусных и вызываемых Pneumocystis инфекций, но не так характерны для менее динамичных грибковых и микобактериальных процессов.
Исследование жидкости из внелегочных источников может заставить врача выдви- нуть в качестве предполагаемого диагноза инфильтрат легких. Обнаружение в спинномоз- говой жидкости Cryptococcus еще не доказывает, что инфильтраты, видимые на рентге- новских снимках, связаны с этим возбудителем. Тем не менее в соответствующей ситуа- ции плевральная жидкость должна быть получена, исследована и направлена на посев, а кал следует послать в лабораторию для обнаружения паразитов. Исследование культуры крови, бесспорно, важно, а реологические пробы редко вовремя обеспечивают нужную информацию.
Бронхиальный секрет и ткань легких
Убольных с нарушенным иммунитетом мокрота выделяется реже, чем у обычных пациентов, особенно когда присутствует нейтропения. Тем не менее, если мокроту можно получить, ее внимательное исследование может выявить источник заболевания. Помимо окрашивания по Граму, ценную информацию дают метод прямой иммунофлюоресценции для выявления Legionella, фазовый контраст или цитологическая подготовка для обна- ружения бластомикоза, кислотоустойчивое окрашивание при подозрении на микобакте- рии и Nocardia и окрашивание с серебром на Pneumocystis и грибковые элементы. Кон- центрированные образцы мокроты могут выявить Strongyloides.
Убольных СПИДом имеется такое обилие микроорганизмов Pneumocystis, что они содержатся в откашливаемой мокроте. К сожалению, для выращивания культур многих патогенных микроорганизмов требуется от нескольких дней до недель, и почти повсеме-
стная практика раннего применения антибиотиков с широким спектром действия обычно затрудняет диагноз.
Необходимость биопсии
575
Если после анализа клинических данных и лабораторных результатов определенный диагноз не установлен, следующий шаг должен определяться весомостью клинического подозрения и безотлагательностью правильного диагноза. В большинстве случаев первой инвазивной процедурой должна быть бронхоскопия. Хотя коагулопатия и потребность в
искусственной вентиляции легких служат умеренными противопоказаниями к биопсии щипцами, лаваж и осторожное применение щетки не опасны, если заранее вводят тромбо- циты и(или) факторы недостаточности свертывающей системы крови. Бронхоскопия при- носит разные результаты в зависимости от течения болезни, выбора времени для осуще- ствления процедуры и метода ее проведения. Например, когда используются все методы отбора проб (биопсия, щетка и лаваж), определенный диагноз может быть установлен приблизительно в 50 % случаев. В отдельных случаях, например у больных СПИДом, эф- фективность значительно выше.
Открытая биопсия легкого часто откладывается из-за ее болезненности и высокой стоимости. Фактически открытая биопсия 20—40-минутной длительности, проводимая на ранней стадии заболевания, хорошо переносится, безопасна и часто полезна для диагно- стики. Эта процедура — наиболее надежное средство получения ткани для гистологиче- ского диагноза при наличии эффективного гемостаза у пациентов с высоким риском кро- вотечения. Торакоскопия с использованием видеокамеры — другой плодотворный подход для пациентов с хорошим гемостазом.
Стоимость открытой биопсии следует рассматривать в сравнении с высокой стоимо- стью эмпирической терапии антибиотиками. Четыре, пять или шесть комбинаций лекар- ственных средств дорого стоят, а, кроме того, некоторые из обычно применяемых препа- ратов (триметоприм и сульфаметоксазол [ТМР-SMX], аминогликозиды и амфотерицин) токсичны для почек и костного мозга.
Какова бы ни была ценность открытой биопсии легкого, предпринимаемой на ранней стадии болезни, она явно менее ценна после применения в течение длительного периода антибиотиков широкого спектра действия. В таких случаях маловероятно, чтобы открытая биопсия добавила достаточно новую информацию, которая перевесила бы присущие этой процедуре недостатки.
Невозможность определить конкретную этиологию воспаления не служит оправда- нием неопределенно долгой эмпирической терапии антибиотиками. Конкретный диагноз позволяет не только рационализовать антибиотики, но также упростить терапию больно-
го, которого лечат многочисленными лекарственными средствами. |
Обычно этот про- |
цесс принимает форму исключения из назначенной комбинации |
наименее эффектив- |
ного или наиболее токсичного антибиотика каждые 1—2 дня. Сокращение антибиотиков часто откладывается до прекращения гранулоцитопении.
Даже пока больной получает многонаправленные антибиотики, клиницист должен помнить о возможности "суперинфекции" новым или устойчивым микроорганизмом. Бо- лее того, если состояние пациента не улучшается при определенной терапии, направлен- ной против известного возбудителя, обычно это означает, что присутствует второй микроорганизм.
Например, больные СПИДом с подтвержденной Pneumocystis пневмонией, которые не реагируют на триметоприм, часто имеют сопутствующую инфекцию цитомегаловиру- сом. Если определенный диагноз поставить не удалось, а врач вынужден выбрать режим лечения, необходимо иметь в виду, что Legionella и Pneumocystis carinii входят в число наиболее опасных для жизни распространенных патогенных микроорганизмов. Для па-
циента с нарушенным иммунитетом без диагноза в качестве начального лечения часто выбирают цефа-лоспорины третьего поколения и аминогликозид или хинолон плюс эритромицин или доксициклин и триметоприм и(или) сульфаметоксазол. Если преоб- ладают метициллинустойчивые стафилококки, часто добавляют ванкомицин или заменя- ют им другой антибиотик. В больницах, где главную проблему составляют грибковые инфекции, курс амфотерицина начинают очень рано. Применение антибиотиков ультра-
576
широкого спектра действия (типа карбапенема) значительно упрощает начальную тера- пию, но такие препараты обладают своим собственным набором проблем, связанных с их высокой стоимостью и продукцией полирезистентных бактерий.
Внелегочные участки инфицирования Чаще всего нейтропения является ятрогенным осложнением противоопухолевой хи-
миотерапии. Она значительно нарушает способность организма "хозяина" поддерживать целостность тканей, имеющих быстрый клеточный оборот (например, стенок кишечника и слизистых оболочек десен и прямой кишки). Поэтому не удивительно, что диффузный некротический колит, аноректальный панникулит и тифлит (серьезная бактериальная ин- фекция слепой кишки, напоминающая аппендицит) — частые источники инфекции. На- рушения обычно не поврежденного наружного покрова внутривенными катетерами, хи-
рургическими разрезами или пролежнями также открывают двери для проникновения бактерий. Поэтому физикальное обследование лихорадящих больных с нейтропенией должно, как правило, включать участки введения катетера, десны и параректальную об- ласть. Отсутствия выраженной болезненности при осторожной пальпации краев анального отверстия обычно достаточно, чтобы исключить его как место инфицирования. Все же часто источник бактериемии или сепсиса найти не удается.
ОБЩИЕ ПРИНЦИПЫ Выживание больных с нейтропенией зависит от ранней эмпирической терапии не-
сколькими антибиотиками, эффективными против инфицирующего микроорганизма. Наи- более распространенные микроорганизмы включают грамотрицательные виды (особенно
Pseudomonas spp.), Staphylococcus spp. и грибы (например, Aspergillus spp. и Candida spp.).
Больные с установленным нарушением клеточного иммунитета более подвержены инфи- цированию Pneumocystis carinii или Candida. Когда участок инфекции ясно определен, должны быть выбраны антибиотики против вероятных микроорганизмов. Однако пациен- ты с нейтропенией часто утрачивают локальные признаки воспаления, и в большинстве случаев вероятный источник инфицирования найти невозможно даже при тщательном ис- следовании. В таких случаях должны быть получены культуры крови, мочи, мокроты и повреждений кожи. Даже если гной в моче отсутствует, ее микроскопическое исследова- ние может выявить большое количество микроорганизмов. Должно быть начато лечение антибиотиками с широким спектром действия, включая соответствующую форму пени- циллина (например, тикарциллин) или цефалоспорин третьего поколения плюс аминогли- козид. Эмпирическое применение ванкомицина не оправдано, если только пациент не имеет аллергии к пенициллину или существует причина подозревать метициллин- устойчивую стафилококковую инфекцию. Во многих отделениях начинают вводить амфо- терицин, когда высокая температура сохраняется у пациента более 72 ч после начала ле- чения антибиотиками с широким спектром действия.
ИНФЕКЦИИ ПОСЛЕ СПЛЕНЭКТОМИИ Тяжелые инфекции после спленэктомии обычно вызваны инкапсулированными бак-
териями (например, Pneumococcus, Salmonella, Haemophilus). Потеря фагоцитарной функ- ции селезенки допускает беспрепятственное размножение бактерий. Аналогичным обра-
зом утрата фагоцитарной функции печени у больных циррозом делает их подверженными неуправляемой инфекции. Два необычных патогенных микроорганизма, обнаруживаемых у таких пациентов, — Salmonella и штаммы Vibrio, поэтому у пациентов после спленэкто- мии очень важно предотвращать инфекции и своевременно назначать антибиотики.
КЛЮЧЕВЫЕ МОМЕНТЫ 1. Скорость диагностики источника инфекции и инвазивность используемых методов
должны в принципе соответствовать тяжести заболевания. При стабильном состоянии,
577
функционирующей иммунной системе и хорошем физиологическом резерве показаны ме- нее агрессивные диагностические приемы, в то время как ослабленным пациентам в кри- тическом состоянии необходимо быстро поставить окончательный диагноз.
2.Больным в нестабильном состоянии, с инфекцией или сепсисом показана эмпири- ческая терапия антибиотиками широкого спектра действия после получения соответст-
вующих культур. Как правило, таким пациентам лучше сначала/дать слишком много, чем слишком ,мало антибиотиков; второй возможности для выбора адекватного лечения1 мо- жет не представиться.
3.Антибиотики должны быть выбраны по результатам посева, если это возможно, или, в противном случае, по еле микроскопического исследования жидкостей организма.
Вотсутствие диагностического материала детерминантами выбора антибиотика должны быть клинический анамнез и предполагаемый участок инфицирования.
4.Когда существует несколько одинаково эффективных альтернатив лечения инфек- ции, следует выбирать комбинацию с наименьшими побочными эффектами и наименьшей
стоимостью. Пероральная терапия и парентеральное введение антибиотиков длительного действия, которые можно вводить не слишком часто, — лучшие методы
сокращения затрат на антибиотики.
5. Выбор антибиотиков следует ежедневно анализировать, имея в виду, что антибио- тики редко действуют на какую-либо инфекцию раньше чем через 48—72 ч. Антибиотики следует сократить до самой простой из эффективных комбинаций, как только станет ясна клиническая реакция и будут получены данные посева.
ТЕРМИНОЛОГИЯ Поскольку для различных врачей слово "сепсис" означает различные ситуации, кон-
кретное обсуждение этой клинической проблемы часто затруднено. В настоящее время су- ществуют одобренные стандартизованные, но, возможно, неточные определения данного клинического синдрома и его разновидностей. Совокупность лихорадки или гипотермии, тахикардии и тахипноэ определяет расстройства жизненно важных функций, характери- зующие "синдром системной воспалительной реакции" (ССВР). ССВР представляет собой реакцию на уровне организма на воспаление, которое может возникнуть из-за инфекции или без нее. Когда недостаточность органных систем является результатом этого воспали- тельного процесса, синдром называют "тяжелым ССВР". Обычно пределы расстройств
578
витальных функций при ССВР — температура ниже 35,5 °С или выше 38 °С, пульс, пре- вышающий 90—100 ударов в минуту при отсутствии заболеваний сердца или фармакоте- рапии, ограничивающей реакцию частоты сердечных сокращений, а тахипноэ с частотой дыхания выше 20 в минуту. Для условий ИВЛ обычно накладывается критерий минутной вентиляции 10 л/мин1. Нарушения количества циркулирующих лейкоцитов при ССВР достаточно часты, чтобы составить диагностический порог. Следует отметить, что встре- чается как повышение числа лейкоцитов более 10 000 в 1 мм3, так и снижение до уровня менее 4000 в 1 мм3.
Когда ССВР вызван инфекцией, это состояние называют "сепсисом". Соответствен- но, когда острая недостаточность органных систем встречается у пациента с обусловлен- ным инфекцией ССВР, результирующий синдром называют "тяжелым сепсисом". Про па- циента, у которого развивается гипотензивная сердечнососудистая системная недостаточ- ность, говорят, что у него "септический шок". Синдром полиорганной недостаточности — прогрессирующая накапливающаяся недостаточность органных систем — чаще всего яв- ляется результатом неизлеченной инфекции и нередко приводит к смерти.
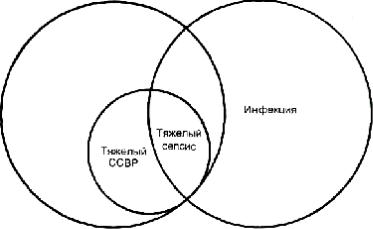
Рис. 27.1. Синдром системной воспалительной реакции (ССВР) определяется специфическим ха- рактером нарушений витальных функций. Инфекция — присутствие микроорганизма в обычно стерильной области организма-"хозяина". Если инфекция вызывает ССВР, развившийся синдром называют сепсисом (центральное наложение). Если под влиянием сепсиса возникает недостаточность организма, такой синдром называют тяжелым сепсисом. (Методически правильнее иллюстрировать термином "сепсис" область, об- щую для ССВР и инфекции. — Прим. пер.)
Лучшее определение полиорганной недостаточности (хотя и не совсем точно) опи- сывает ее как состояние генерализованного прогрессирующего воспаления. Довольно сложные взаимоотношения инфекции, ССВР, тяжелого ССВР, сепсиса и тяжелого сепсиса иллюстрируются на рис. 27.1.
' Точнее, выше 10 л/мин (Примеч. пер.).
ТАБЛИЦА 27.1 КРИТЕРИИ СЕПСИСА
I.Клиническое проявление инфекции (требуется)
II.Главные критерии (требуются два из четырех)
Лихорадка или гипотермия (температура >38 "С или <35,5 °С)
Тахипноэ (частота дыхания >20/мин) или высокая минутная вентиляция (>10 л/мин) Тахикардия (пульс >90/мин в отсутствие заболевания сердца или лекарственной те-
рапии, исключающей тахикардию)
Лейкоцитоз или лейкопения (число лейкоцитов >10 000 в 1 мм3или<4000в 1 мм3), или>10 % палочкоядерных форм
III.Острое ухудшение функций органных систем (хотя бы одной) Изменения сознания (снижение по шкале комы Глазго >2 пунктов)
579
Гипотония (систолическое артериальное давление <90 мм рт. ст. или падение АД бо- лее чем на 40 мм рт. ст., устойчивое к восполнению ОЦК)
Ухудшающийся газообмен или острый ОРДС (отношение PaO2/FiО2 < 300)
Метаболический ацидоз или лактатацидоз Олигурия или почечная недостаточность (диурез <0,5 мл/кг/ч)
Гипербилирубинемия
Коагулопатия (число тромбоцитов < 100 000 в 1 мм3; MHO > 2,0; АЧТВ > 1,5 от кон- трольного или повышение продуктов деградации фибриногена—фибрина)
Рабочее определение сепсиса выделено в табл. 27.1. Остальная часть этого обсужде- ния будет сосредоточена на особенностях наиболее важных из этих нарушений, клиниче- ских синдромах тяжелого сепсиса и полиорганной недостаточности.
ЭПИДЕМИОЛОГИЯ Примерно 500 000 случаев тяжелого сепсиса, которые регистрируются каждый год,
представляют огромную медицинскую и экономическую проблему. Средний возраст па- циентов с сепсисом — приблизительно 55 лет, и по неясным причинам среди них не- сколько преобладают мужчины. Несмотря на эти наблюдения, сепсис не имеет возрастных или половых границ. Сепсис, безусловно, может впервые развиться у здоровых до этого людей вне больницы, но он больше распространен среди госпитализированных больных, чаще всего у недавно подвергнутых терапевтическому или хирургическому лечению. И действительно, большинство пациентов поступают в больницу за 5— 10 дней до начала сепсиса. Наибольшему риску подвержены больные после травмы или сложных хирурги- ческих процедур, больные с нарушенным иммунитетом и хронически ослабленные паци- енты.
Всего погибает приблизительно 40 % больных с сепсисом, многие — от основных заболеваний или осложнений, но, возможно, половина смертных случаев вызвана непо- средственно септическим процессом. При такой летальности в некоторых
подгруппах пациентов, в частности у больных с гипотермией и людей очень пре- клонного возраста, прогноз особенно неблагоприятен. Интересно отметить, что даже с распространением отделений интенсивной терапии, высокоэффективных антибиотиков и передовых технологий поддержки, таких как диализ, парентеральное питание, искусст- венная вентиляция, а также препаратов и устройств для сердечно-сосудистой поддержки, в течение последнего столетия смертность от сепсиса существенно не снизилась. Причи- ны устойчивости этих показателей обсуждаются. Возможно, частичным объяснением яв- ляются увеличивающийся возраст населения, увеличение числа насильственных травм, агрессивное применение иммунодепрессантов при раке и трансплантации органов, много- численные случаи ВИЧ-инфекции. Тем не менее современная заболеваемость и смерт- ность недопустимо высоки, и миллиарды долларов тратятся на лечение этой группы без- надежно больных. Однако необходимо подчеркнуть, что выздоровевшие обычно возвра- щаются к нормальной жизни, т. е. сепсис редко приводит к хронической инвалидизации.
После начала синдрома оставшимся в живых требуется в среднем 7— 14 дней интен- сивной поддерживающей терапии. В большинстве случаев значительная часть этого вре- мени тратится на ИВЛ. После прекращения ИВЛ и перевода из ОИТ обычно нужно еще от 10 до 14 дней пребывания в стационаре. Таким образом, для большинства оставшихся в живых время от госпитализации до выписки составляет в среднем от 3 до 5 нед. Из-за длительного и технологически сложного лечения сепсис налагает на общество существен- ное экономическое бремя.
ИНФЕКЦИЯ И СЕПСИС Получение роста патогенного микроорганизма из обычно стерильной среды орга-
низма (крови, синовиальной или спинномозговой жидкости и т. п.) является микробиоло- гическим подтверждением инфекции, однако у большинства инфицированных больных
580
сепсис не развивается. Этот факт свидетельствует, что сепсис вызывает не инфекция сама по себе, а скорее комбинация инфекции и реакции организма на нее. Отметим, что у мно- гих пациентов не удается определить источник инфекции как причину сепсиса.
Кроме того, у больных, имеющих клинические критерии тяжелого сепсиса, положи- тельные гемокультуры можно получит в 60—80 % случаев. Однако часто это является ре- зультатом колонизации или контаминации (загрязнения) флаконов с питательной средой при посеве крови. Источником такого загрязнения является кожа рук медперсонала или самого больного.
Частыми примерами таких "положительных", но клинически незначимых результа- тов является небольшой рост Staphylococcus aureus при посеве аспирированной мокроты длительно вентилируемого больного или обнаружение единичных колоний Candida albicans в моче пациента с постоянным мочевым катетером. Возможно, об инфекции у боль- ного с сепсисом наиболее убедительно свидетельствует рост одного и того же воз- будителя при неоднократном (2—3 раза) посеве крови и его соответствии клиническому состоянию пациента. К примеру, рост Escherichia coli в нескольких посевах крови, полу- ченных у пожилого мужчины с пиурией и обструкцией уретры, может иметь существен- ное значение. К сожалению, положительные гемокультуры получают не более чем у 20— 30 % пациентов.
Как ни странно, тяжесть воспалительной реакции не зависит от присутствия инфек-
ции.
Действительно, для неинфицированных пациентов с тяжелым ССВР, обусловленным панкреатитом, травмой или ожогом, характерны такие же физиологические и клинические проявления и такой же исход, как и для инфицированных пациентов, в состоянии, отве- чающем критериям "тяжелого сепсиса". Это наблюдение еще раз доказывает, что инфек- ция не является необходимым условием синдрома ССВР, а микробиологическая стиму- ляция действует просто как одно из условий, "запускающих" заболевание. Относительная частота источников инфекции, вызывающей сепсис, иллюстрируется на рис. 27.2. Почти во всех исследованиях легкие являются наиболее частым местом инфекции, приводящей к сепсису, составляя в большинстве исследований почти половину случаев. Остальные ло- кализации — мочевыводящие пути, внутрибрюшные органы и все другие участки, явля- ются источниками сепсиса примерно с равной частотой. Очевидно, что многое в этом от- ношении зависит от изучаемой популяции.
КЛИНИЧЕСКАЯ МИКРОБИОЛОГИЯ Тяжелый сепсис может быть вызван любыми микроорганизмами — бактериями,
грибами, простейшими и вирусами. Чаще выявляются бактерии, вероятно, вследствие от- носительно высокой частоты бактериальной инфекции и сравнительной легкости их вы- деления. Из-за значительной трудности выращивания вирусы обычно выделяются наибо- лее редко. Приблизительно у 70—80 % всех "септических" больных выявляется рост мик- роорганизмов, но не
всегда есть уверенность, что обнаруженная бактерия является причиной синдрома. Примерно в 20—30 % случаев клинической картины сепсиса бактериальный возбудитель обнаруживается в крови. Частота грамотрицательных и грамположительных бактерий, по сообщениям, широко варьируется, но в настоящее время распределяется примерно 50/50.
Теоретическое обсуждение частоты грамположительных и грамотрицательных инфекций как причины синдрома сепсиса имеет мало смысла: частота высевания каждого типа бак- терий со временем меняется, и нередко этому способствует применение антибиотиков. Кроме того, точное знание частоты каждого типа возбудителей не влияет на разработку терапии для конкретного больного. В большинстве обстоятельств больному в критической стадии сепсиса необходима эмпирическая антимикробная терапия, подходящая для обеих групп бактерий, пока не будет поставлен более определенный диагноз.
