
- •Министерство образования и науки украины
- •1. Строение атома
- •1.2. Некоторые сведения из квантовой механики
- •1.3. Уравнение Шредингера для атома водорода
- •1.4. Спин электрона
- •1.5. Атомная орбиталь
- •1.6. Принцип Паули
- •1.7. Многоэлектронные атомы
- •2. Химическая связь
- •2.1. Основные характеристики химической связи
- •2.1. Составление химических уравнений
- •2.3. Стехиометрические расчеты в химии
- •2.5. Номенклатура неорганических соединений
- •2.5. Скорость химических реакций.
- •3. Кристаллохимия
- •3.1. Ионные кристаллы
- •3.2. Ковалентные связи в кристаллах
- •3.3. Металлическая связь
- •3.4. Слабая (ван-дер-ваальсовая) связь в кристаллах
- •3.5. Кристаллохимические параметры
- •4. Кристаллография (1 часть)
- •4.1. Предмет кристаллографии
- •4.4. Сетка Вульфа. Сферические координаты
- •4.5. Элементы симметрии кристалла
- •5. Кристаллография (2 часть)
- •5.1. Сингонии. Решетки Бравэ
- •5.2. Некоторые наиболее распространенные типы решеток
- •5.3. Пространственная решетка
- •5.4. Индицирование направления
- •5.5. Индицирование плоскостей (hkl)
- •5.6. Индицирование гексагональных кристаллов (граней)
- •5.7. Термины в кристаллографии
- •6. Дефекты кристаллической решетки
- •6.1. Точечные дефекты
- •6.2. Миграция точечных дефектов
- •6.3. Диффузия в твердых телах
- •6.4. Дислокации в кристаллах
- •7. Макро-, микро- и наноструктура материалов
- •7.1. Макроскопический анализ
- •7.2. Микроскопический анализ
- •7.3. Принцип работы металлографического микроскопа
- •7.4. Определение балла зерна
- •7.5 Фазовый анализ
- •7.6. Наноструктура
- •7.7. Рентгеноструктурный анализ материалов
- •8. Механические свойства твердых материалов
- •8.1. Разновидности механических свойств материалов
- •8.3. Упругая линейная продольная деформация
- •8.4. Сдвиг. Упругая деформация сдвига
- •8.5. Взаимосвязь между деформациями растяжения (сжатия) и сдвига
- •9. Всесторонняя деформация сжатия
- •9.1. Закон Гука для всесторонней деформации
- •9.2. Закон Гука для деформации вдоль одной стороны
- •9.3. Связь между модулем всестороннего сжатия и
- •9.4. Напряжения при ударе
- •9.5. Упругое последствие
- •10. Изгиб и кручение материалов
- •10.1. Изгиб. Упругая изгибная деформация
- •10.2. Прогиб и поворот сечения балки
- •10.3. Прогиб балки на двух опорах
- •10.4. Кручение материалов. Деформация кручения
- •11. Пластичность. Твердость. Ударная вязкость
- •11.1. Пластическая деформация твердых тел
- •11.2. Физическая сущность пластической деформации
- •11.3. Пластическая деформация поликристаллов
- •11.4. Основные характеристики деформации и разрушения
- •11.5. Твердость материалов
- •12. Разрушение материалов. Пути повышения прочности
- •12.1. Прочность. Виды разрушений
- •12.2. Ползучесть материалов
- •12.3. Другие механические свойства
- •12.4. Пути повышения прочности материалов
- •13. Тепловые свойства твердых тел
- •13.1. Колебания атомов в кристаллах
- •13.2. Теплоемкость твердых тел
- •13.3. Теплопроводность твердых тел
- •13.4. Тепловое расширение твердых тел
- •13.5. Зависимость механических напряжений от температуры
- •13.6. Повышение механических свойств материалов под действием температуры
- •14. Жидкое состояние вещества
- •14.3. Вязкость жидкостей
- •14.4. Поверхностное натяжение
- •14.5. Явления смачивания
- •14.6. Жидкие растворы
- •14.9. Осмотическое давление
- •15. Структура полимеров
- •15.1. Молекулярное строение полимеров
- •15.2. Классификация полимеров
- •15.3. Превращения в полимерах
- •15.4. Надмолекулярная структура полимеров
- •16. Механические свойства полимеров
- •16.1 Высокоэластическое состояние полимеров
- •16.2. Модель Максвелла для линейных полимеров
- •16.3. Модель Кельвина-Фогта для сетчатых полимеров
- •17. Термодинамика фазовых превращений
- •17.1. Фазовые превращения. Правило фаз
- •17.2. Термодинамические функции и параметры
- •Свойства термодинамических функций:
- •17.3. Связь между основными термодинамическими функциями и параметрами
- •17.4. Химический потенциал
- •18. Фазовые переходы I рода. Плавление и
- •18.1. Фазовые переходы I рода
- •18.2. Уравнение Клапейрона-Клаузиуса
- •18.3. Плавление и кристаллизация
- •18.4. Термический анализ
- •19. Фазовые превращения в твердом состоянии
- •19.1. Изоморфизм и полиморфизм вещества
- •19.2. Полиморфные превращения
- •19.3. Бездиффузионные и диффузионные превращения
- •19.4 Кинетика твердофазных превращений
- •19. 5 Упорядочение и разупорядочение в сплавах
- •19.6. Диаграмма состояния сплавов с учетом твердофазных превращений
- •19.7. Эвтектоидные превращения
- •19. 8. Рекристаллизация
- •20. Сплавы
- •20.1. Классификация сплавов
- •20.2. Зависимость свободной энергии Гиббса от температуры и
- •20.3. Система с неограниченной растворимостью компонентов в жидком и твердом состояниях
- •20.4. Построение диаграмм состояния методом термического
- •21. Диаграммы состояния бинарных систем
- •21.1. Система с ограниченной взаимной растворимостью
- •21.2. Анализ диаграммы состояния для сплавов с эвтектическим
- •21.3. Анализ диаграммы состояния для сплавов с перитектическим превращением.
- •21.4. Диаграммы состояния для сплавов, когда компоненты образуют химические соединения
- •22. Изучение диаграмм состояния
- •22.1. Построение и расшифровка диаграмм состояния тройных сплавов
- •22.2. Основные типы диаграмм состояния трехкомпонентных
- •II. Изотермические и политермические сечения тройных диаграмм.
- •23. Определение концентрации компонентов
- •Бинарные сплавы
- •Найти молярную массу бинарного раствора м при известных ,,м1 и м2.
- •24.2. Неорганическое стекло
- •24.3. Механические и тепловые свойства стекла
- •24.6. Оптические свойства стекла
- •24.5. Применение технических стекол.
- •25. Дисперсные системы
- •25.1. Введение
- •25.2. Свойства малых частиц
- •25.3. Коагуляция частиц
- •26. Электрические свойства материалов
- •26.1. Элементы зонной теории твердого тела
- •26.2. Электропроводность твердых тел
- •26.2. Поляризация диэлектрика
- •26.4. Сверхпроводники
- •26.5. Электрический ток в жидкостях
- •27. Магнитные свойства твердых тел
- •27.1. Магнитные моменты атомов
- •27.2. Намагничивание. Диа- и парамагнетики
- •27.3. Ферромагнетики
23. Определение концентрации компонентов
И ПЛОТНОСТИ СПЛАВОВ
Концентрация - величина, определяющая содержание компонента в смеси, растворе, сплаве. Способы выражения концентрации различные.
В физике концентрация – n - это количество частиц в единице объема
![]() ; [c]
= M-3
в СИ.
; [c]
= M-3
в СИ.
По этой формуле определяют число атомов или молекул в единице объема, а также концентрацию электронов, дырок и др.
Долевая (относительная) концентрация Сm по массе есть отношение массы компонента mi к общей массе смеси m
![]() .
.
По этой формуле чаще всего определяют концентрацию компонента (по массе) в сплавах. Например, в бинарном сплаве А10В90 содержится 10масс.% компонента А и 90масс.% компонента В.
Атомная (молекулярная) долевая концентрация Сат – это отношение содержащегося в смеси числа атомов (молекул) Nx компонента к числу атомов (молекул) всех компонентов N
![]() .
.
Мольная долевая концентрация С - это отношение содержащегося в смеси числа молей х одного из компонентов к общему числу молей вещества
С х/.
Концентрации Сm ,Сат ,С выражаются в виде дроби, либо в процентах. Относительная концентрация Сат чаще всего используется для нахождения концентрации вакансий, либо атомов примесей. В этом случае под Nx подразумевают число вакансий, либо инородных атомов, а под N– число узлов кристаллической решетки, либо общее число позиций, которые могут быть заняты атомами примесей (обычно их также приравнивают к числу узлов в кристаллической решетке).
Молярная концентрация С удобна для определения концентрации компонента в смеси газов, либо в растворе жидкости.
Моль раствора М – количество раствора, при котором число молей каждого компонента равно его молярной доле
![]() ,
,
где
![]() -
молярная массаi-гокомпонента.
-
молярная массаi-гокомпонента.
Молярность – число молей вещества в 1 литре раствора (моль/л или моль/м3)
![]() .
.
Мольность – число молей вещества в 1 кг растворителя (моль/кг)
![]() .
.
Титр – масса вещества 1 мл раствора
![]() .
.
Объемная
концентрация
![]() -отношение
объема Vx,
занимаемого компонентом к общему объему
V
системы
-отношение
объема Vx,
занимаемого компонентом к общему объему
V
системы
![]() .
.
Концентрация
компонента по плотности
![]() -
отношение массы компонентаm
к объему системы V
-
отношение массы компонентаm
к объему системы V
![]() ,
, ![]() .
.
Согласно системе СИ к концентрации относят только массовую Сm и молярную С концентрации. Все остальные характеристики содержания компонента не являются концентрациями.
При изготовлении сплавов часто возникают практические задачи по определению плотности сплавов, атомной Са , массовой Сm и молярной С концентраций сплавов, а также молярной массы сплава М. Приведем наиболее распространенные методы вычисления этих параметров для бинарных и тройных сплавов.
Бинарные сплавы
Задача №1.
Определить
относительное содержание компонентов
![]() и
и![]() по массе, если известны плотности
компонентов
по массе, если известны плотности
компонентов![]() и смеси
и смеси![]()
![]() ,
, ![]() ,
,
![]() ,
, ![]() ,
,![]() ,
,
![]() ,
, ![]() ,
,
![]() из
этой системы находим
из
этой системы находим
![]() или
или
![]() , откуда
, откуда
![]() ,
следовательно,
,
следовательно,
![]() .
.
Тогда
![]()
![]() .
(23.1)
.
(23.1)
Аналогично ![]() ,
(23.2)
,
(23.2)
или ![]() , (или
100%).
, (или
100%).
Например,
для сплава олово-свинец с плотностью
=102/см3
имеем
![]() .
.
Задача № 2.
Найти
плотность
![]() сплава, если известны массыm1,
m2
и
плотности
сплава, если известны массыm1,
m2
и
плотности
![]() и
и![]() компонентов
компонентов
![]() ,
,![]() ,
,![]() ,
,
![]() ,
,![]() ,
,

![]() . (23.3)
. (23.3)
Например,
для сплава олова и свинца при
![]() и
и![]() имеем
имеем![]() .
.
Задача № 3.
Найти
плотность
![]() для сплава при заданных концентрациях
для сплава при заданных концентрациях![]() и
и![]() компонентов и их плотностях
компонентов и их плотностях![]() и
и![]() .
.
 ,
,
![]() .
(23.4)
.
(23.4)
Например,
для сплава олова с свинцом при
![]() получим
получим![]() .
.
Задача № 4.
Найти
массу m2
второго
компонента в сплаве при известной массе
m1
первого компонента и его массовой
концентрации
![]() .
.
 .
(23.5)
.
(23.5)
Задача № 5.
Найти
атомный процент
![]() ,
,
![]() компонентов
сплава, если известны их массы и
молекулярные массы.
компонентов
сплава, если известны их массы и
молекулярные массы.
![]()
![]()
![]()
![]() ;
;

 , (23.6)
, (23.6)  .
(23.7)
.
(23.7)
Задача № 6.
Найти
молярный процент
![]() компонентов сплава, если известны их
молярные массыМ1,
М2
и
массы компонентов m1
и m2..
компонентов сплава, если известны их
молярные массыМ1,
М2
и
массы компонентов m1
и m2..

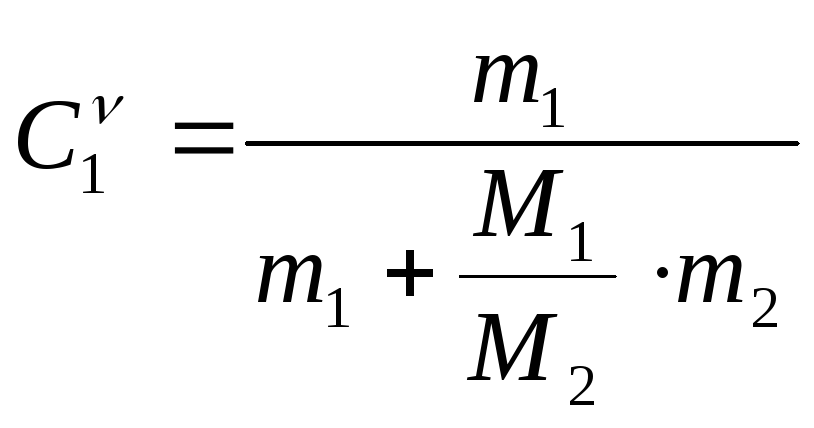 , (23.8)
, (23.8)  .
(23.9)
.
(23.9)
Задача № 7.
При
известных атомных концентрациях
компонентов
![]() и
и
![]() найти массовые концентрации
найти массовые концентрации
![]() и
и![]() .
.

 , (23.10)
, (23.10) .
(23.11)
.
(23.11)
Задача № 8.
При
известных массовых концентрациях
![]() и
и![]() компонентов найти атомные концентрации
компонентов.
компонентов найти атомные концентрации
компонентов.
 ,
,
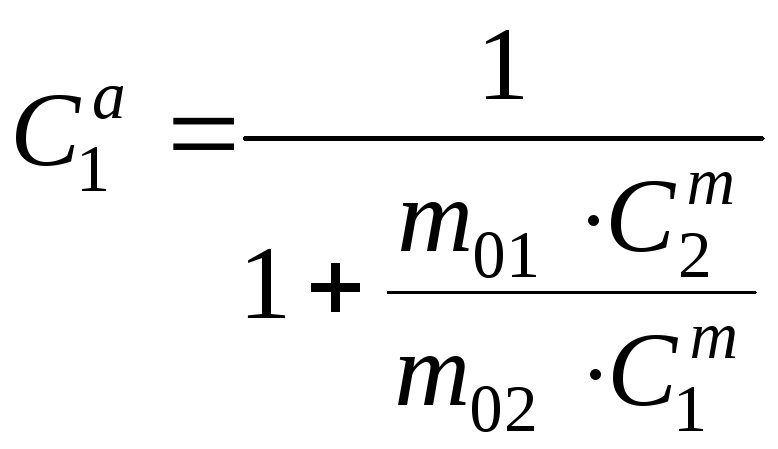 , (23.12)
, (23.12)  .
(23.13)
.
(23.13)
Задача № 9.
По
массовым концентрациям
![]() и
и![]() найти молярные концентрации
найти молярные концентрации![]() и
и![]() .
.
 , (23.14)
, (23.14) 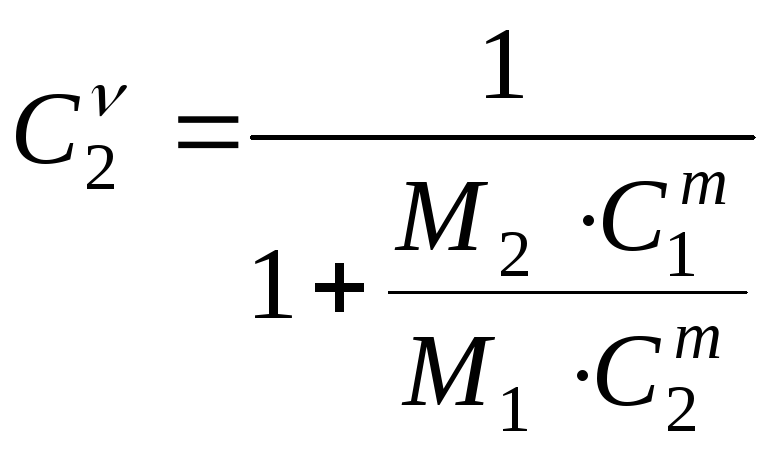 .
(23.15)
.
(23.15)
Задача № 10.
