
- •Предмет, содержание, задачи токсикологической химии.
- •Краткий исторический очерк развития токсикологической химии.
- •Связь токсикологической химии с другими химическими, фармацевтическими и биологическими науками.
- •Вклад отечественных учёных в развитие токсикологической химии.
- •Организация судебно-медицинской и химико-токсикологической (судебно-химической) экспертизы в России.
- •Объекты химико-токсикологического исследования и вопросы, решаемые химико-токсикологическим анализом. Понятие «яд», «ядовитое вещество». Классификация ядов и отравлений.
- •Специфические особенности химико-токсикологического анализа.
- •Пути поступления чужеродных соединений в организм. Основные факторы, оказывающие влияние на всасываемость и распределение веществ в тканях и биологических средах организма.
- •Превращение и выделение чужеродных веществ из организма. Общая характеристика.
- •Общая характеристика методов исследования, применяемых в токсикологической химии (методы изолирования, очистки, качественного и количественного анализа).
- •11. Судебная химия – основной раздел токсикологической химии.
- •Документация химико-токсикологических экспертиз и правила её
- •Источники ошибок на основных этапах химико-токсикологического анализа.
- •Правила приёма вещественных (химических) доказательств на экспертизу.
- •Значение данных дознания, истории болезни и результатов судебно-медицинского исследования трупов для судебно-химической экспертизы.
- •Микрокристаллоскопия и кристаллооптика в токсикологической химии.
- •Методы количественного определения. Значение этих определений для оценки результатов исследования (показать на примере «металлических ядов»).
- •Реакции отрицательного судебно-химического значения.
- •Классификация ядовитых и сильнодействующих веществ в токсикологической химии.
- •Охрана окружающей среды и перспективы развития токсикологической химии на современном этапе.
- •Классификация наркотических и психотропных веществ. Основные особенности их химико-токсикологического анализа.
- •Современные физико-химические методы, применяемые в анализе наркотических и психотропных веществ. Основные требования к ним.
- •Фармакокинетика, метаболизм, особенности химико-токсикологического анализа опиатов.
- •Фармакокинетика, метаболизм, особенности химико-токсикологического анализа каннабиноидов.
- •Перспективы развития и совершенствования методов судебно-химических исследований вещественных доказательств.
- •26. Теоретические основы изолирования ядовитых и сильнодействующих веществ из биологического материала дистилляцией водяным паром.
- •27.Синильная кислота. Качественное обнаружение и количественное определение.
- •28. Химико-токсикологическое значение синильной кислоты и её производных.
- •29. Ядовитые галогенпроизводные (хлороформ, хлоралгидрат). Изолирование.
- •30. Ядовитые галогенпроизводные (четыреххлористый углерод, 1,2-дихлорэтан).
- •31. Альдегиды (формалин, формальдегид). Изолирование, качественное обнаружение и количественное определение. Токсикологическое значение и метаболизм.
- •32. Ацетон. Изолирование, качественное обнаружение и количественное
- •33. Метиловый спирт. Изолирование, качественное обнаружение и количественное
- •34. Этиловый спирт. Изолирование. Качественное обнаружение и количественное
- •35. Физико-химические методы количественного определения этилового спирта, применение в судебно-химическом анализе.
- •36. Значение этапа количественного определения этилового спирта при химико-токсикологическом исследовании биологических объектов.
- •37. Реакции отличия метилового и этилового спирта. Методы экспресс-анализа спирта. Пробы Раппопорта и Шинкаренко.
- •38.Спирты (амиловый, этиленгликоль). Качественное обнаружение. Токсикологическое значение. Метаболизм.
- •39. Уксусная кислота. Изолирование. Качественное обнаружение и количественное определение. Токсикологическое значение и метаболизм.
- •40. Нитробензол в химико-токсикологическом отношении.
- •41. Фенолы (фенол, трикрезол) в химико-токсикологическом отношении.
- •42. Анилин в химико-токсикологическом отношении.
- •43. Метод изолирования подкисленным спиртом. Его достоинства и недостатки.
- •44. Метод изолирования подкисленной водой. Вклад отечественных учёных в разработку этого метода, его достоинства и недостатки.
- •45. Частный метод изолирования подкисленной водой в.Ф. Крамаренко. Влияние рН среды и др. Факторов на изолирование и экстрагирование алкалоидов.
- •46. Метод изолирования подщелоченной водой, его достоинства и недостатки.
- •47. Салициловая кислота. Изолирование, качественное обнаружение и количественное обнаружение. Токсикологическое значение и метаболизм.
- •48. Химико-токсикологическое значение производных барбитуровой кислоты. Методы изолирования, очистки барбитуратов.
- •49. Качественное обнаружение барбитуратов в судебно-химическом анализе.
- •50. Количественное определение барбитуратов в судебно-химическом анализе.
- •51. Спектрофотометрическое определение производных барбитуровой кислоты в химико-токсикологическом анализе.
- •52. Токсикологическое значение и метаболизм барбитуратов.
- •53. Фенацетин. Качественное обнаружение и количественное определение.
- •54. Предварительные химико-токсикологические исследования при наличии алкалоидов (общеалкалоидные реакции).
- •55. Методы изолирования, очистки и обнаружение алкалоидов.
- •56. Алкалоиды, производные пиридина и пиперидина (кониин, ареколин). Изолирование, качественное обнаружение и количественное определение. Токсикологическое значение и метаболизм.
- •57. Алкалоиды, производные пиридина и пиперидина (никотин, анабазин) в химико-токсикологическом отношении.
- •58. Пахикарпин в химико-токсикологическом отношении.
- •59. Алкалоиды, производные тропана (атропин, гиосциамин) в химико-токсикологическом отношении.
- •60. Алкалоиды, производные тропана (кокаин) в химико-токсикологическом отношении.
- •61. Производные аминокислот ароматического ряда (новокаин, дикаин) в химико-токсикологическом отношении.
- •62. Алкалоиды, производные хинолина (хинин и его соли). Изолирование, качественное обнаружение и количественное определение. Токсикологическое значение и метаболизм.
- •63. Алкалоиды, производные изохинолина (морфин). Изолирование. Качественное обнаружение и количественное определение. Токсикологическое значение и метаболизм.
- •64. Заменители морфина (кодеин, этилморфина гидрохлорид, апоморфин) в химико-токсикологическом отношении.
- •65. Доказательства отравления опием.
- •66. Алкалоиды, производные бензилизохинолина (папаверин, наркотин) в химико-токсикологическом отношении.
- •67. Алкалоиды, производные индола (резерпин, секуренин) в химико-токсикологическом отношении.
- •69. Алкалоиды, производные пирролизидина (платифиллин) в химико-токсикологическом отношении.
- •70. Алкалоиды, производные пиримидина (кофеин, теобромин, теофиллин) в химико-токсикологическом отношении.
- •71. Ациклические алкалоиды (эфедрин). Изолирование, обнаружение, определение, значение, метаболизм.
- •72. Производные пиразола (антипирин, амидопирин) в химико-токсикологическом отношении.
- •73. Производные 1,4 - бензодиазепина в химико-токсикологическом отношении.
- •74. Производные фенотиазина в химико-токсикологическом отношении.
- •75. Общая характеристика пестицидов (ядохимикатов) в химико-токсикологическом отношении. Классификация.
- •76. Пестициды из группы галогенпроизводных (ддт, гхцг, гептахлор) в химико-токсикологическом отношении.
- •77. Пестициды из класса фенолов (днок, диносеб, зоокумарин). Качественное обнаружение и количественное определение. Токсикологическое значение и метаболизм.
- •78. Пестициды класса фосфорорганических соединений (хлорофос, карбофос) в химико-токсикологическом отношении.
- •79. Пестициды, производные карбаминовой кислоты (севин) в химико-токсикологическом отношении.
- •80. Пестициды, производные тиокарбаминовой, дитиокарбаминовой кислот (крысид, тмтд) в химико-токсикологическом отношении.
- •81. Металлоорганические пестициды (гранозан, меркуран, меркургексан) в химико-токсикологическом отношении.
- •82. Неорганические ядохимикаты (фосфид цинка, фторид натрия) в химико-токсикологическом отношении.
- •83. Общая характеристика сероводородного и дробного методов анализа «металлических» ядов.
- •84. Вклад отечественных учёных в разработку химико-токсикологического анализа «металлических ядов».
- •85. Теоретические и методологические основы дробного метода анализа «металлических» ядов, разработанные а.Н. Крыловой.
- •86. Органические реагенты, предложенные а.Н. Крыловой для анализа «металлических» ядов дробным методом.
- •87. Последовательность проведения дробного метода анализа на «металлические» яды.
- •88. Частые методы минерализации органических веществ.
- •89. Минерализация серной и азотной кислотами органических веществ. Достоинства и недостатки.
- •90. Минерализация органических веществ азотной, серной, хлорной кислотами. Достоинства и недостатки метода.
- •91. Методы удаления окислителей из минерализата.
- •92. Исследование осадка после минерализации азотной, серной кислотами (свинец, барий).
- •93. Свинец и тетраэтилсвинец. Качественное обнаружение и количественное определение. Токсикологическое значение.
- •94. Барий в химико-токсикологическом отношении.
- •95. Марганец в химико-токсикологическом отношении.
- •96. Хром в химико-токсикологическом отношении.
- •97. Серебро. Изолирование, качественное обнаружение и количественное определение, поступление, распределение, выведение из организма, токсикологическое значение.
- •98. Медь в химико-токсикологическом отношении.
- •99. Висмут в химико-токсикологическом отношении.
- •100. Сурьма и таллий в химико-токсикологическом отношении.
- •101. Кадмий в химико-токсикологическом отношении.
- •102. Цинк в химико-токсикологическом отношении.
- •103. Ртуть, деструктивные методы изолирования. Качественное и количественное значение. Органические препараты ртути (этилмеркурхлорид).
- •104. Мышьяк в химико-токсикологическом отношении. Общая схема анализа.
- •105. Определение мышьяка в аппарате Марша.
- •106. Определение мышьяка в аппарате Зангер-Блека.
- •107. Изолирование веществ из биологического материала диализом (серная, азотная, соляная кислоты). Качественное обнаружение и количественное определение, токсикологическое значение.
- •108. Изолирование веществ из биологического материала диализом (аммиак, едкий натр, щелочные соли). Качественное обнаружение и количественное определение, токсикологическое значение.
102. Цинк в химико-токсикологическом отношении.
Соединения цинка
Токсикологическое значение соединений цинка
Металлический цинк входит в состав ряда сплавов, имеющих большое техническое значение (латунь, бронза и др.), а так же применяется для покрытия железа и изготовления цинковой посуды. Оксид, сульфид цинка используется в лакокрасочной промышленности. Фосфид цинка — очень токсичное соединение, применяется для борьбы с грызунами. В медицине соединения цинка нашли широкое применение в препаратах, содержащих оксид и сульфат цинка как вяжущие средства. Цинк, необходимый нашему организму. Потребность человека в цинке в десять раз больше, чем в меди. Доказано, что цинк является компонентом почти 80 ферментов. К таким ферментам относятся полимеры нуклеиновых кислот, лакта-, алкоголь- и ретинолдегидрогеназы, а также фосфатаза, протеазы и другие. Дефицит цинка проявляется в различных симптомах, связанных с нарушением функций названных ферментов. Следствием недостатка цинка в питании является замедленный рост детей и подростков и трудное заживление ран. На основании многочисленных исследований ВОЗ предложена суточная доза потребления цинка с пищей для взрослого человека — 22 мг. Различие между необходимым количеством потребляемого с пищей цинка и его токсичным уровнем достаточно велико. По данным ВОЗ, критический сверхдопустимый предел поступления цинка в организм человека составляет 200 мг в сутки.
Цинк плохо всасывается и оказывает в основном местное раздражающее действие на слизистую желудка. Пыль и пары цинка, образующиеся при плавлении металла, в организме образуют соединения с белками, вызывающие приступы лихорадки, так называемая латунная лихорадка. Симптомы отравления появляются очень быстро (от нескольких минут до 2—3 часов) после поступления цинка в организм и проявляются в виде тошноты, рвоты, расстройства желудка, мышечной боли. При отравлении соединения цинка накапливаются в печени и поджелудочной железе, выводятся главным образом с калом, в меньшей степени с мочой. Дети более чувствительны к отравлению цинком, чем взрослые.
Исследование минерализата на наличие ионов цинка.
Реакция образования дитизоната. К 0,5 мл минерализата добавляют 10 % раствора натра едкого до рН = 4.5—5 по универсальному индикатору, 1 мл буфера ацетатного, 2 капли 0,01 % раствора дитизона в хлороформе, 0,5 мл хлороформа и сильно встряхивают. При наличии ионов цинка в минерализате хлороформный слой окрашивается в малиновый или красно-фиолетовый цвет.

При положительном результате этой реакции на ионы цинка проводят подтверждающие реакции после выделения их из минерализата в виде диэтилдитиокарбамата (при рН - 8,5) с последующей реэкстракцией 1 М раствором кислоты хлористоводородной.
Реакция выделения цинка из минерализата. К 10 мл минерализата в делительной воронке прибавляют 10 % раствор натра едкого до рН = 8,5 по универсальному индикатору Затем добавляют 3 мл 1 % раствора натрия диэтилдитиокарбамата и 5 мл хлороформа и сильно встряхивают. Хлороформный слой отделяют и встряхивают с 3 мл 1 М раствором кислоты хлористоводородной.
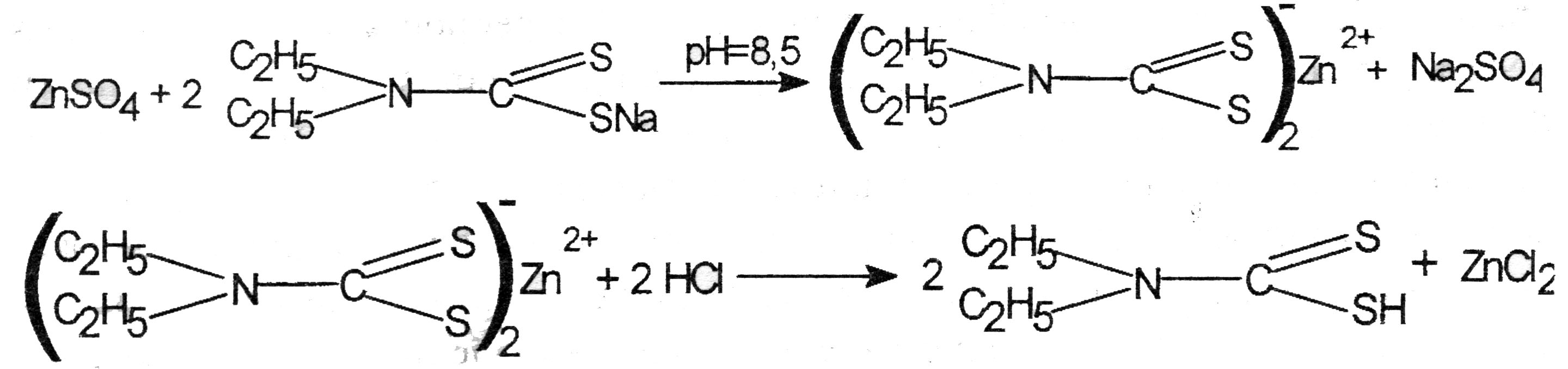
Водное извлечение отделяют, делят на три части и выполняют следующие реакции:
а) с калия гексоцианоферратом. К 1 мл реэкстракта добавляют 10 % раствор едкого кали до рН = 5 по универсальному индикатору и 2—3 капли 5 % раствора калия гексоцианоферрата (II). Появляется муть или белый осадок:
3ZnCl2 + 2K4[Fe(CN)6] = K2Zn3[Fe(CN)6]2 + 6KCl
б) с натрия сульфидом. К 1 мл реэкстракта добавляют 10 % раствор едкого кали до рН = 5 по универсальному индикатору, 3—4 капли свежеприготовленного раствора натрия сульфида. Образуется осадок или муть белого цвета:
ZnCl2 + Na2S = ZnS + 2NaCl
в) с аммония тетратиоцианатомеркуриатом (II). На предметное стекло наносят 2-3 капли реэкстракта, выпаривают досуха, остаток растворяют в 1 капли 10 % кислоты уксусной и добавляют 1 каплю раствора аммония тетратиоцианатомеркуриата (II). Через несколько минут под микроскопом наблюдают характерные кристаллы в виде дендритов.
ZnCl2 + (NH4)2[Hg(SCN)4] = Zn[Hg(SCN)4] + 2NH4Cl
