
- •Предмет, содержание, задачи токсикологической химии.
- •Краткий исторический очерк развития токсикологической химии.
- •Связь токсикологической химии с другими химическими, фармацевтическими и биологическими науками.
- •Вклад отечественных учёных в развитие токсикологической химии.
- •Организация судебно-медицинской и химико-токсикологической (судебно-химической) экспертизы в России.
- •Объекты химико-токсикологического исследования и вопросы, решаемые химико-токсикологическим анализом. Понятие «яд», «ядовитое вещество». Классификация ядов и отравлений.
- •Специфические особенности химико-токсикологического анализа.
- •Пути поступления чужеродных соединений в организм. Основные факторы, оказывающие влияние на всасываемость и распределение веществ в тканях и биологических средах организма.
- •Превращение и выделение чужеродных веществ из организма. Общая характеристика.
- •Общая характеристика методов исследования, применяемых в токсикологической химии (методы изолирования, очистки, качественного и количественного анализа).
- •11. Судебная химия – основной раздел токсикологической химии.
- •Документация химико-токсикологических экспертиз и правила её
- •Источники ошибок на основных этапах химико-токсикологического анализа.
- •Правила приёма вещественных (химических) доказательств на экспертизу.
- •Значение данных дознания, истории болезни и результатов судебно-медицинского исследования трупов для судебно-химической экспертизы.
- •Микрокристаллоскопия и кристаллооптика в токсикологической химии.
- •Методы количественного определения. Значение этих определений для оценки результатов исследования (показать на примере «металлических ядов»).
- •Реакции отрицательного судебно-химического значения.
- •Классификация ядовитых и сильнодействующих веществ в токсикологической химии.
- •Охрана окружающей среды и перспективы развития токсикологической химии на современном этапе.
- •Классификация наркотических и психотропных веществ. Основные особенности их химико-токсикологического анализа.
- •Современные физико-химические методы, применяемые в анализе наркотических и психотропных веществ. Основные требования к ним.
- •Фармакокинетика, метаболизм, особенности химико-токсикологического анализа опиатов.
- •Фармакокинетика, метаболизм, особенности химико-токсикологического анализа каннабиноидов.
- •Перспективы развития и совершенствования методов судебно-химических исследований вещественных доказательств.
- •26. Теоретические основы изолирования ядовитых и сильнодействующих веществ из биологического материала дистилляцией водяным паром.
- •27.Синильная кислота. Качественное обнаружение и количественное определение.
- •28. Химико-токсикологическое значение синильной кислоты и её производных.
- •29. Ядовитые галогенпроизводные (хлороформ, хлоралгидрат). Изолирование.
- •30. Ядовитые галогенпроизводные (четыреххлористый углерод, 1,2-дихлорэтан).
- •31. Альдегиды (формалин, формальдегид). Изолирование, качественное обнаружение и количественное определение. Токсикологическое значение и метаболизм.
- •32. Ацетон. Изолирование, качественное обнаружение и количественное
- •33. Метиловый спирт. Изолирование, качественное обнаружение и количественное
- •34. Этиловый спирт. Изолирование. Качественное обнаружение и количественное
- •35. Физико-химические методы количественного определения этилового спирта, применение в судебно-химическом анализе.
- •36. Значение этапа количественного определения этилового спирта при химико-токсикологическом исследовании биологических объектов.
- •37. Реакции отличия метилового и этилового спирта. Методы экспресс-анализа спирта. Пробы Раппопорта и Шинкаренко.
- •38.Спирты (амиловый, этиленгликоль). Качественное обнаружение. Токсикологическое значение. Метаболизм.
- •39. Уксусная кислота. Изолирование. Качественное обнаружение и количественное определение. Токсикологическое значение и метаболизм.
- •40. Нитробензол в химико-токсикологическом отношении.
- •41. Фенолы (фенол, трикрезол) в химико-токсикологическом отношении.
- •42. Анилин в химико-токсикологическом отношении.
- •43. Метод изолирования подкисленным спиртом. Его достоинства и недостатки.
- •44. Метод изолирования подкисленной водой. Вклад отечественных учёных в разработку этого метода, его достоинства и недостатки.
- •45. Частный метод изолирования подкисленной водой в.Ф. Крамаренко. Влияние рН среды и др. Факторов на изолирование и экстрагирование алкалоидов.
- •46. Метод изолирования подщелоченной водой, его достоинства и недостатки.
- •47. Салициловая кислота. Изолирование, качественное обнаружение и количественное обнаружение. Токсикологическое значение и метаболизм.
- •48. Химико-токсикологическое значение производных барбитуровой кислоты. Методы изолирования, очистки барбитуратов.
- •49. Качественное обнаружение барбитуратов в судебно-химическом анализе.
- •50. Количественное определение барбитуратов в судебно-химическом анализе.
- •51. Спектрофотометрическое определение производных барбитуровой кислоты в химико-токсикологическом анализе.
- •52. Токсикологическое значение и метаболизм барбитуратов.
- •53. Фенацетин. Качественное обнаружение и количественное определение.
- •54. Предварительные химико-токсикологические исследования при наличии алкалоидов (общеалкалоидные реакции).
- •55. Методы изолирования, очистки и обнаружение алкалоидов.
- •56. Алкалоиды, производные пиридина и пиперидина (кониин, ареколин). Изолирование, качественное обнаружение и количественное определение. Токсикологическое значение и метаболизм.
- •57. Алкалоиды, производные пиридина и пиперидина (никотин, анабазин) в химико-токсикологическом отношении.
- •58. Пахикарпин в химико-токсикологическом отношении.
- •59. Алкалоиды, производные тропана (атропин, гиосциамин) в химико-токсикологическом отношении.
- •60. Алкалоиды, производные тропана (кокаин) в химико-токсикологическом отношении.
- •61. Производные аминокислот ароматического ряда (новокаин, дикаин) в химико-токсикологическом отношении.
- •62. Алкалоиды, производные хинолина (хинин и его соли). Изолирование, качественное обнаружение и количественное определение. Токсикологическое значение и метаболизм.
- •63. Алкалоиды, производные изохинолина (морфин). Изолирование. Качественное обнаружение и количественное определение. Токсикологическое значение и метаболизм.
- •64. Заменители морфина (кодеин, этилморфина гидрохлорид, апоморфин) в химико-токсикологическом отношении.
- •65. Доказательства отравления опием.
- •66. Алкалоиды, производные бензилизохинолина (папаверин, наркотин) в химико-токсикологическом отношении.
- •67. Алкалоиды, производные индола (резерпин, секуренин) в химико-токсикологическом отношении.
- •69. Алкалоиды, производные пирролизидина (платифиллин) в химико-токсикологическом отношении.
- •70. Алкалоиды, производные пиримидина (кофеин, теобромин, теофиллин) в химико-токсикологическом отношении.
- •71. Ациклические алкалоиды (эфедрин). Изолирование, обнаружение, определение, значение, метаболизм.
- •72. Производные пиразола (антипирин, амидопирин) в химико-токсикологическом отношении.
- •73. Производные 1,4 - бензодиазепина в химико-токсикологическом отношении.
- •74. Производные фенотиазина в химико-токсикологическом отношении.
- •75. Общая характеристика пестицидов (ядохимикатов) в химико-токсикологическом отношении. Классификация.
- •76. Пестициды из группы галогенпроизводных (ддт, гхцг, гептахлор) в химико-токсикологическом отношении.
- •77. Пестициды из класса фенолов (днок, диносеб, зоокумарин). Качественное обнаружение и количественное определение. Токсикологическое значение и метаболизм.
- •78. Пестициды класса фосфорорганических соединений (хлорофос, карбофос) в химико-токсикологическом отношении.
- •79. Пестициды, производные карбаминовой кислоты (севин) в химико-токсикологическом отношении.
- •80. Пестициды, производные тиокарбаминовой, дитиокарбаминовой кислот (крысид, тмтд) в химико-токсикологическом отношении.
- •81. Металлоорганические пестициды (гранозан, меркуран, меркургексан) в химико-токсикологическом отношении.
- •82. Неорганические ядохимикаты (фосфид цинка, фторид натрия) в химико-токсикологическом отношении.
- •83. Общая характеристика сероводородного и дробного методов анализа «металлических» ядов.
- •84. Вклад отечественных учёных в разработку химико-токсикологического анализа «металлических ядов».
- •85. Теоретические и методологические основы дробного метода анализа «металлических» ядов, разработанные а.Н. Крыловой.
- •86. Органические реагенты, предложенные а.Н. Крыловой для анализа «металлических» ядов дробным методом.
- •87. Последовательность проведения дробного метода анализа на «металлические» яды.
- •88. Частые методы минерализации органических веществ.
- •89. Минерализация серной и азотной кислотами органических веществ. Достоинства и недостатки.
- •90. Минерализация органических веществ азотной, серной, хлорной кислотами. Достоинства и недостатки метода.
- •91. Методы удаления окислителей из минерализата.
- •92. Исследование осадка после минерализации азотной, серной кислотами (свинец, барий).
- •93. Свинец и тетраэтилсвинец. Качественное обнаружение и количественное определение. Токсикологическое значение.
- •94. Барий в химико-токсикологическом отношении.
- •95. Марганец в химико-токсикологическом отношении.
- •96. Хром в химико-токсикологическом отношении.
- •97. Серебро. Изолирование, качественное обнаружение и количественное определение, поступление, распределение, выведение из организма, токсикологическое значение.
- •98. Медь в химико-токсикологическом отношении.
- •99. Висмут в химико-токсикологическом отношении.
- •100. Сурьма и таллий в химико-токсикологическом отношении.
- •101. Кадмий в химико-токсикологическом отношении.
- •102. Цинк в химико-токсикологическом отношении.
- •103. Ртуть, деструктивные методы изолирования. Качественное и количественное значение. Органические препараты ртути (этилмеркурхлорид).
- •104. Мышьяк в химико-токсикологическом отношении. Общая схема анализа.
- •105. Определение мышьяка в аппарате Марша.
- •106. Определение мышьяка в аппарате Зангер-Блека.
- •107. Изолирование веществ из биологического материала диализом (серная, азотная, соляная кислоты). Качественное обнаружение и количественное определение, токсикологическое значение.
- •108. Изолирование веществ из биологического материала диализом (аммиак, едкий натр, щелочные соли). Качественное обнаружение и количественное определение, токсикологическое значение.
97. Серебро. Изолирование, качественное обнаружение и количественное определение, поступление, распределение, выведение из организма, токсикологическое значение.
Соединения серебра
Токсикологическое значение соединений серебра
Токсикологическое значение имеет растворимый нитрат серебра, нашедший широкое применение в медицине как дезинфицирующее, вяжущее и прижигающее средство, а так же в качестве реактива в химических и фотолабораториях. Соединения серебра, поступившие в желудок, всасываются в кровь в незначительных количествах. Часть этих соединений взаимодействует с хлористоводородной кислотой содержимого желудка и превращается в хлорид, нерастворимый в воде. Нитрат серебра действует на кожу и слизистые оболочки. При поступлении в организм пыли через дыхательные пути, содержащей серебро или его соединения, возникает опасность поражения капилляров легких. При длительном воздействии данного металла может развиться аргирия, отложение серебра в тканях, при которой кожа приобретает серо-зеленую или коричневатую окраску. Выводится из организма главным образом через кишечник. В организме человека серебро содержится в виде естественного фона в количестве от 0,005 (в печени) до 0,01 мг (в костях) на 100 г ткани.
Исследование минерализата на наличие ионов серебра
Реакция образования серебра дитизоната. К 5 мл основного минерализата, при рН = 1—2 добавляют 5 мл хлороформа и по каплям 0,01 % раствора дитизона в хлороформе, сильно встряхивают. При наличии в минерализате ионов серебра хлороформный слой окрашивается в золотисто-желтый цвет.
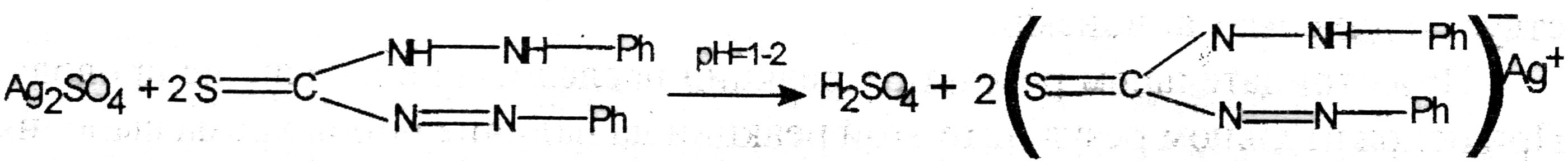
Хлороформный слой отделяют и добавляют 5 мл 0,5 М раствора кислоты хлористоводородной, встряхивают. Серебра дитизонат разрушается разрушается, при этом хлороформный слой окрашивается в зелёный цвет и образуется белый осадок.

При положительном результате реакции с дитизоном, ионы серебра отделяют в виде серебра хлорида: к 90 мл минерализата добавляют 0,5 г натрия хлорида и при наличии осадка или мути, нагревают до кипения. Выпавший осадок отфильтровывают, фильтрат доводят промывными водами до 90 мл и исследуют на другие катионы. Промытый осадок растворяют в 5 каплях 25% раствора аммония гидроксида и исследуют следующими реакциями:
AgCl + 2NH4OH = [Ag(NH3)2]Cl + 2H2O
А) к капле раствора серебра аммиаката на предметном стекле прибавляют каплю кислоты азотной разведённой – выпадает белый творожитстый осадок серебра хлорида:
[Ag(NH3)2]Cl + HNO3 = AgCl + 2NH4NO3
Б) к 0,5 мл раствора, содержащего серебра аммиакат, прибавляют 0,5 мл насыщенного раствора калия йодида. Появление мути или жёлтого осадка указывает на наличие ионов серебра:
[Ag(NH3)2]Cl + KJ = AgJ + KCl + 2NH3
98. Медь в химико-токсикологическом отношении.
Соединения меди
Токсикологическое значение соединений меди
Соединения меди широко используются в промышленности для приготовления красок, травления стекла, в пиротехнике и в керамической промышленности. Ряд неорганических соединений меди используется в сельском хозяйстве в качестве фунгицидов в сочетании с соединениями мышьяка. Сульфат меди применяется в медицине как вяжущее и прижигающее средство. В медицине применяется и цитрат меди. Пары металлической меди, образующиеся при получении различных сплавов, могут попадать в организм с вдыхаемым воздухом и вызывать отравления. Медная посуда, применяемая для варки фруктов, содержащих органические кислоты, также может быть причиной отравления. В определенных количествах медь необходима для нормального функционирования организма человека и животных. Клиническая практика показала, что в ряде случаев возникновение анемии у человека было связано с недостатком меди в продуктах питания. Суточная потребность взрослого человека в меди, по данным ВОЗ, определяется в 2—5 мг или 30 мкг/кг массы тела. Максимально допустимое суточное поступление — 50 мкг/кг. Лишь небольшая часть меди в организме человека находится в виде свободных ионов, основная же часть связана в виде комплексных соединений с белками. Основным белком, содержащим медь, является церулоплазмин. Медь входит в состав ряда важных ферментов, принимающих участие в окислительно-восстановительных реакциях, цитохромоксидазы, аминооксидазы и его содержание в органах в виде естественного фона колеблется от 0,25 до 1,12 мг на 100 г органа. Однако в избыточных количествах медь оказывает токсическое действие. При попадании в организм с пищей, содержащей более 50 мкг/кг, наблюдаются характерные признаки отравления: металлический вкус во рту, неукротимая рвота, боли в животе; после всасывания, соединения меди действуют на капилляры, вызывают гемолиз, поражение печени и почек. При поступлении в меньших количествах медь накапливается в печени, что вызывает физиологические расстройства в организме: тошноту, рвоту; желудочную боль.
Некоторые соединения меди играют роль катализаторов окислительных процессов в пищевых продуктах. Кроме того, ряд соединений меди разрушают витамины С и А, ухудшают органолептические показатели, способствуют образованию токсичных продуктов окисления липидов. Вследствие отмеченных свойств допустимые нормы содержания меди в продуктах устанавливают часто ниже норм, определенных по токсикологическим показателям.
Исследование минерализата на наличие ионов меди
Выделение ионов меди из минерализата. 10 мл фильтрата (после отделения серебра хлорида) нейтрализуют 10 % раствором аммония гидроксида до рН = 3 по универсальному индикатору и встряхивают с 5 мл хлороформного раствора свинца диэтилдитиокарбамата. При наличии ионов меди хлороформный слой окрашивается в желтый или коричневый цвет.
Хлороформный слой отделяют и промывают 30 с 6 М раствором кислоты хлористоводородной для удаления избытка свинца диэтилдитиокарбамата, а затем водой очищенной. После промывания хлороформный слой взбалтывают с 1 % раствором ртути (II) хлорида. Раствор сулемы добавляют по каплям до обесцвечивания хлороформного слоя. Затем к бесцветной жидкости прибавляют 0,5— 1 мл воды, вновь энергично встряхивают, водный слой отделяют и делят на 3 части для проведения качественных реакций на ионы меди.
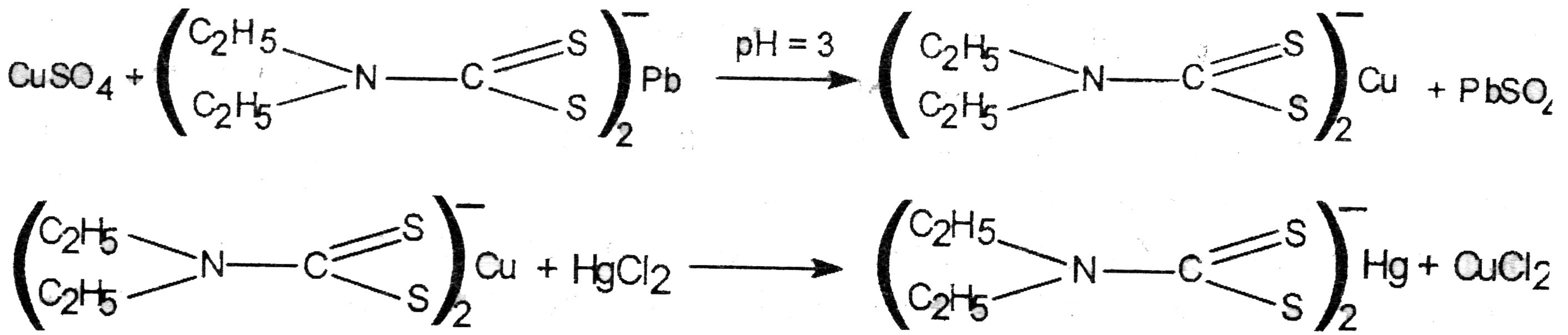
Реакция с пиридин-роданидным реактивом. В пробирку вносят 0,5 мл реэкстракта, к которому по каплям прибавляют 1-2 мл пиридин-роданидного реактива. При этом образуется осадок или муть. К осадку прибавляют 2 мл хлороформа и хорошо взбалтывают. При наличии ионов меди хлороформный слой приобретает изумрудно-зелёную окраску.

Реакция с аммония тетратиоцианатомеркуриатом (II). К 0,5 мл реэкстракта прибавляют несколько капель 5% раствора цинка сульфата и несколько капель раствора аммония тетратиоцианатомеркуриата (II). При наличии ионов меди выпадает розовато-лиловый или фиолетовый осадок тетратиоцианатомеркуриата (II) меди и цинка.
CuCl2 + 2(NH4)2[Hg(CNS)4] + ZnSO4 = CuZn[Hg(CNS)4]2 + 2NH4Cl + (NH4)2SO4
Реакция с калия гексацианоферратом (II). К 0,5 мл реэкстракта прибавляют 2 капли 5% раствора калия гексацианоферрата (II) и 2 капли 2% раствора кадмия хлорида. При наличии катионов меди выпадает красно-бурый осадок.
CuCl2 + CdCl2 + K4[Fe(CN)6] = CuCd[Fe(CN)6] + 4KCl
