
- •Предмет, содержание, задачи токсикологической химии.
- •Краткий исторический очерк развития токсикологической химии.
- •Связь токсикологической химии с другими химическими, фармацевтическими и биологическими науками.
- •Вклад отечественных учёных в развитие токсикологической химии.
- •Организация судебно-медицинской и химико-токсикологической (судебно-химической) экспертизы в России.
- •Объекты химико-токсикологического исследования и вопросы, решаемые химико-токсикологическим анализом. Понятие «яд», «ядовитое вещество». Классификация ядов и отравлений.
- •Специфические особенности химико-токсикологического анализа.
- •Пути поступления чужеродных соединений в организм. Основные факторы, оказывающие влияние на всасываемость и распределение веществ в тканях и биологических средах организма.
- •Превращение и выделение чужеродных веществ из организма. Общая характеристика.
- •Общая характеристика методов исследования, применяемых в токсикологической химии (методы изолирования, очистки, качественного и количественного анализа).
- •11. Судебная химия – основной раздел токсикологической химии.
- •Документация химико-токсикологических экспертиз и правила её
- •Источники ошибок на основных этапах химико-токсикологического анализа.
- •Правила приёма вещественных (химических) доказательств на экспертизу.
- •Значение данных дознания, истории болезни и результатов судебно-медицинского исследования трупов для судебно-химической экспертизы.
- •Микрокристаллоскопия и кристаллооптика в токсикологической химии.
- •Методы количественного определения. Значение этих определений для оценки результатов исследования (показать на примере «металлических ядов»).
- •Реакции отрицательного судебно-химического значения.
- •Классификация ядовитых и сильнодействующих веществ в токсикологической химии.
- •Охрана окружающей среды и перспективы развития токсикологической химии на современном этапе.
- •Классификация наркотических и психотропных веществ. Основные особенности их химико-токсикологического анализа.
- •Современные физико-химические методы, применяемые в анализе наркотических и психотропных веществ. Основные требования к ним.
- •Фармакокинетика, метаболизм, особенности химико-токсикологического анализа опиатов.
- •Фармакокинетика, метаболизм, особенности химико-токсикологического анализа каннабиноидов.
- •Перспективы развития и совершенствования методов судебно-химических исследований вещественных доказательств.
- •26. Теоретические основы изолирования ядовитых и сильнодействующих веществ из биологического материала дистилляцией водяным паром.
- •27.Синильная кислота. Качественное обнаружение и количественное определение.
- •28. Химико-токсикологическое значение синильной кислоты и её производных.
- •29. Ядовитые галогенпроизводные (хлороформ, хлоралгидрат). Изолирование.
- •30. Ядовитые галогенпроизводные (четыреххлористый углерод, 1,2-дихлорэтан).
- •31. Альдегиды (формалин, формальдегид). Изолирование, качественное обнаружение и количественное определение. Токсикологическое значение и метаболизм.
- •32. Ацетон. Изолирование, качественное обнаружение и количественное
- •33. Метиловый спирт. Изолирование, качественное обнаружение и количественное
- •34. Этиловый спирт. Изолирование. Качественное обнаружение и количественное
- •35. Физико-химические методы количественного определения этилового спирта, применение в судебно-химическом анализе.
- •36. Значение этапа количественного определения этилового спирта при химико-токсикологическом исследовании биологических объектов.
- •37. Реакции отличия метилового и этилового спирта. Методы экспресс-анализа спирта. Пробы Раппопорта и Шинкаренко.
- •38.Спирты (амиловый, этиленгликоль). Качественное обнаружение. Токсикологическое значение. Метаболизм.
- •39. Уксусная кислота. Изолирование. Качественное обнаружение и количественное определение. Токсикологическое значение и метаболизм.
- •40. Нитробензол в химико-токсикологическом отношении.
- •41. Фенолы (фенол, трикрезол) в химико-токсикологическом отношении.
- •42. Анилин в химико-токсикологическом отношении.
- •43. Метод изолирования подкисленным спиртом. Его достоинства и недостатки.
- •44. Метод изолирования подкисленной водой. Вклад отечественных учёных в разработку этого метода, его достоинства и недостатки.
- •45. Частный метод изолирования подкисленной водой в.Ф. Крамаренко. Влияние рН среды и др. Факторов на изолирование и экстрагирование алкалоидов.
- •46. Метод изолирования подщелоченной водой, его достоинства и недостатки.
- •47. Салициловая кислота. Изолирование, качественное обнаружение и количественное обнаружение. Токсикологическое значение и метаболизм.
- •48. Химико-токсикологическое значение производных барбитуровой кислоты. Методы изолирования, очистки барбитуратов.
- •49. Качественное обнаружение барбитуратов в судебно-химическом анализе.
- •50. Количественное определение барбитуратов в судебно-химическом анализе.
- •51. Спектрофотометрическое определение производных барбитуровой кислоты в химико-токсикологическом анализе.
- •52. Токсикологическое значение и метаболизм барбитуратов.
- •53. Фенацетин. Качественное обнаружение и количественное определение.
- •54. Предварительные химико-токсикологические исследования при наличии алкалоидов (общеалкалоидные реакции).
- •55. Методы изолирования, очистки и обнаружение алкалоидов.
- •56. Алкалоиды, производные пиридина и пиперидина (кониин, ареколин). Изолирование, качественное обнаружение и количественное определение. Токсикологическое значение и метаболизм.
- •57. Алкалоиды, производные пиридина и пиперидина (никотин, анабазин) в химико-токсикологическом отношении.
- •58. Пахикарпин в химико-токсикологическом отношении.
- •59. Алкалоиды, производные тропана (атропин, гиосциамин) в химико-токсикологическом отношении.
- •60. Алкалоиды, производные тропана (кокаин) в химико-токсикологическом отношении.
- •61. Производные аминокислот ароматического ряда (новокаин, дикаин) в химико-токсикологическом отношении.
- •62. Алкалоиды, производные хинолина (хинин и его соли). Изолирование, качественное обнаружение и количественное определение. Токсикологическое значение и метаболизм.
- •63. Алкалоиды, производные изохинолина (морфин). Изолирование. Качественное обнаружение и количественное определение. Токсикологическое значение и метаболизм.
- •64. Заменители морфина (кодеин, этилморфина гидрохлорид, апоморфин) в химико-токсикологическом отношении.
- •65. Доказательства отравления опием.
- •66. Алкалоиды, производные бензилизохинолина (папаверин, наркотин) в химико-токсикологическом отношении.
- •67. Алкалоиды, производные индола (резерпин, секуренин) в химико-токсикологическом отношении.
- •69. Алкалоиды, производные пирролизидина (платифиллин) в химико-токсикологическом отношении.
- •70. Алкалоиды, производные пиримидина (кофеин, теобромин, теофиллин) в химико-токсикологическом отношении.
- •71. Ациклические алкалоиды (эфедрин). Изолирование, обнаружение, определение, значение, метаболизм.
- •72. Производные пиразола (антипирин, амидопирин) в химико-токсикологическом отношении.
- •73. Производные 1,4 - бензодиазепина в химико-токсикологическом отношении.
- •74. Производные фенотиазина в химико-токсикологическом отношении.
- •75. Общая характеристика пестицидов (ядохимикатов) в химико-токсикологическом отношении. Классификация.
- •76. Пестициды из группы галогенпроизводных (ддт, гхцг, гептахлор) в химико-токсикологическом отношении.
- •77. Пестициды из класса фенолов (днок, диносеб, зоокумарин). Качественное обнаружение и количественное определение. Токсикологическое значение и метаболизм.
- •78. Пестициды класса фосфорорганических соединений (хлорофос, карбофос) в химико-токсикологическом отношении.
- •79. Пестициды, производные карбаминовой кислоты (севин) в химико-токсикологическом отношении.
- •80. Пестициды, производные тиокарбаминовой, дитиокарбаминовой кислот (крысид, тмтд) в химико-токсикологическом отношении.
- •81. Металлоорганические пестициды (гранозан, меркуран, меркургексан) в химико-токсикологическом отношении.
- •82. Неорганические ядохимикаты (фосфид цинка, фторид натрия) в химико-токсикологическом отношении.
- •83. Общая характеристика сероводородного и дробного методов анализа «металлических» ядов.
- •84. Вклад отечественных учёных в разработку химико-токсикологического анализа «металлических ядов».
- •85. Теоретические и методологические основы дробного метода анализа «металлических» ядов, разработанные а.Н. Крыловой.
- •86. Органические реагенты, предложенные а.Н. Крыловой для анализа «металлических» ядов дробным методом.
- •87. Последовательность проведения дробного метода анализа на «металлические» яды.
- •88. Частые методы минерализации органических веществ.
- •89. Минерализация серной и азотной кислотами органических веществ. Достоинства и недостатки.
- •90. Минерализация органических веществ азотной, серной, хлорной кислотами. Достоинства и недостатки метода.
- •91. Методы удаления окислителей из минерализата.
- •92. Исследование осадка после минерализации азотной, серной кислотами (свинец, барий).
- •93. Свинец и тетраэтилсвинец. Качественное обнаружение и количественное определение. Токсикологическое значение.
- •94. Барий в химико-токсикологическом отношении.
- •95. Марганец в химико-токсикологическом отношении.
- •96. Хром в химико-токсикологическом отношении.
- •97. Серебро. Изолирование, качественное обнаружение и количественное определение, поступление, распределение, выведение из организма, токсикологическое значение.
- •98. Медь в химико-токсикологическом отношении.
- •99. Висмут в химико-токсикологическом отношении.
- •100. Сурьма и таллий в химико-токсикологическом отношении.
- •101. Кадмий в химико-токсикологическом отношении.
- •102. Цинк в химико-токсикологическом отношении.
- •103. Ртуть, деструктивные методы изолирования. Качественное и количественное значение. Органические препараты ртути (этилмеркурхлорид).
- •104. Мышьяк в химико-токсикологическом отношении. Общая схема анализа.
- •105. Определение мышьяка в аппарате Марша.
- •106. Определение мышьяка в аппарате Зангер-Блека.
- •107. Изолирование веществ из биологического материала диализом (серная, азотная, соляная кислоты). Качественное обнаружение и количественное определение, токсикологическое значение.
- •108. Изолирование веществ из биологического материала диализом (аммиак, едкий натр, щелочные соли). Качественное обнаружение и количественное определение, токсикологическое значение.
48. Химико-токсикологическое значение производных барбитуровой кислоты. Методы изолирования, очистки барбитуратов.
ПРОИЗВОДНЫЕ БАРБИТУРОВОЙ КИСЛОТЫ В ХИМИКО-ТОКСИКОЛОГИЧЕСКОМ ОТНОШЕНИИ
Из лекарственных веществ, экстрагируемых органическим растворителем из кислого раствора, наибольшее токсикологическое значение имеют производные барбитуровой кислоты. Эта группа веществ подлежит обязательному судебно-химическому исследованию при проведении общего судебно-химического анализа (Приказ МЗ СССР №1021 от 25 12 1973 г).
Первый из барбитуратов - барбитал- синтезирован в 1881 г. В медицинскую практику производные барбитуровой кислоты были введены в 1903 г Фишером и Мерингом. В настоящее время синтезировано около 2500 производных, из которых в нашей стране применяется 11.
Токсикологическое значение производных барбитуровой кислоты очень велико. С одной стороны, барбитураты обладают высокой фармакологической активностью, поэтому их передозировка может привести к различным осложнениям и даже вызвать смертельный исход. С другой - они достаточно доступны для населения, т. к. широко используются в медицинской практике в качестве снотворных, седативных, противосудорожных средств. В технике и в фотографии применяются как ингибиторы и антиоксиданты, в химических лабораториях как реактивы. При длительном применении они вызывают пристрастие и привыкание, т.е. барбитуровую токсикоманию и наркоманию (барбамил и этаминал-натрий официально отнесены к наркотическим средствам). Все эти факторы приводят к тому, что производные барбитуровой кислоты занимают одно из первых мест по количеству вызываемых ими отравлений.
В основе химического строения барбитуратов лежит кольцо малонилмочевины, или барбитуровой кислоты, которая может быть получена при взаимодействии мочевины и диэтилового эфира малоновой кислоты:
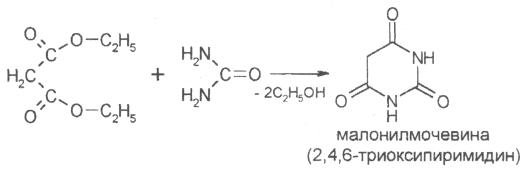
Барбитуровая кислота является циклическим уреидом и может рассматриваться как производное пиримидина (2,4,6 - триоксипиримидин). Атомы водорода метиленовой группы в 5-ом положении пиримидинового кольца, а также водород, стоящий у атомов азота в 1-ом и 3-ем положениях, подвижны и способны замещаться различными органическими радикалами, атом кислорода в положении 2 также способен замещаться на атом S. На этих свойствах и основан синтез производных барбитуровой кислоты.

По физическим свойствам все интересующие в настоящее время судебно-химическую экспертизу барбитураты представляют собой белые кристаллические порошки без запаха, горького вкуса, лишь тиопентал имеет желтоватый оттенок и обладает слабым запахом серы.
Кислотные (молекулярные формы) барбитуратов растворимы в эфире, хлороформе, спирте и некоторых других органических растворителях, натриевые соли – в воде.
Барбитураты имеют высокие температуры плавления больше 100 по Цельсию и способны возгоняться без разложения, что используется для очистки от посторонних примесей при выделении из биологического материала.
Лактим-лактамная таутомерия
В водных растворах барбитураты обладают кислотными свойствами. Это объясняется тем, что барбитураты в зависимость от рН среды способны существовать в нескольких таутомерных формах:
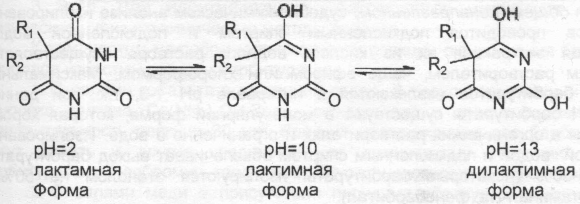
В случае N-замещенных производных возможно образование только лактимной структуры, т. к. второй атом N замещен радикалом (Ra).
Кислотные свойства обусловлены тем, что атомы водорода гидроксильных групп способны отщепляться в виде ионов, подобно тому, как это происходит в фенольном гидроксиле, и замещаться на атом Me, образуя солеобразные соединения.
На лактим-лактамной таутомерии барбитуратов основано получение их натриевых производных, которые, в отличие от лактамных форм, хорошо растворяются в воде (мединал - производное барбитала, барбамил, этаминал-натрий, гексенал, тиопентал). В то же время, Na-производные плохо растворяются в органических растворителях, таких, как эфир, хлороформ, бензол, дихлорэтан и других. Лактамные формы, наоборот, хорошо растворимы в указанных органических растворителях, спирте, щелочах (в последних за счет образования Na-производных).
Способность барбитуратов существовать в нескольких таутомерных формах и различная растворимость этих форм в воде и органических растворителях используется для их изолирования и очистки при выделении из биологического материала.
На этом же свойстве барбитуратов основано исследование их в УФ-области спектра, т. к. таутомерные формы обладают различным светопоглощением.
