
- •«Утверждаю»
- •Занятие №1
- •Правила техники безопасности при работе в лаборатории аналитической химии
- •Общие требования безопасности для работников химической лаборатории
- •Первая помощь при ожогах химическими веществами
- •Работа с кислотами и щелочами
- •Запрещается:
- •Работа с огнеопасными веществами
- •Занятие №2
- •Лабораторная работа №1
- •1. Владеть пробирочным методом проведения анализа.
- •3. Расшифровать полученные результаты и сделать выводы по ним.
- •1. Лекции по аналитической химии.
- •4. Васильев в.П. Аналитическая химия. В 2 ч. М.: Высшая школа, 1989.
- •Лабораторная работа №2
- •1. Лекции по аналитической химии.
- •Занятие №3
- •По кислотно-основной классификации»
- •1. Лекции по аналитической химии.
- •Кислотно-основная классификация
- •Первая группа катионов
- •Анализ смеси катионов I группы
- •Анализ смеси катионов
- •1. Внешний вид вещества (описание физических свойств)
- •2. Предварительные испытания
- •3. Растворимость в воде, если вещество в сухом виде
- •4. Дробные обнаружения катионов
- •Алгоритм хода анализа смеси катионов I группы
- •Обнаружение или подтверждение присутствия катионов в растворе
- •Итоговый вывод работы:
- •Занятие №4
- •По кислотно-основной классификации»
- •1. Лекции по аналитической химии.
- •Вторая группа катионов
- •Анализ смеси катионов II группы
- •Алгоритм хода анализа смеси катионов II группы
- •Осадить хлориды
- •Анализ смеси катионов
- •1. Внешний вид вещества (описание физических свойств)
- •2. Предварительные испытания
- •3. Растворимость в воде, если вещество в сухом виде
- •4. Дробные обнаружения катионов
- •Светло-желтый осадок AgI Обнаружение или подтверждение присутствия катионов в растворе
- •Итоговый вывод работы:
- •Занятие №5
- •По кислотно-основной классификации»
- •1. Лекции по аналитической химии.
- •Третья группа катионов
- •Анализ смеси катионов III группы
- •Анализ смеси катионов
- •1. Внешний вид вещества (описание физических свойств)
- •2. Предварительные испытания
- •3. Дробные обнаружения катионов
- •Алгоритм хода анализа смеси катионов III группы
- •Удаление полное
- •Результаты анализа
- •Обнаружение или подтверждение присутствия катионов в растворе
- •Итоговый вывод работы:
- •Занятие №6
- •«Анализ смеси катионов I - III аналитических групп»
- •1. Лекции по аналитической химии.
- •Анализ смеси катионов I, II и III групп
- •Анализ смеси катионов
- •1. Внешний вид вещества (описание физических свойств)
- •2. Предварительные испытания
- •Алгоритм хода анализа смеси катионов I - III групп
- •Растворить
- •3. Дробные обнаружения катионов
- •4. Растворимость в воде, если вещество в сухом виде
- •Анализ раствора на присутствие катионов
- •Обнаружение или подтверждение присутствия катионов в растворе
- •Итоговый вывод работы:
- •Занятие №7
- •По кислотно-основной классификации»
- •1. Лекции по аналитической химии.
- •Анализ смеси катионов IV аналитической группы
- •Алгоритм хода анализа смеси катионов IV группы
- •Растворить
- •Синее окрашивание
- •Анализ смеси катионов
- •1. Внешний вид вещества (описание физических свойств)
- •2. Предварительные испытания
- •3. Дробные обнаружения катионов
- •4. Растворимость в воде, если вещество в сухом виде
- •Обнаружение или подтверждение присутствия катионов в растворе
- •Итоговый вывод работы:
- •Занятие №8
- •По кислотно-основной классификации»
- •1. Лекции по аналитической химии.
- •Анализ смеси катионов V гpуппы
- •Алгоритм хода анализа смеси катионов V группы
- •Светло-желтый осадок MgNh4po4
- •Итоговый вывод работы:
- •Занятие №9
- •По кислотно-основной классификации»
- •1. Лекции по аналитической химии.
- •Реакции катионов VI аналитической группы
- •Анализ смеси катионов VI группы
- •Алгоритм хода анализа смеси катионов VI группы
- •Cхема анализа смеси катионов VI аналитической группы
- •Итоговый вывод работы:
- •«Анализ смеси катионов IV- VI аналитических групп»
- •1. Лекции по аналитической химии.
- •Анапиз смеси катионов IV, V и VI rpynn
- •Алгоритм хода анализа смеси катионов IV-VI группы
- •САнализируемый раствор хема анализа смеси катионов IV-VI группы
- •Анализ смеси катионов
- •Итоговый вывод работы:
- •Занятие №10
- •«Анализ смеси катионов I - VI аналитических групп»
- •1. Лекции по аналитической химии.
- •Аиализ смеси катиоиов всех шести аиалитических групп
- •Экспериментальная работа.
- •Итоговый вывод работы:
- •Занятие №11 Тема занятия: «Качественные реакции анионов первой - третьей аналитических групп».
- •1. Лекции по аналитической химии.
- •Общая характеристика анионов
- •Аналитические реакции анионов первой аналитической группы:
- •Внимание! Соединения мышьяка токсичны! При работе с ними необходимо проявлять особую осторожность!
- •Арсин очень ядовит! Реакции проводят только под тягой!
- •Внимание! Все соединения мышьяка ядовиты!
- •Экспериментальная работа. Анализ смеси анионов I группы
- •Аналитические реакции анионов второй аналитической группы:
- •Аналитические реакции анионов третьей аналитической группы:
- •Нитриты токсичны!
- •Экспериментальная работа Анализ смеси II и III группы анионов
- •Итоговый вывод:
- •Экспериментальная работа Самостоятельная работа: Анализ смеси I-III группы анионов
- •Итоговый вывод:
- •Занятие №12
- •«Анализ смеси катионов и анионов. Качественный химический анализ вещества»
- •1. Лекции по аналитической химии.
- •Анализ смесей катионов и анионов (качественный химический анализ вещества)
- •Подготовка вещества к качественному химическому анализу
- •Предварительные наблюдения и испытания
- •Действие разбавленной и концентрированной серной кислоты.
- •Перевод анализируемого образца в раствор (растворение)
- •Занятие № 14
- •«Анализ сухой соли»
- •1. Внешний вид соли (описание физических свойств)
- •2. Предварительные испытания сухой соли
- •3. Дробные обнаружения из сухой соли
- •5. Растворимость водонерастворимой сухой соли в других кислотах
- •Анализ раствора на присутствие катионов
- •Обнаружение или подтверждение присутствия катионов в растворе
- •Анализ растворов на присутствие анионов
- •Обнаружение или подтверждение присутствия анионов
- •Итоговый вывод работы:
- •Занятие №13
- •1. Лекции по аналитической химии.
- •Количественные характеристики.
- •Экстрагенты.
- •Органические растворители.
- •Практические рекомендации.
- •Применение экстракции для разделения катионов Анализ смеси катионов цинка, кадмия и ртути(II)
- •Анализ смеси катионов VI аналитической группы
- •Занятие №15
- •1. Сущность методики
- •2. Предварительные расчеты. Расчет массы навески кристаллогидрата бария хлорида
- •3. Доведение бюкса до постоянной массы
- •4. Взятие навески образца
- •5. Удаление кристаллизационной воды из образца
- •6. Расчет результата анализа
- •7. Статистическая обработка результатов параллельных определений массовой доли кристаллизационной воды в кристаллогидрате бария хлорида
- •1. Сущность методики
- •2. Расчет объема раствора осадителя
- •3. Доведение тигля до постоянной массы
- •4. Получение осаждаемой формы
- •5. Отделение осадка от раствора фильтрованием
- •6. Промывание осадка
- •7. Получение гравиметрической формы
- •8. Расчет результата анализа
- •9. Статистическая обработка результатов параллельных определений
- •Занятие №16
- •1. Сущность методики
- •2. Предварительные расчеты
- •2.1. Расчет массы навески
- •2.2. Расчет объема раствора осадителя
- •3. Доведение тигля до постоянной массы
- •4. Взятие навески образца
- •5. Растворение навески образца
- •6. Получение осаждаемой формы
- •7. Отделение осадка от раствора фильтрованием
- •8. Промывание осадка
- •9. Получение гравиметрической формы
- •10. Расчет результата анализа
- •11. Статистическая обработка результатов параллельных определений
- •1. Сущность методики
- •2. Предварительные расчеты. Расчет массы кальция, необходимой для выполнения анализа с допустимой погрешностью ± 0,2%
- •3. Доведение тигля до постоянной массы
- •4. Получение осаждаемой формы
- •5. Отделение осадка от раствора фильтрованием
- •6. Промывание осадка
- •7. Получение гравиметрической формы
- •8. Расчет результата анализа
- •9. Статистическая обработка результатов параллельных определений массы кальция(II) в растворе
- •Занятие №17
- •1. Сущность методики
- •2. Расчет объема раствора осадителя
- •3. Доведение стеклянного пористого тигля до постоянной массы
- •4. Получение осаждаемой формы
Экстрагенты.
Наиболее часто для экстракции применяют органические реагенты, образующие с ионами металлов внутрикомплексные соединения, малорастворимые в воде, но хорошо растворимые в органических растворителях.
Чаще всего в качестве экстрагентов используются дитизон, диэтилдитиокарбаминат натрия (ДЭДТК), 8-оксихинолин, ацетилацетон.
Органические растворители.
Для экстракции органических веществ и координационных соединений элементов используют органические растворители различной природы:
углеводороды – гексан, циклогексан, бензол, толуол;
хлорпроизводные углеводородов – хлороформ, четыреххлористый углерод, хлорбензол;
спирты – изоамиловый, н –бутиловый, изобутиловый, циклогексанол;
простые и сложные эфиры – диэтиловый эфир, ацетилацетат, бутилацетат;
кетоны – метилизобутилкетон, метилэтилкетон, циклогексанон.
Природа органического растворителя в ряде случаев оказывает существенное влияние на экстракцию. Важны диэлектрическая проницаемость растворителя, его сольватирующая способность, способность участвовать в кислотно-основных взаимодействиях.
Выбор органического растворителя для экстракции зависит от состава соединения. Если в состав экстрагируемого соединения не входят молекулы воды, то природа органического растворителя относительно мало влияет на экстракцию. В этом случае можно использовать разные органические растворители: хлороформ, бензол, спирты и др. Если в состав соединения входят молекулы воды, то такие соединения экстрагируются только растворителями с большой сольватирующей способностью, которые могут либо замещать молекулы воды, либо их блокировать. К таким растворителям относятся кислородосодержащие растворители: спирты, эфиры, кетоны. Можно также использовать смесь растворителей.
Практические рекомендации.
Экстракцию проводят в делительных воронках. После сливания всех необходимых реагентов и экстрагента делительную воронку закрывают стеклянной пробкой и, придерживая пробку указательным пальцем, взбалтывают или плавно переворачивают воронку в течение определенного времени, обычно 2-3 минуты.
Если плотность органического растворителя больше плотности воды, органическая фаза находится снизу (хлороформ, четыреххлористый углерод). Если плотность органического растворителя меньше плотности воды, органическая фаза распологается сверху (бензол, диэтиловый эфир, метилизобутилкетон). После расслаивания фазы разделяют с помощью крана и работают с каждой фазой отдельно. Если в водной фазе необходимо далее проводить экстракцию других элементов, её помещают в делительную воронку. Если водная фаза – нижний слой, её сливают через кран в другую делительную воронку. Если водная фаза – верхний слой, органическую фазу сливают, а водную фазу оставляют в той же воронке.
Для извлечения вещества из органической фазы используют реэкстракцию. К органической фазе в делительной воронке добавляют реэкстрагент, закрывают делительную воронку пробкой и взбалтывают или плавно переворачивают воронку в течение необходимого времени (так же, как и при экстракции). После расслаивания разделяют фазы и обнаруживают искомый элемент в реэкстракте.
Реэкстракция может быть использована и для разделения элементов, находящихся в органической фазе. Для этого используют селективные реэкстрагенты.
Опыт 1. Обнаружение Cr3+
Реактивы и оборудование: раствор соли CrCl3 (или раствор любой растворимой соли хрома),2М HNO3, раствор KMnO4, водяная баня, пробирки и делительная воронка, раствор H2O2, диэтиловый эфир.
Кислота надхромовая H2Cr2O6 образуется, как известно, при действии водорода пероксида на кислый раствор, содержащий дихромат-ионы. Окисление хрома(III) до дихромат-иона в кислой среде можно провести калия перманганатом:
2Cr3+ + 2MnO4ˉ + 5H2O ⇆ Cr2O72¯+ 2MnO(OH)2(T) + 6H+
В присутствии органических растворителей – амилового спирта или диэтилового эфира – кислота надхромовая переходит в органический слой, окрашивая его в сине-фиолетовый цвет. Реакцию используют для дробного обнаружения хрома в присутствии всех других катионов.
Методика проведения опыта: В центрифужную пробирку помещают 2-3 капли исследуемого раствора, подкисляют 2 моль/л раствором HNO3, прибавляют избыток раствора KMnO4 и нагревают несколько минут на водяной бане. Окраска раствора должна быть ярко-малиновой. Если такой окраски нет, добавляют еще KMnO4 и нагревают. Центрифугируют, осадок отбрасывают, центрифугат хорошо охлаждают, прибавляют 8-10 капель диэтилового эфира, несколько капель раствора H2O2 и энергично встряхивают содержимое пробирки. Экстракт окрашивается в синий цвет.
Опыт 2. Обнаружение Fe3+.
Реактивы и оборудование: 0,1% раствор FeCl3,; 10% раствор тиоционата калия (KSCN) или аммония; 2М HCl; смесь изоамилового спирта и бензола (4:1), пробирки и делительная воронка.
Методика проведения опыта: В делительную воронку поместить раствор FeCl3,, добавить несколько капель раствора HCl и раствор тиоционата калия или аммония (в избытке). Все перемешать, отметить окраску раствора и записать уравнение реакции. Затем добавить смесь органических растворителей и встряхнуть несколько раз пробирку. Наблюдается образование двух фаз: органической и водной. Записать в лабораторный журнал уравнение реакции и цвета водной и органической фаз до и после экстракции.
Опыт 3. Обнаружение Co2+
Реактивы и оборудование: растворы солей Co2+, Cu2+ и Fe3+, раствор тиоционата калия (KSCN) или аммония (NH4SCN), раствор KF, раствор SnCl2, амиловый или изоамиловый спирт, пробирки и делительная воронка.
Тиоцианат-ион образует с Co2+ комплексный ион состава [Co(SCN)4]2–.
Полученный комплекс в водном растворе очень непрочен (β =1∙103). Плотность его повышается в менее полярных, чем вода, растворителях, например, в амиловом спирте. Реакции мешает ион Fe3+, образующий с тиоцианат-ионом окрашенный в кроваво-красный цвет комплекс. Мешающее действие Fe3+ устраняется за счет связывания его в прочный бесцветный комплекс [Fe F6]3–.
Можно также использовать раствор хлорида олова(II). В этом случае устраняется мешающее действие не только Fe3+, но и Cu2+, которые восстанавливаются до Fe2+ и Cu+. Реакция может быть использована для дробного открытия Fe3+, Cu2+ и Co2+.
Методика проведения опыта: В пробирку помещают 1 мл дистиллированной воды по 1 капле растворов солей кобальта, меди и железа(III), добавляют NH4SCN в виде сухой соли. Раствор окрашивается в кроваво-красный цвет, что свидетельствует о присутствии Fe3+. Добавляют раствор KF до исчезновения кроваво-красной окраски и наблюдают коричневато-желтую окраску раствора, свидетельствующую о наличии Cu+. Прибавляют несколько капель раствора SnCl2, 6-8 капель амилового (изоамилового) спирта, встряхивают содержимое пробирки. Экстракт окрашивается в синий цвет.
Опыт 4. Обнаружение Al3+
Реактивы и оборудование: раствор соли алюминия ,кристаллический ацетат натрия,1%-ный раствор 8-оксихинолина в хлороформе, пробирки и делительная воронка.
Al3+ образует с 8-оксихинолином в уксусной среде окрашенное в желтый цвет внутрикомплексное соединение, плохо растворимое в воде и хорошо растворимое в ряде органических растворителей:
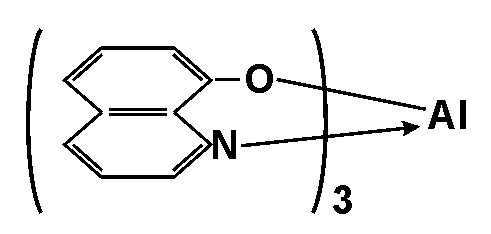
Методика проведения опыта: В пробирку помещают 2-3 капли раствора соли алюминия, добавляют кристаллический натрия ацетат до pH 5, равный объем 10%-ного раствора 8оксихинолина в хлороформе и экстрагируют в течение 1 – 2 мин. Органический слой окрашивается в желтый цвет.
Опыт 5. Обнаружение Cu2+
Реактивы и оборудование: раствор соли меди(II), 20%-ный раствор ацетилацетона в хлороформе, пробирки и делительная воронка.
Cu2+ с ацетилацетоном в азотнокислой среде образует внутрикомплексное соединение, имеющее следующую структуру:
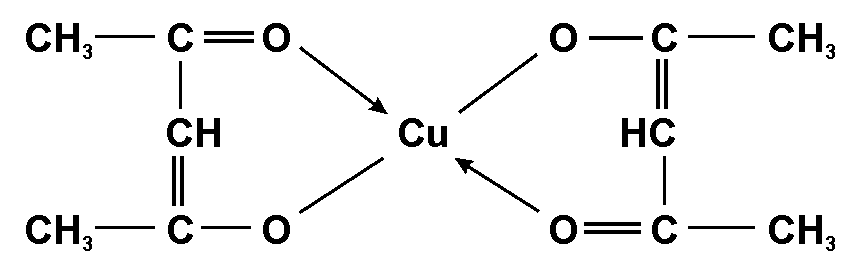
Этот хелатный комплекс экстрагируется хлороформом, окрашивая его в сине-зеленый цвет. Реакция чувствительна, но недостаточно специфична.
Методика проведения опыта: В пробирку помещают 2-3 капли раствора соли меди(II), добавляют 1-2 капли азотной кислоты и несколько капель 20%-ного раствора ацетилацетона в хлороформе. Полученный комплекс экстрагируется в хлороформом, окрашивая его в сине-зеленый цвет.
Опыт 6. Обнаружение Hg2+, Zn2+, Cd2+ реакцией с дитизоном
Реактивы и оборудование: раствор HgCl2, 2М HNO3, раствор соли цинка, 30%-ный раствор NaOH, 20%-ный раствор натрия тартрата, 1%-ный раствор ЭДТА, 0,02%-ный раствор дитизона в четыреххлористом углероде, раствор соли кадмия(II), пробирки и делительная воронка.
Внутрикомплексное соединение с дитизоном образует многие катионы тяжелых металлов. Состав комплексов зависит от pH среды и концентрации реагента.
 Одна
из возможных структур
однозамещенных дитизонатов
Одна
из возможных структур
однозамещенных дитизонатов
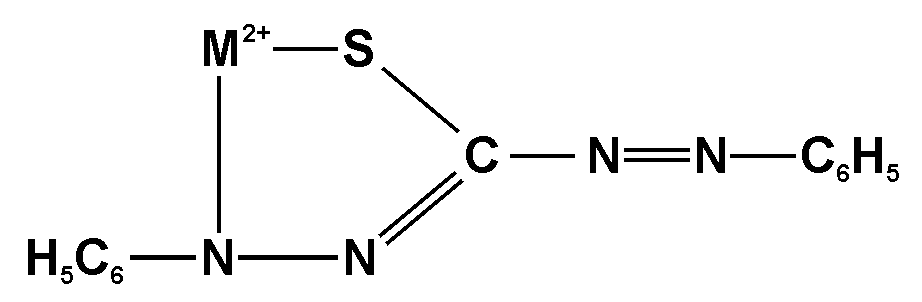
Одна из возможных структур
двухзамещенных дитизонатов
где М – атом металла-комплексообразователя.
Экстракция в виде дитизонатов характерна для катионов, обладающих сродством к сере, т.е. образующих малорастворимые сульфиды. Катионы, дающие экстрагируемые дитизонаты, можно разделить на три группы:
1) Cu2+, Hg2+, Ag+;
2) Zn2+, Ni2+, Co2+;
3) Pb2+, Cd2+.
Извлечение дитизонатов ионов этих групп проводят, соответственно, из кислых (0,5-1 моль/л HCl), уксуснокислых и щелочных растворов. Селективность разделения может быть повышена с помощью маскирования мешающих ионов.
6.1. Обнаружение Hg2+
Методика проведения опыта: К 2-3 каплям раствора HgCl2 добавляют 2 моль/л раствор кислоты азотной до pH=1 по универсальному индикатору и 4-5 капель раствора дитизона в CCl4, встряхивают. Органический слой окрашивается в оранжевый цвет.
6.2. Обнаружение Zn2+
Методика проведения опыта: К нескольким каплям раствора соли цинка имеющего pH=5, добавляют равный объем раствора дитизона в CCl4, встряхивают. Экстракт окрашивается в красный цвет. Обрабатывают экстракт 10 каплями 30%-ного раствора NaOH.
Водная фаза окрашивается в красный цвет (отличие дитизоната цинка от дитизонатов других металлов).
6.3. Обнаружение Cd2+
Методика проведения опыта: К 2-3 каплям раствора соли кадмия(II) прибавляют несколько капель 20%-ного раствора натрия тартрата, 2-3 капли 30%-ного раствора NaOH и экстрагируют разбавленным раствором дитизона в CCl4. В присутствии кадмия(II) органический слой окрашивается в красный цвет. При добавлении к раствору 20-25 капель 1%-ного раствора ЭДТА и встряхивании органическая фаза становится оранжево-коричневой.
Опыт 7. Обнаружение сурьмы(V)
Реактивы и оборудование: раствора сурьмы(III), конц. HCl, кристаллическая соль NaNO2 или KNO2, кристаллическая мочевина, дистиллированная вода, 0,2%-ный раствор метилового фиолетового, бензол. пробирки и делительная воронка.
Сурьма(V) в среде кислоты соляной образует комплексный анион [SbCl6]¯, способный экстрагироваться неполярными растворителями в виде ионных ассоциатов с катионами некоторых органических красителей:
[R]+ + [SbCl6]¯ ⇆ [R+] · [SbCl6¯],
где [R]+ – катион метилового фиолетового или родамина 6Ж.
Методика проведения опыта: В пробирку помещают каплю раствора сурьмы(III), 6 капель концентрированного раствора HCl, несколько кристаллов NaNO2 или KNO2, перемешивают и выдерживают 1 мин. Добавляют около 0,5 г (1 лопаточку) кристаллической мочевины для разрушения избытка нитрит-иона, 10 капель дистиллированной воды. 3 капли 0,2%-ного раствора метилового фиолетового и 6 капель бензола. Энергично встряхивают. Слой органического растворителя окрашивается в фиолетовый цвет.
Вместо метилового фиолетового можно применять родамин 6Ж. Экстракт в этом случае имеет розовую окраску.
Сделать выводы по проведенной лабораторной работе и записать их в журнале. Результаты опытов оформить в виде таблицы.
№ п\п |
Формула экстрагируемого соединения |
Цвет экстрагируемого соединения |
Формула и цвет органического реагента |
Цвет органической фазы после экстракции |
Цвет неорганической фазы после экстракции |
|
|
|
|
|
|
ЛАБОРАТОРНАЯ РАБОТА N10.1.
