
- •Молекулярна фізика. Лабораторний практикум
- •Перелік лабораторних робіт
- •Список рекомендованої літератури
- •Частина і. Молекулярна фізика. Розділ 1. Будова речовини
- •1.1. Модель речовини. Маси атомів і молекул
- •1.2. Сили міжмолекулярної взаємодії. Агрегатні стани речовини
- •1.3. Енергія міжмолекулярної взаємодії. Потенціал Ленарда–Джонса
- •1.4. Структура речовини
- •1.4.1. Газоподібний стан
- •1.4.2. Рідини
- •1.4.3. Тверді тіла
- •Розділ 2. Основи молекулярно-кінетичної теорії газів
- •2.1. Ідеальний газ. Ізопроцеси. Рівняння стану ідеального газу
- •2.2. Тиск і температура ідеального газу. Основне рівняння молекулярно-кінетичної теорії
- •2.3. Поняття про статистичний розподіл. Функції розподілу
- •2.3.1. Закони розподілу молекул ідеального газу за швидкостями й енергіями теплового руху (розподіл Максвелла)
- •2.3.2. Барометрична формула. Розподіл Больцмана
- •2.3.3. Розподіл Максвелла–Больцмана
- •2.3.4. Квантові аспекти розподілів. Розподіли Бозе–Айнштайна і Фермі–Дірака
- •2.4. Середня кількість зіткнень молекул. Середня довжина вільного пробігу
- •Розділ 3. Основи термодинаміки
- •3.1. Головні поняття й означення
- •3.2. Внутрішня енергія ідеального газу Молекули ідеального газу не взаємодіють на відстані, тому
- •Вище доведено, що середня кінетична енергія теплового руху молекули ідеального газу
- •3.3. Теплоємність ідеального газу
- •Для ізобарного процесу
- •3.4. Теплоємність рідин
- •3.5. Теплоємність твердих тіл
- •3.5.1. Класична теорія теплоємності твердих тіл
- •3.5.2. Квантові теорії теплоємності твердих тіл.
- •3.6. Адіабатний процес
- •3.7. Політропні процеси
- •3.8. Робота в термодинамічних процесах
- •3.9. Стисливість газів
- •3.10. Ентропія
- •3.11. Циклічні процеси. Теплові машини
- •Розділ 4. Реальні гази
- •4.1. Рівняння стану реального газу. Рівняння Ван-дер-Ваальса
- •4.2. Внутрішня енергія і теплоємність реального газу
- •Розділ 5. Поверхневий натяг. Капілярні явища
- •На підставі (5.3) рівняння (5.4) запишемо у вигляді
- •Розділ 6. Фазові переходи
- •6.1. Агрегатні стани і фази речовини
- •6.2. Фазові переходи першого і другого роду
- •Розділ 7. Явища перенесення
- •7.1. Самодифузія і взаємна дифузія
- •7.2. Теплопровідність
- •7.4. Розріджені гази. Вакуум
- •Частина іі. Молекулярна фізика. Лабораторний практикум. Лабораторна робота № 201. Визначення коефіцієнта в’язкості рідини методом стокса
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 202. Дослідження залежності коефіцієнта в’язкості рідини від температури
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 203. Визначення коефіцієнта в’язкості рідини за допомогою капілярного віскозиметра оствальда
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №205. Визначення коефіцієнта поверхневого натягу рідини методом відривання кільця
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 206. Дослідження залежності коефіцієнта поверхневого натягу рідини від температури методом максимального тиску в бульбашці
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №208. Дослідження теплового розширення металів
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №209. Визначення питомої теплоємності металів методом охолодження
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 210. Визначення сталої больцмана та універсальної газової сталої
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №211. Визначення середньої довжини вільного пробігу та ефективного діаметра молекул повітря
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 212 визначення співвідношення теплоємностей повітря сp/сv методом клемана–дезорма
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 213. Визначення співвідношення теплоємностей повітря ср / сv методом стоячої хвилі
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 214. Вимірювання вологості повітря психрометром
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 215. Дослідження критичного стану речовини
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №216. Дослідження процесу плавлення кристалічних речовин
- •Порядок виконання роботи
- •Контрольні запитання
- •Додатки Головні фізичні сталі
- •Густина твердих тіл . За температури 20ºС
- •Густина рідин за температури 20ºС
- •Густина газів
- •Додаток 4 Теплофізичні коефіцієнти твердих тіл
- •Додаток 5 Пружні властивості твердих тіл
- •Додаток 6 Коефіцієнти лінійного теплового розширення твердих тіл в інтервалі 0–100 ºС
- •Додаток 7 Швидкість поширення звуку в різних середовищах
- •Додаток 8 Деякі фізичні характеристики рідин
- •Додаток 11 Коефіцієнт об’ємного теплового розширення деяких рідин
2.3. Поняття про статистичний розподіл. Функції розподілу
2.3.1. Закони розподілу молекул ідеального газу за швидкостями й енергіями теплового руху (розподіл Максвелла)
Під час хаотичного руху молекули ідеального газу зазнають багаторазових зіткнень, унаслідок чого змінюються і значення, і напрям їхніх швидкостей. Водночас, як з’ясовано вище, середня квадратична швидкість молекул vкв за умови Т=const є сталою. Це можна пояснити тим, що в газі, який перебуває у рівноважному стані, усталюється певний розподіл молекул за швидкостями. Дж. Максвелл на підставі закономірностей математичної статистики і теорії імовірності вивів закон цього розподілу:
f(v)=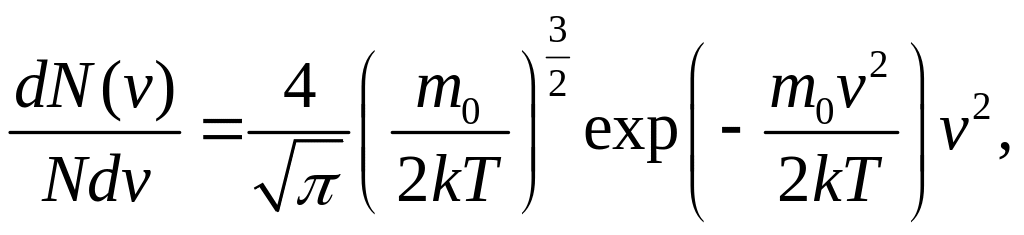 (2.14)
(2.14)
де N – кількість молекул газу; dN(v) – кількість молекул, швидкість яких є в проміжку від v до v+dv.
Розподіл Максвелла описує деяка функція f(v) – функція розподілу молекул за швидкостями, або густина імовірності того, що молекула має швидкість v. Функція f(v)dv визначає відносну кількість молекул газу, швидкість яких є у проміжку від v до v+dv.
Умова нормування функції f(v)
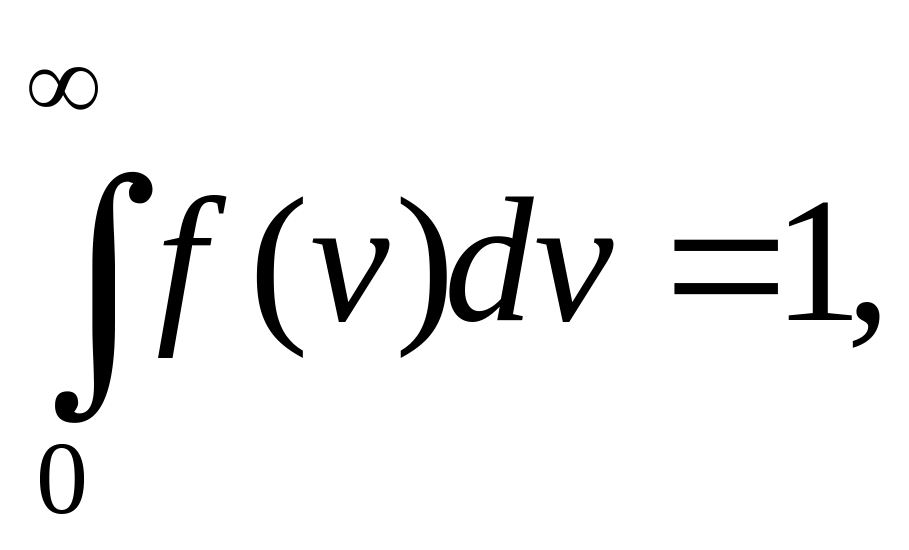 (2.15)
(2.15)
щ
Рис. 2.4. Графік функції
розподілу f(v)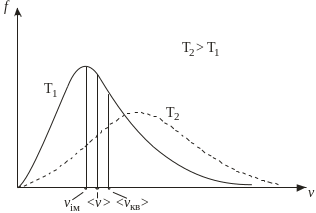
Графік функції
розподілу f(v) показано на рис.
2.4. Характерний вигляд графіка f(v)
зумовлений добутком
![]() .
За малих швид-костей множник v2
у рівнянні (2.14) зростає швидше, ніж спадає
.
За малих швид-костей множник v2
у рівнянні (2.14) зростає швидше, ніж спадає
![]() ,
а за великих швидкостей переважає
експонента.
,
а за великих швидкостей переважає
експонента.
Максимум функції f(v) відповідає найімовірнішій швидкості молекул vі, яку можна знайти шляхом диференціювання (2.14):
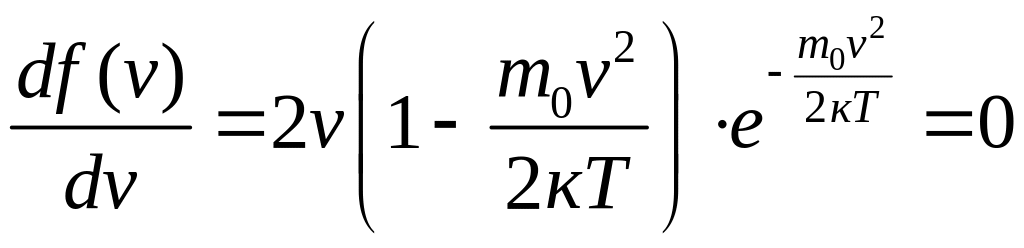 ,
(2.16)
,
(2.16)
звідки 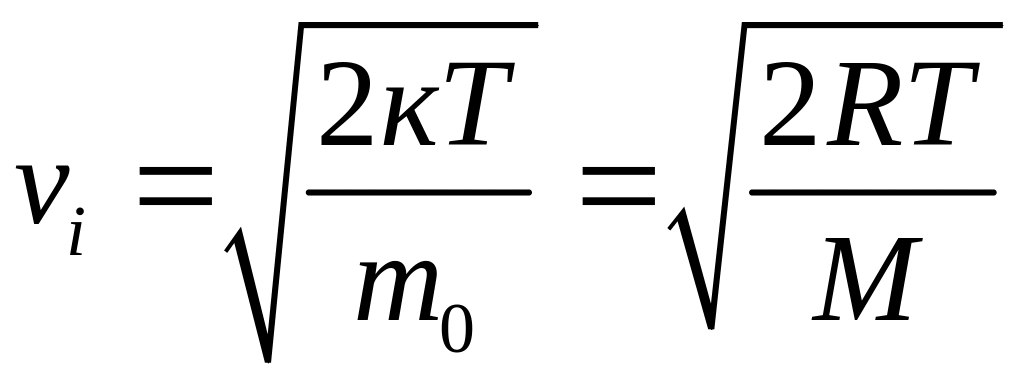 .
(2.17)
.
(2.17)
Зазначимо, що з підвищенням температури максимум функції зсувається в бік більших швидкостей, однак площа під ним є сталою (див. рис. 2.4).
Якщо функція розподілу f(v) відома, то з рівняння (2.14) можна визначити відносну кількість молекул газу, швидкість яких є в заданому проміжку швидкостей v1, v2:
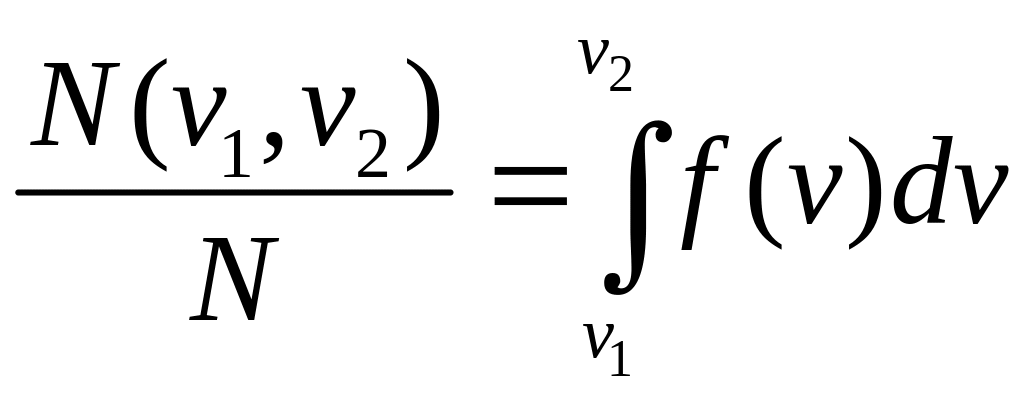 .
(2.18)
.
(2.18)
Оскільки f(v) є густиною імовірності, то можна знайти середнє значення будь-якої функції (v):
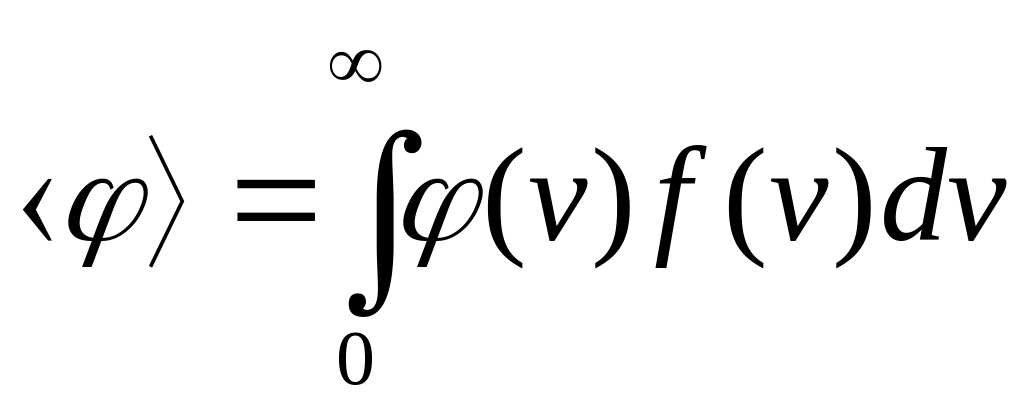 .
(2.19)
.
(2.19)
Скористаємось
(2.19), щоб знайти середню арифметичну v
та середню квадратичну ![]()
швидкості молекул газу:
швидкості молекул газу:
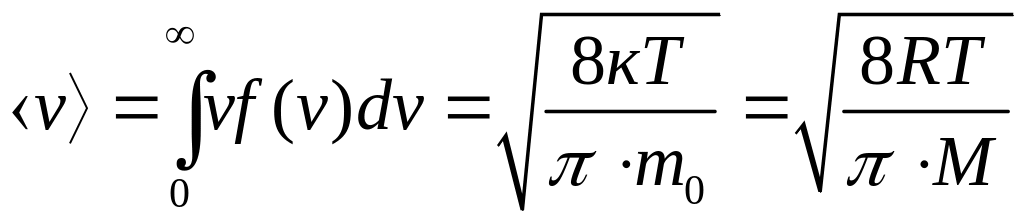 (2.20)
(2.20)
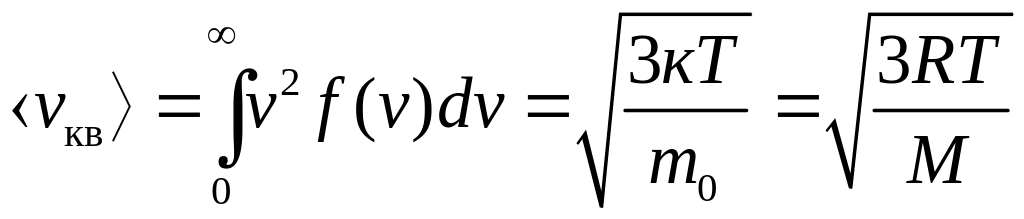 .
(2.21)
.
(2.21)
Як бачимо, вирази для , отримані на підставі розподілу Максвелла (2.21) і з основного рівняння МКТ (2.13), є тотожними.
Середню арифметичну, найімовірнішу та середню квадратичну швидкості називають характерними швидкостями розподілу Максвелла.
Кінетична енергія молекул залежить від їхньої швидкості, тому на підставі (2.14) можна знайти розподіл молекул за їхніми кінетичними енергіями.
Зробимо у (2.14) заміну змінних:
![]() ,
звідки
,
звідки
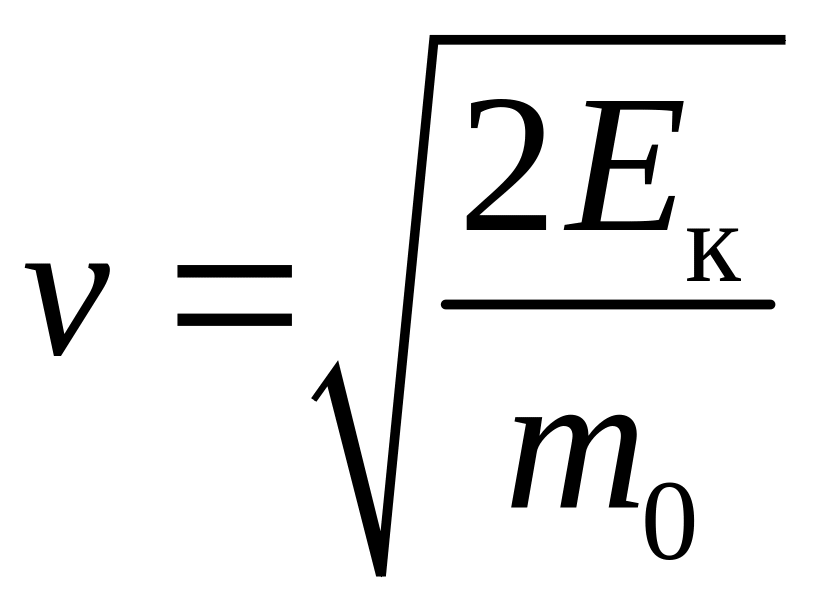 ,
а
,
а
![]() .
(2.22)
.
(2.22)
Тоді із (2.13), (2.14) і (2.22) отримаємо
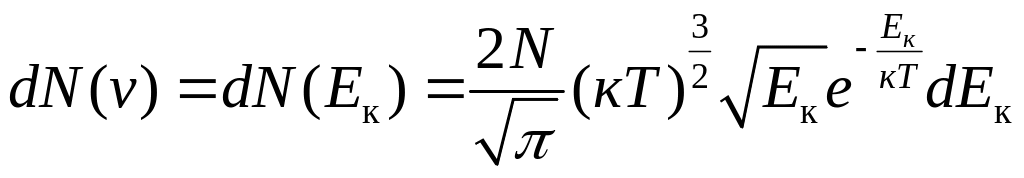 .
(2.23)
.
(2.23)
Функція
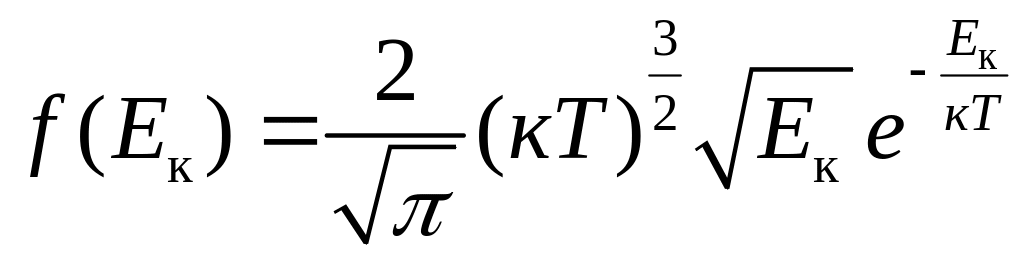 (2.24)
(2.24)
є функцією розподілу молекул за енергією теплового руху.
2.3.2. Барометрична формула. Розподіл Больцмана
У
Рис. 2.5. Зміна атмосферного тиску
з висотою h
![]() , (2.25)
, (2.25)
де р0 – атмосферний тиск на рівні моря (h=0).
Для доведення (2.25) розглянемо статичний вертикальний атмосферний стовп повітря висоти h (рис. 2.5). Нехай на висоті h тиск повітря становить р, тоді на висоті h+dh тиск дорівнюватиме
р-dp. Оскільки в шарі товщиною dh густину повітря можна вважати сталою, то приріст тиску
![]() .
(2.26)
.
(2.26)
Якщо тепер
скористатись рівнянням стану газу p=nkT
і врахувати, що
![]() ,
то
,
то
![]() ,
звідки
,
звідки
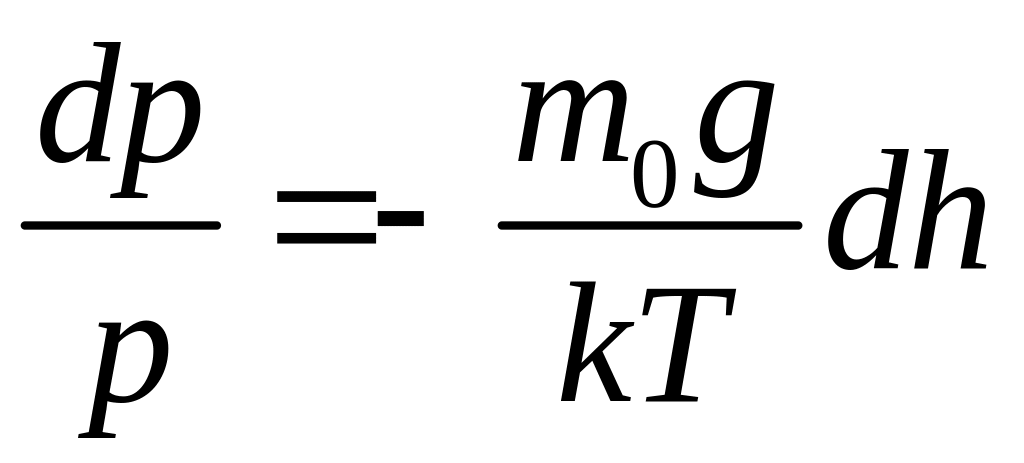 .
(2.27)
.
(2.27)
Проінтегруємо
(2.27) в межах від р0 до р і
від 0 до h, отримаємо формулу Лапласа
(2.25). Якщо тепер знову скористатись
рівнянням стану газу
![]() то (2.25) можна звести до вигляду
то (2.25) можна звести до вигляду
![]() ,
(2.28)
,
(2.28)
де n – концентрація молекул на висоті h, n0 – концентрація молекул на рівні h=0.
Зазначимо, що m0gh – це потенціальна енергія молекул повітря у полі сили земного тяжіння. Больцман довів, що залежність (2.28) характерна для будь-якого газу, який перебуває у потенціальному полі
![]() .
(2.29)
.
(2.29)
Розподіл Больцмана (2.29) описує рівноважний розподіл за потенціальною енергією молекул газу, що перебувають у зовнішньому потенціальному полі сил.
Якщо концентрація частинок невідома в жодній точці поля, але відома загальна кількість частинок N, то розподіл Больцмана записують у вигляді
![]() .
(2.30)
.
(2.30)
Нормувальний множник С знаходять з умови нормування
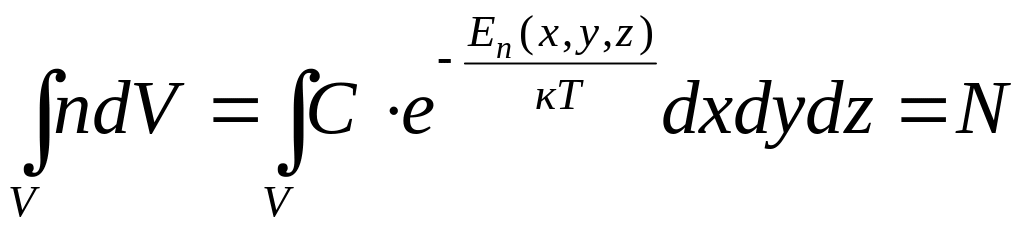 ,
(2.31)
,
(2.31)
де V – об’єм, у якому містяться частинки.
