
- •Молекулярна фізика. Лабораторний практикум
- •Перелік лабораторних робіт
- •Список рекомендованої літератури
- •Частина і. Молекулярна фізика. Розділ 1. Будова речовини
- •1.1. Модель речовини. Маси атомів і молекул
- •1.2. Сили міжмолекулярної взаємодії. Агрегатні стани речовини
- •1.3. Енергія міжмолекулярної взаємодії. Потенціал Ленарда–Джонса
- •1.4. Структура речовини
- •1.4.1. Газоподібний стан
- •1.4.2. Рідини
- •1.4.3. Тверді тіла
- •Розділ 2. Основи молекулярно-кінетичної теорії газів
- •2.1. Ідеальний газ. Ізопроцеси. Рівняння стану ідеального газу
- •2.2. Тиск і температура ідеального газу. Основне рівняння молекулярно-кінетичної теорії
- •2.3. Поняття про статистичний розподіл. Функції розподілу
- •2.3.1. Закони розподілу молекул ідеального газу за швидкостями й енергіями теплового руху (розподіл Максвелла)
- •2.3.2. Барометрична формула. Розподіл Больцмана
- •2.3.3. Розподіл Максвелла–Больцмана
- •2.3.4. Квантові аспекти розподілів. Розподіли Бозе–Айнштайна і Фермі–Дірака
- •2.4. Середня кількість зіткнень молекул. Середня довжина вільного пробігу
- •Розділ 3. Основи термодинаміки
- •3.1. Головні поняття й означення
- •3.2. Внутрішня енергія ідеального газу Молекули ідеального газу не взаємодіють на відстані, тому
- •Вище доведено, що середня кінетична енергія теплового руху молекули ідеального газу
- •3.3. Теплоємність ідеального газу
- •Для ізобарного процесу
- •3.4. Теплоємність рідин
- •3.5. Теплоємність твердих тіл
- •3.5.1. Класична теорія теплоємності твердих тіл
- •3.5.2. Квантові теорії теплоємності твердих тіл.
- •3.6. Адіабатний процес
- •3.7. Політропні процеси
- •3.8. Робота в термодинамічних процесах
- •3.9. Стисливість газів
- •3.10. Ентропія
- •3.11. Циклічні процеси. Теплові машини
- •Розділ 4. Реальні гази
- •4.1. Рівняння стану реального газу. Рівняння Ван-дер-Ваальса
- •4.2. Внутрішня енергія і теплоємність реального газу
- •Розділ 5. Поверхневий натяг. Капілярні явища
- •На підставі (5.3) рівняння (5.4) запишемо у вигляді
- •Розділ 6. Фазові переходи
- •6.1. Агрегатні стани і фази речовини
- •6.2. Фазові переходи першого і другого роду
- •Розділ 7. Явища перенесення
- •7.1. Самодифузія і взаємна дифузія
- •7.2. Теплопровідність
- •7.4. Розріджені гази. Вакуум
- •Частина іі. Молекулярна фізика. Лабораторний практикум. Лабораторна робота № 201. Визначення коефіцієнта в’язкості рідини методом стокса
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 202. Дослідження залежності коефіцієнта в’язкості рідини від температури
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 203. Визначення коефіцієнта в’язкості рідини за допомогою капілярного віскозиметра оствальда
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №205. Визначення коефіцієнта поверхневого натягу рідини методом відривання кільця
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 206. Дослідження залежності коефіцієнта поверхневого натягу рідини від температури методом максимального тиску в бульбашці
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №208. Дослідження теплового розширення металів
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №209. Визначення питомої теплоємності металів методом охолодження
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 210. Визначення сталої больцмана та універсальної газової сталої
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №211. Визначення середньої довжини вільного пробігу та ефективного діаметра молекул повітря
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 212 визначення співвідношення теплоємностей повітря сp/сv методом клемана–дезорма
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 213. Визначення співвідношення теплоємностей повітря ср / сv методом стоячої хвилі
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 214. Вимірювання вологості повітря психрометром
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 215. Дослідження критичного стану речовини
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №216. Дослідження процесу плавлення кристалічних речовин
- •Порядок виконання роботи
- •Контрольні запитання
- •Додатки Головні фізичні сталі
- •Густина твердих тіл . За температури 20ºС
- •Густина рідин за температури 20ºС
- •Густина газів
- •Додаток 4 Теплофізичні коефіцієнти твердих тіл
- •Додаток 5 Пружні властивості твердих тіл
- •Додаток 6 Коефіцієнти лінійного теплового розширення твердих тіл в інтервалі 0–100 ºС
- •Додаток 7 Швидкість поширення звуку в різних середовищах
- •Додаток 8 Деякі фізичні характеристики рідин
- •Додаток 11 Коефіцієнт об’ємного теплового розширення деяких рідин
Розділ 6. Фазові переходи
6.1. Агрегатні стани і фази речовини
Агрегатний стан речовини визначений її термодинамічними параметрами, зокрема тиском Р і температурою Т. Зміна цих параметрів може зумовити зміну агрегатного стану речовини. Часто поняття „агрегатний стан” ототожнюють із поняттям „фази” речовини, що не зовсім правильно, оскільки одному агрегатному стану речовини може відповідати декілька фаз. Зокрема, деякі тверді речовини можуть мати різні кристалічні модифікації (фази). Прикладом таких речовин є вуглець, який у твердому стані може існувати у вигляді графіту або алмазу; лід, для якого характерні п’ять фізичних кристалічних фаз; біле і сіре олово, рідкі кристали тощо. Цю особливість деяких твердих і рідких речовин називають поліморфізмом. Зазначимо, що у газоподібному стані поліморфізму нема.
Фазою називають термодинамічно рівноважний стан речовини з однаковими фізичними та хімічними властивостями і структурою. Гомогенною називають термодинамічну систему, яка складається лише з однієї фази. Система, яка складається з кількох фаз, – є гетерогенною. Приклад гетерогенної системи – вода, у якій плавають куски льоду; вона складається з трьох фаз: лід, вода і суміш повітря з водяною парою. Якщо температура такої системи 0,01оС, а тиск атмосферний, то трифазовий стан системи може зберігатись необмежено довго. Отже, в гетерогенній системі можливий стан фазової рівноваги. Порушити фазову рівновагу можна, змінивши тиск або температуру системи. Перехід речовини з однієї фази в іншу називають фазовим переходом. Фазовий перехід завжди пов’язаний з якісними змінами властивостей речовини.
6.2. Фазові переходи першого і другого роду
Розрізняють фазові переходи першого і другого роду. Фазові переходи першого роду завжди супроводжуються виділенням або поглинанням теплоти, яку називають прихованою теплотою фазового переходу. Прикладами фазових преходів першого роду можуть бути такі процеси, як плавлення, кристалізація, випаровування, конденсація, сублімація, полі-морфні перетворення тощо. Характерним для фазових переходів першого роду є те, що вони відбуваються за сталої температури, тоді як ентропія системи й об’єм фаз змінюються. Сталість температури під час фазового переходу (наприклад, випаровування) можна пояснити тим, що теплота, якої надають тілу, витрачається не на нагрівання, а на роботу з руйнування міжмолекулярних зв’язків. Під час зворотного процесу (конденсації) система виділятиме теплоту за сталої температури.
Ф
Рис. 6.1. Ілюстрація виведеня
рівняня Клапейрона–Клаузіуса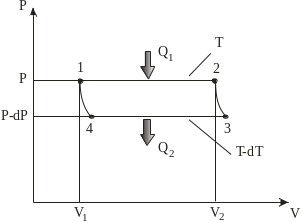
Якщо системі надати кількість теплоти Q1, то її об’єм збільшиться ізотермічно від V1 до V2 (рис. 6.1, процес 1–2), оскільки частина рідини випаровується, щоб підтримувати пару в стані насичення. Тиск насиченої пари за цих умов є сталим. Під час нескінченно малого адіабатного розширення системи (V2V3) її температура зменшується до Т–dT, а тиск – до р–dр. Під час ізотермічно-ізобарного стискання (3–4) об’єм системи зменшується до V4, частина пари конденсується у рідину, а теплота Q2 переходить до холодильника. Далі адіабатним нескінченно малим стисненням (V4V1) систему повертають у початковий стан 1. Корисна робота, виконана системою під час циклу Карно,
![]() .
(6.1)
.
(6.1)
Роботою під час адіабатичних процесів 2–3 і 4–1 ми знехтували, оскільки ΔV1 і ΔV2 є нескінченно малими. Коефіцієнт корисної дії такого циклу Карно
 або
або
![]() .
(6.2)
.
(6.2)
Звідси
 .
(6.3)
.
(6.3)
Нехай кількість наданої системі теплоти Q1 дорівнює питомій теплоті пароутворення r=q (теплота фазового переходу). Тоді зміна об’єму системи V2–V1 дорівнюватиме різниці питомих об’ємів насиченої пари і рідини за температури Т і тиску р:
V2–V1=v2 – v1. (6.4)
За цих умов рівняння (6.4) зведемо до вигляду
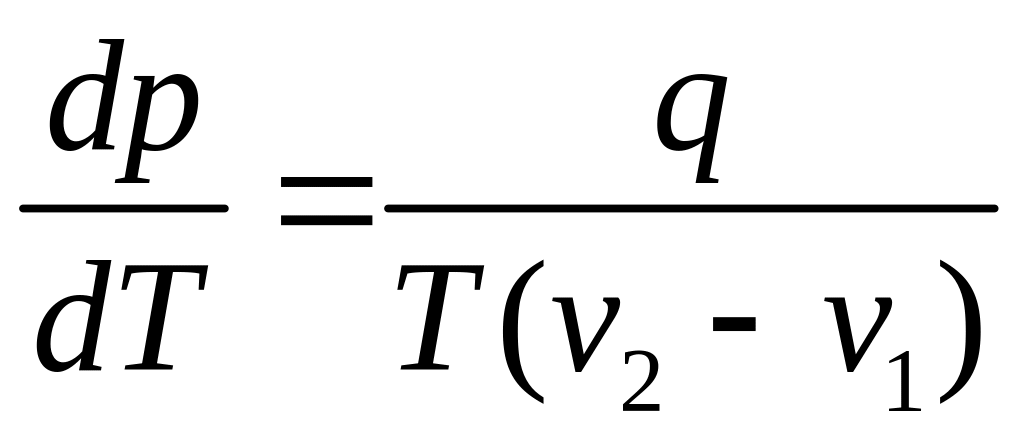 ,
(6.5)
,
(6.5)
де q – питома теплота фазового переходу.
Ц
Рис. 6.2. Фазова діаграма. Потрійна точка
Для однокомпонентних систем, які складаються з хімічно однорідної речовини, поняття фази тотожне поняттю агрегатного стану. Умови існування речовини в одному з трьох агрегатних станів (твердому, рідкому чи газоподібному) визначені тиском і температурою термодинамічної систе-ми. Для зображення фазових переходів використовують діаграму стану (рис. 6.2), на яку в координатах p, V задають залежності між температурою фазового переходу і тиском. На графіку ці залежності показано кривими фазової рівноваги між двома співіснуючими фазами, де АВ – крива сублімації, ВК – крива випаровування, ВС і ВД – криві плавлення. Точка перетину в цих кривих визначає умови одночасного співвідношення всіх трьох фаз речовини – Т3 і р3. Це так звана потрійна точка. Зокрема, для води за нормального атмосферного тиску потрійній точці відповідає температура 273,16 К (0,01оС), це реперна точка для побудови термодинамічної шкали температур. Зазначимо, що криву випаровування ВК завжди позначають скінченним відрізком, який починається у потрійній точці В і закінчується у точці К, яка відповідає критичній температурі Тк. Це пояснюється тим, що за температури Т≥Тк зникає різниця між рідиною і газоподібним станом речовини, отже, немає сенсу говорити про співіснування двох фаз.
Т
Рис. 6.3. Фазова діаграма сірки
Нахил кривих фазової рівноваги визначають на підставі рівняння Клапейрона-Клаузіуса за співвідношенням між V2 i V1. Оскільки q і T є додатними, то за умови V2 >V1 dP/dT>0, а за умови V2<V1, dP/dT<0. Під час сублімації і випаровування об’єм газової фази завжди більший, отже, dP/dT>0 і відповідні криві мають додатний нахил (див. рис. 6.3, криві АВ і ВК). Під час плавлення для більшості речовин об’єм рідкої фази є більшим, ніж об’єм твердої, отже, криві плавлення таких речовин також матимуть додатний нахил (крива ВС). Водночас для деяких речовин (вода, вісмут, германій, чавун та ін.) V2<V1, тому їхні криві плавлення мають від’ємний нахил. Температура плавлення таких речовин знижується з підвищенням тиску (див. рис. 6.2, крива ВД).
За діаграмою стану можна визначити у якому стані перебуватиме речовина за заданих р і Т та які фазові переходи будуть характерними для неї в тому чи іншому процесі. Наприклад, точці 1 відповідає твердий стан, а точці 3 – газоподібний. Під час ізобарного нагрівання (процес 1–2–3) за температури Та речовина плавитиметься. Після повного розплавлення відбуватиметься нагрівання рідини від температури Та до Тb. За температури Тb рідина почне випаровуватись і перейде у газоподібний стан.
Р
Рис. 43 Діаграма плавлення та
випаровування кристалічної речовини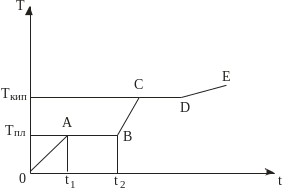
Якщо ж речовина спочатку перебуває в газоподібному стані, і від неї забирають теплоту, то простежуватимемо два протилежні фазові переходи першого роду – за Т=Ткип газова фаза перейде в рідину (конденсація), а за Т=Тпл рідка фаза перетвориться у тверду (кристалізація). Для обох фазових переходів характерне виділення прихованої теплоти за сталої температури. Зазначимо, що, відповідно до рівняння (6.5), температура фазового переходу залежить від тиску.
