
- •Молекулярна фізика. Лабораторний практикум
- •Перелік лабораторних робіт
- •Список рекомендованої літератури
- •Частина і. Молекулярна фізика. Розділ 1. Будова речовини
- •1.1. Модель речовини. Маси атомів і молекул
- •1.2. Сили міжмолекулярної взаємодії. Агрегатні стани речовини
- •1.3. Енергія міжмолекулярної взаємодії. Потенціал Ленарда–Джонса
- •1.4. Структура речовини
- •1.4.1. Газоподібний стан
- •1.4.2. Рідини
- •1.4.3. Тверді тіла
- •Розділ 2. Основи молекулярно-кінетичної теорії газів
- •2.1. Ідеальний газ. Ізопроцеси. Рівняння стану ідеального газу
- •2.2. Тиск і температура ідеального газу. Основне рівняння молекулярно-кінетичної теорії
- •2.3. Поняття про статистичний розподіл. Функції розподілу
- •2.3.1. Закони розподілу молекул ідеального газу за швидкостями й енергіями теплового руху (розподіл Максвелла)
- •2.3.2. Барометрична формула. Розподіл Больцмана
- •2.3.3. Розподіл Максвелла–Больцмана
- •2.3.4. Квантові аспекти розподілів. Розподіли Бозе–Айнштайна і Фермі–Дірака
- •2.4. Середня кількість зіткнень молекул. Середня довжина вільного пробігу
- •Розділ 3. Основи термодинаміки
- •3.1. Головні поняття й означення
- •3.2. Внутрішня енергія ідеального газу Молекули ідеального газу не взаємодіють на відстані, тому
- •Вище доведено, що середня кінетична енергія теплового руху молекули ідеального газу
- •3.3. Теплоємність ідеального газу
- •Для ізобарного процесу
- •3.4. Теплоємність рідин
- •3.5. Теплоємність твердих тіл
- •3.5.1. Класична теорія теплоємності твердих тіл
- •3.5.2. Квантові теорії теплоємності твердих тіл.
- •3.6. Адіабатний процес
- •3.7. Політропні процеси
- •3.8. Робота в термодинамічних процесах
- •3.9. Стисливість газів
- •3.10. Ентропія
- •3.11. Циклічні процеси. Теплові машини
- •Розділ 4. Реальні гази
- •4.1. Рівняння стану реального газу. Рівняння Ван-дер-Ваальса
- •4.2. Внутрішня енергія і теплоємність реального газу
- •Розділ 5. Поверхневий натяг. Капілярні явища
- •На підставі (5.3) рівняння (5.4) запишемо у вигляді
- •Розділ 6. Фазові переходи
- •6.1. Агрегатні стани і фази речовини
- •6.2. Фазові переходи першого і другого роду
- •Розділ 7. Явища перенесення
- •7.1. Самодифузія і взаємна дифузія
- •7.2. Теплопровідність
- •7.4. Розріджені гази. Вакуум
- •Частина іі. Молекулярна фізика. Лабораторний практикум. Лабораторна робота № 201. Визначення коефіцієнта в’язкості рідини методом стокса
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 202. Дослідження залежності коефіцієнта в’язкості рідини від температури
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 203. Визначення коефіцієнта в’язкості рідини за допомогою капілярного віскозиметра оствальда
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №205. Визначення коефіцієнта поверхневого натягу рідини методом відривання кільця
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 206. Дослідження залежності коефіцієнта поверхневого натягу рідини від температури методом максимального тиску в бульбашці
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №208. Дослідження теплового розширення металів
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №209. Визначення питомої теплоємності металів методом охолодження
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 210. Визначення сталої больцмана та універсальної газової сталої
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №211. Визначення середньої довжини вільного пробігу та ефективного діаметра молекул повітря
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 212 визначення співвідношення теплоємностей повітря сp/сv методом клемана–дезорма
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 213. Визначення співвідношення теплоємностей повітря ср / сv методом стоячої хвилі
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 214. Вимірювання вологості повітря психрометром
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 215. Дослідження критичного стану речовини
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №216. Дослідження процесу плавлення кристалічних речовин
- •Порядок виконання роботи
- •Контрольні запитання
- •Додатки Головні фізичні сталі
- •Густина твердих тіл . За температури 20ºС
- •Густина рідин за температури 20ºС
- •Густина газів
- •Додаток 4 Теплофізичні коефіцієнти твердих тіл
- •Додаток 5 Пружні властивості твердих тіл
- •Додаток 6 Коефіцієнти лінійного теплового розширення твердих тіл в інтервалі 0–100 ºС
- •Додаток 7 Швидкість поширення звуку в різних середовищах
- •Додаток 8 Деякі фізичні характеристики рідин
- •Додаток 11 Коефіцієнт об’ємного теплового розширення деяких рідин
Розділ 2. Основи молекулярно-кінетичної теорії газів
2.1. Ідеальний газ. Ізопроцеси. Рівняння стану ідеального газу
У молекулярно-кінетичній теорії (МКТ), як звичайно, користуються ідеалізованою моделлю газу – ідеальним газом. Газ уважатимемо ідеальним, якщо: а) власним об’ємом його молекул можна знехтувати, тобто вважати молекули матеріальними точками; б) сили взаємодії між молекулами газу на відстані не діють, молекули абсолютно пружно взаємодіють лише під час зіткнень.
С
Рис. 2.1. Ізотермічні процеси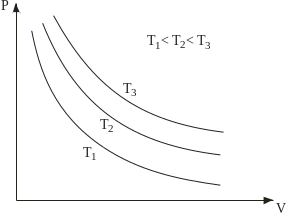
1. Ізотермічний процес – це процес, який відбувається з газом за сталої температури. Його описує закон Бойля–Маріотта: для заданої маси газу за сталої температури добуток тиску газу на його об’єм є сталою величиною:
pV=const, (T= const, m= const). (2.1)
У координатах pV графік процесу показаний гіперболою (рис. 2.1).
Рис. 2.2. Ізобарні процеси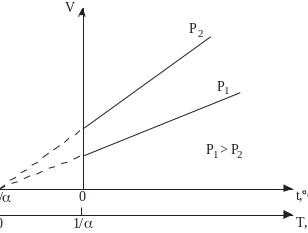
V=V0(1+tC), (2.2)
(р=const, m=const). (2.2)
Тут коефіцієнт =1/273,15 К-1, V0 – об’єм газу за температури t=0оС. Якщо у (2.2) ввести абсолютну температуру Т, то рівняння ізобарного процесу набуде вигляду
![]() =const. (2.3)
=const. (2.3)
Графіки процесів у координатах V t і VT зображені на рис. 2.2.
Рис. 2.3.
Ізохорні процеси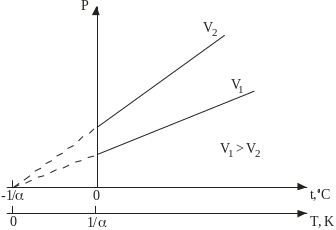
р=р0(1+tC), (2.4)
(V= const, m= const), (2.4)
або
![]() =const
(2.5)
=const
(2.5)
Графіки ізохорних процесів пока-зані на рис. 2.3.
У загальному випадку незалежно від процесів, які відбуваються з ідеальним газом, його стан описує рівняння Клайперона–Менделєєва:
![]() ,
(2.6)
,
(2.6)
де m – маса
газу; М – його молярна маса, R –
універсальна газова стала. Рівняння
(2.6) можна вивести,
розглянувши два процеси переходу газу
зі стану з параметрами p1, V1,
T1 у стан p2, V2,
T2 через проміжний стан p2,
![]() ,
T1 та скориставшись рівняннями
(2.3), (2.5), (2.6).
,
T1 та скориставшись рівняннями
(2.3), (2.5), (2.6).
Рівняння стану ідеального газу можна записати в іншій формі, врахувавши, що m=Nm0, де N – кількість молекул газу; m0 – маса молекули; молярна маса M=NAm0, а R=kNA. Підставимо ці співвідношення у (2.6) і отримаємо:
p=nkT, (2.7)
де n=N/V – концентрація молекул газу.
Отже, за сталої температури тиск газу прямопропорційний до концентрації його молекул.
2.2. Тиск і температура ідеального газу. Основне рівняння молекулярно-кінетичної теорії
Макропараметри
стану газу – тиск р і температуру
Т – ми ввели без визначення фізичного
змісту цих величин. Щоб з’ясувати їхній
фізичний зміст, розглянемо рівняння
тиску одноатомного ідеального газу, що
його чинить цей газ на стінки посудини.
Тиск виникає тому, що під час хаотичного
руху кожна молекула газу стикається зі
стінками посудини і передає їй імпульс
2mvx, де vx –
складова швидкості, яка перпендикулярна
до поверхні стінки. Отже, під час кожного
акту взаємодії на стінку діє сила
![]() .
.
Розглянемо газ як сукупність великої кількості молекул, що рухаються з різними швидкостями, тоді сумарну силу, що діє на стінку, знайдемо шляхом усереднення
F=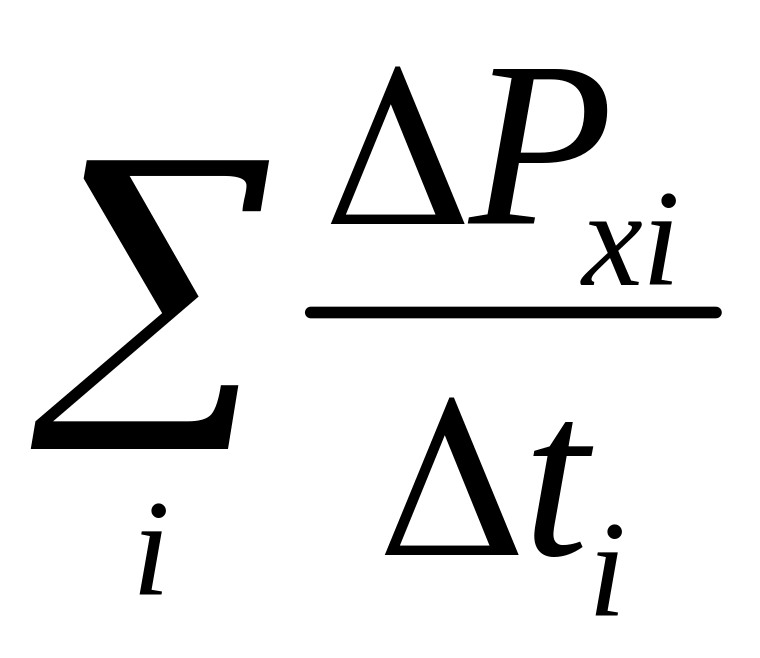 .
(2.8)
.
(2.8)
За цих умов тиск газу
Р=![]() ,
(2.9)
,
(2.9)
де S – площа стінки, з якою взаємодіють молекули.
Зазначимо, що в
ідеальному газі молекули мають лише
кінетичні енергії теплового хаотичного
руху
![]() .
Ці енергії не однакові для різних
молекул, оскільки під час зіткнень їхні
швидкості змінюються і за напрямом, і
за значенням. На практиці використовують
середню кінетичну енергію молекули
.
Ці енергії не однакові для різних
молекул, оскільки під час зіткнень їхні
швидкості змінюються і за напрямом, і
за значенням. На практиці використовують
середню кінетичну енергію молекули
Ек=![]() ,
(2.10)
,
(2.10)
де <Vкв> — середня квадратична швидкість молекул газу.
На підставі цих міркувань виводять основне рівняння МКТ, тобто рівняння тиску ідеального газу.
![]() ,
або
,
або
![]() ,
(2.11)
,
(2.11)
де n – концентрація
молекул газу, m0 – маса молекули;
![]() – середня кінетична енергія поступального
руху молекули.
– середня кінетична енергія поступального
руху молекули.
Отже, тиск дорівнює двом третім середньої кінетичної енергії поступального руху молекул, що містяться в одиниці об’єму газу. Рівняння (2.10) та (2.11) важливі ще й тому, що пов’язують макропараметр стану газу (тиск р) з масою, швидкістю та енергією окремих молекул.
Порівняємо основне рівняння МКТ (2.11) з рівнянням стану одноатомного ідеального газу (2.7) й отримаємо
Ек=![]() .
(2.12)
.
(2.12)
Як бачимо, середня кінетична енергія поступального руху молекули ідеального газу прямопропорційна до його абсолютної температури. Отже, абсолютна температура є мірою середньої кінетичної енергії молекул газу.
Важливо, що (2.12) не містить ніяких характеристик молекул, а це означає, що за сталої температури середні кінетичні енергії молекул будь-яких газів, у тім числі складових суміші, є однаковими, а Ек не залежить від типу газу.
З рівняння (2.12) можна легко отримати вираз для середньої квадратичної швидкості молекул. Оскільки
Ек=![]() то vкв=
то vкв= =
= =
=![]() .
(2.13)
.
(2.13)
