
- •Молекулярна фізика. Лабораторний практикум
- •Перелік лабораторних робіт
- •Список рекомендованої літератури
- •Частина і. Молекулярна фізика. Розділ 1. Будова речовини
- •1.1. Модель речовини. Маси атомів і молекул
- •1.2. Сили міжмолекулярної взаємодії. Агрегатні стани речовини
- •1.3. Енергія міжмолекулярної взаємодії. Потенціал Ленарда–Джонса
- •1.4. Структура речовини
- •1.4.1. Газоподібний стан
- •1.4.2. Рідини
- •1.4.3. Тверді тіла
- •Розділ 2. Основи молекулярно-кінетичної теорії газів
- •2.1. Ідеальний газ. Ізопроцеси. Рівняння стану ідеального газу
- •2.2. Тиск і температура ідеального газу. Основне рівняння молекулярно-кінетичної теорії
- •2.3. Поняття про статистичний розподіл. Функції розподілу
- •2.3.1. Закони розподілу молекул ідеального газу за швидкостями й енергіями теплового руху (розподіл Максвелла)
- •2.3.2. Барометрична формула. Розподіл Больцмана
- •2.3.3. Розподіл Максвелла–Больцмана
- •2.3.4. Квантові аспекти розподілів. Розподіли Бозе–Айнштайна і Фермі–Дірака
- •2.4. Середня кількість зіткнень молекул. Середня довжина вільного пробігу
- •Розділ 3. Основи термодинаміки
- •3.1. Головні поняття й означення
- •3.2. Внутрішня енергія ідеального газу Молекули ідеального газу не взаємодіють на відстані, тому
- •Вище доведено, що середня кінетична енергія теплового руху молекули ідеального газу
- •3.3. Теплоємність ідеального газу
- •Для ізобарного процесу
- •3.4. Теплоємність рідин
- •3.5. Теплоємність твердих тіл
- •3.5.1. Класична теорія теплоємності твердих тіл
- •3.5.2. Квантові теорії теплоємності твердих тіл.
- •3.6. Адіабатний процес
- •3.7. Політропні процеси
- •3.8. Робота в термодинамічних процесах
- •3.9. Стисливість газів
- •3.10. Ентропія
- •3.11. Циклічні процеси. Теплові машини
- •Розділ 4. Реальні гази
- •4.1. Рівняння стану реального газу. Рівняння Ван-дер-Ваальса
- •4.2. Внутрішня енергія і теплоємність реального газу
- •Розділ 5. Поверхневий натяг. Капілярні явища
- •На підставі (5.3) рівняння (5.4) запишемо у вигляді
- •Розділ 6. Фазові переходи
- •6.1. Агрегатні стани і фази речовини
- •6.2. Фазові переходи першого і другого роду
- •Розділ 7. Явища перенесення
- •7.1. Самодифузія і взаємна дифузія
- •7.2. Теплопровідність
- •7.4. Розріджені гази. Вакуум
- •Частина іі. Молекулярна фізика. Лабораторний практикум. Лабораторна робота № 201. Визначення коефіцієнта в’язкості рідини методом стокса
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 202. Дослідження залежності коефіцієнта в’язкості рідини від температури
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 203. Визначення коефіцієнта в’язкості рідини за допомогою капілярного віскозиметра оствальда
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №205. Визначення коефіцієнта поверхневого натягу рідини методом відривання кільця
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 206. Дослідження залежності коефіцієнта поверхневого натягу рідини від температури методом максимального тиску в бульбашці
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №208. Дослідження теплового розширення металів
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №209. Визначення питомої теплоємності металів методом охолодження
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 210. Визначення сталої больцмана та універсальної газової сталої
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №211. Визначення середньої довжини вільного пробігу та ефективного діаметра молекул повітря
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 212 визначення співвідношення теплоємностей повітря сp/сv методом клемана–дезорма
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 213. Визначення співвідношення теплоємностей повітря ср / сv методом стоячої хвилі
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 214. Вимірювання вологості повітря психрометром
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 215. Дослідження критичного стану речовини
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №216. Дослідження процесу плавлення кристалічних речовин
- •Порядок виконання роботи
- •Контрольні запитання
- •Додатки Головні фізичні сталі
- •Густина твердих тіл . За температури 20ºС
- •Густина рідин за температури 20ºС
- •Густина газів
- •Додаток 4 Теплофізичні коефіцієнти твердих тіл
- •Додаток 5 Пружні властивості твердих тіл
- •Додаток 6 Коефіцієнти лінійного теплового розширення твердих тіл в інтервалі 0–100 ºС
- •Додаток 7 Швидкість поширення звуку в різних середовищах
- •Додаток 8 Деякі фізичні характеристики рідин
- •Додаток 11 Коефіцієнт об’ємного теплового розширення деяких рідин
Лабораторна робота № 210. Визначення сталої больцмана та універсальної газової сталої
Завдання: визначити експериментально сталу Больцмана й обчислити універсальну газову сталу.
Приладдя: установка для визначення сталої Больцмана; рідина, яка легко випаровується за кімнатної температури (діетиловий ефір, етиловий спирт, ацетон); шприц медичний.
Теоретичний матеріал, який необхідно засвоїти під час підготовки до виконання роботи: ідеальний газ, рівняння Менделєєва–Клапейрона, закони Авогадро і Дальтона, основне рівняння молекулярно-кінетичної теорії, фізичний зміст сталої Больцмана й універсальної газової сталої.
Література:
1) § 14.5, c. 241–247;
2) § 13.1–13.2, c. 129–138;
3) § 42–44, с. 129–138;
4) § 41–43, с. 73–78.
О
Рис. 11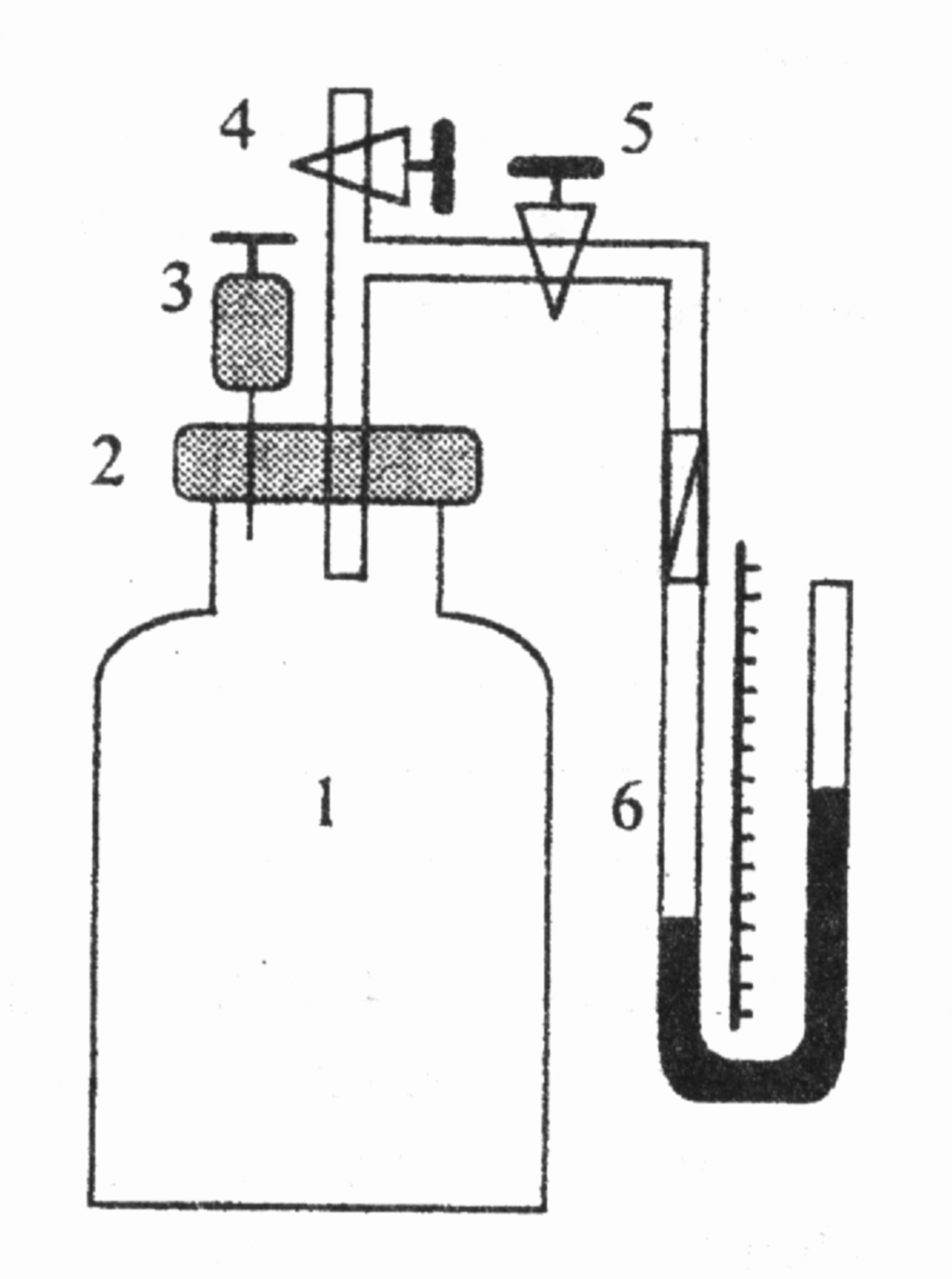
Ідея роботи та виведення робочої формули. Визначення сталої Больцмана в цій роботі ґрунтується на використанні рівняння стану ідеального газу Менделєєва–Клапейрона
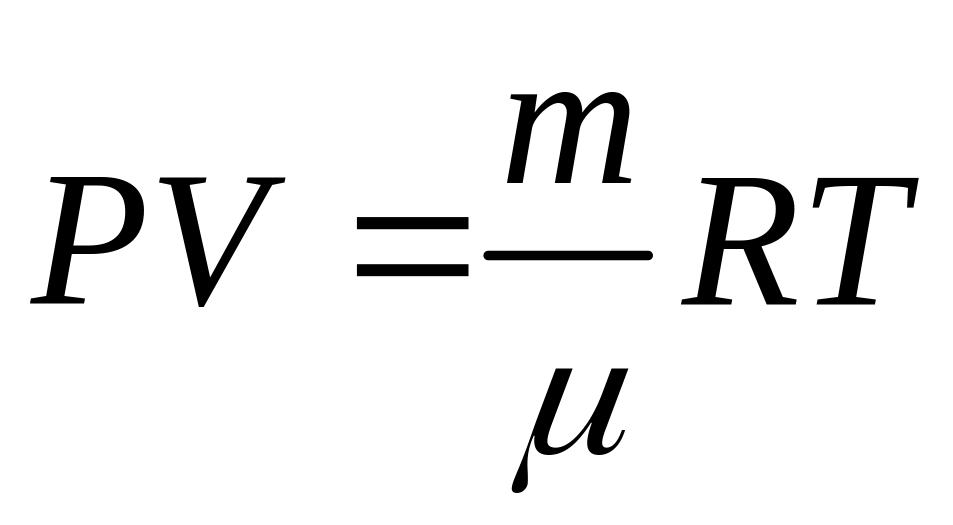 (1)
(1)
та співвідношення між універсальною газовою сталою R і сталою Больцмана k
R=kNA, (2)
де NA= 6,022 •1023 моль-1– число Авогадро.
Як модель ідеального газу в цій роботі використовують пару рідини, яка швидко випаровується за кімнатної температури (наприклад, діетиловий ефір). Якщо порцію ефіру масою m вприснути у закриту посудину об’ємом V0, то тиск у посудині збільшиться від Р0 до Р0 +Р, де Р0 – атмосферний тиск, а Р–парціальний тиск пари ефіру. Стан пари ефіру описує рівняння (1). Тоді з (1) і (2) отримаємо
 ,
(3)
,
(3)
де – молекулярна маса ефіру; Т – абсолютна температура.
У роботі парціальний тиск пари ефіру вимірюють манометром 6:
P = 0gh, (4)
де 0 – густина рідини; h – різниця рівнів рідини в манометрі.
Масу ефіру можна обчислити як
m = V, (5)
де – густина, а V – об’єм ефіру, який уводять у посудину.
Якщо тепер формули (4) і (5) підставити у (3), то отримаємо вираз для розрахунку сталої Больцмана:
 .
(6)
.
(6)
Вирази (6) і (2) є робочими формулами лабораторної роботи.
Порядок виконання роботи
Записати вихідні дані експерименту: 0 = (9,990 ± 0,005)102 кг/м3; = = (7,140 ± 0,005)102 кг/м3; = (76,0 ± 0,1) кг/кмоль; V0 = (22,40 ± 0,05)10-3 м3.
Відкрити крани 4 й 5 і переконатись, що різниця рівнів води в колінах манометра дорівнює нулю.
Закрити кран 4, набрати в шприц порцію ефіру заданого викладачем об’єму V і ввести його в посудину через голку 3 (для забезпечення герметичності шприц із голки не виймати).
Спостерігати за показами манометра 6, очікуючи, коли рівні води в його колінах перестануть змінюватись. Виміряти різницю рівнів води h у колінах манометра і записати в таблицю:
Номер
за пор.
V,
м3
V,
м3
h,
м
h,
м
1
….
С.з.
Відкрити кран 4 на 5–7 хв для провітрювання посудини.
Повторити дослід ще двічі згідно з пунктами 2–4.
Виміряти і записати значення кімнатної температури Т=(......)К.
Обчислити за формулами (6) і (2) k і R у кожному досліді. Результати усереднити.
Похибки вимірювань обчислити за формулами
 ;
;
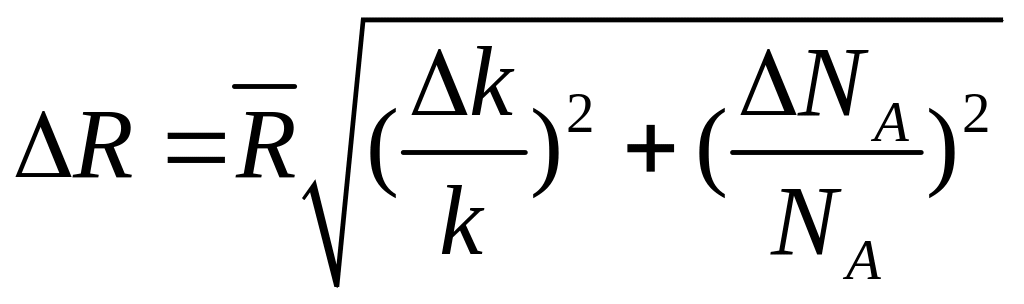 .
.
Записати кінцевий результат експерименту у вигляді
k =k k, Ek = …%;
R =R R, ER = …%.
