
- •Молекулярна фізика. Лабораторний практикум
- •Перелік лабораторних робіт
- •Список рекомендованої літератури
- •Частина і. Молекулярна фізика. Розділ 1. Будова речовини
- •1.1. Модель речовини. Маси атомів і молекул
- •1.2. Сили міжмолекулярної взаємодії. Агрегатні стани речовини
- •1.3. Енергія міжмолекулярної взаємодії. Потенціал Ленарда–Джонса
- •1.4. Структура речовини
- •1.4.1. Газоподібний стан
- •1.4.2. Рідини
- •1.4.3. Тверді тіла
- •Розділ 2. Основи молекулярно-кінетичної теорії газів
- •2.1. Ідеальний газ. Ізопроцеси. Рівняння стану ідеального газу
- •2.2. Тиск і температура ідеального газу. Основне рівняння молекулярно-кінетичної теорії
- •2.3. Поняття про статистичний розподіл. Функції розподілу
- •2.3.1. Закони розподілу молекул ідеального газу за швидкостями й енергіями теплового руху (розподіл Максвелла)
- •2.3.2. Барометрична формула. Розподіл Больцмана
- •2.3.3. Розподіл Максвелла–Больцмана
- •2.3.4. Квантові аспекти розподілів. Розподіли Бозе–Айнштайна і Фермі–Дірака
- •2.4. Середня кількість зіткнень молекул. Середня довжина вільного пробігу
- •Розділ 3. Основи термодинаміки
- •3.1. Головні поняття й означення
- •3.2. Внутрішня енергія ідеального газу Молекули ідеального газу не взаємодіють на відстані, тому
- •Вище доведено, що середня кінетична енергія теплового руху молекули ідеального газу
- •3.3. Теплоємність ідеального газу
- •Для ізобарного процесу
- •3.4. Теплоємність рідин
- •3.5. Теплоємність твердих тіл
- •3.5.1. Класична теорія теплоємності твердих тіл
- •3.5.2. Квантові теорії теплоємності твердих тіл.
- •3.6. Адіабатний процес
- •3.7. Політропні процеси
- •3.8. Робота в термодинамічних процесах
- •3.9. Стисливість газів
- •3.10. Ентропія
- •3.11. Циклічні процеси. Теплові машини
- •Розділ 4. Реальні гази
- •4.1. Рівняння стану реального газу. Рівняння Ван-дер-Ваальса
- •4.2. Внутрішня енергія і теплоємність реального газу
- •Розділ 5. Поверхневий натяг. Капілярні явища
- •На підставі (5.3) рівняння (5.4) запишемо у вигляді
- •Розділ 6. Фазові переходи
- •6.1. Агрегатні стани і фази речовини
- •6.2. Фазові переходи першого і другого роду
- •Розділ 7. Явища перенесення
- •7.1. Самодифузія і взаємна дифузія
- •7.2. Теплопровідність
- •7.4. Розріджені гази. Вакуум
- •Частина іі. Молекулярна фізика. Лабораторний практикум. Лабораторна робота № 201. Визначення коефіцієнта в’язкості рідини методом стокса
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 202. Дослідження залежності коефіцієнта в’язкості рідини від температури
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 203. Визначення коефіцієнта в’язкості рідини за допомогою капілярного віскозиметра оствальда
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №205. Визначення коефіцієнта поверхневого натягу рідини методом відривання кільця
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 206. Дослідження залежності коефіцієнта поверхневого натягу рідини від температури методом максимального тиску в бульбашці
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №208. Дослідження теплового розширення металів
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №209. Визначення питомої теплоємності металів методом охолодження
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 210. Визначення сталої больцмана та універсальної газової сталої
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №211. Визначення середньої довжини вільного пробігу та ефективного діаметра молекул повітря
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 212 визначення співвідношення теплоємностей повітря сp/сv методом клемана–дезорма
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 213. Визначення співвідношення теплоємностей повітря ср / сv методом стоячої хвилі
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 214. Вимірювання вологості повітря психрометром
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № 215. Дослідження критичного стану речовини
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота №216. Дослідження процесу плавлення кристалічних речовин
- •Порядок виконання роботи
- •Контрольні запитання
- •Додатки Головні фізичні сталі
- •Густина твердих тіл . За температури 20ºС
- •Густина рідин за температури 20ºС
- •Густина газів
- •Додаток 4 Теплофізичні коефіцієнти твердих тіл
- •Додаток 5 Пружні властивості твердих тіл
- •Додаток 6 Коефіцієнти лінійного теплового розширення твердих тіл в інтервалі 0–100 ºС
- •Додаток 7 Швидкість поширення звуку в різних середовищах
- •Додаток 8 Деякі фізичні характеристики рідин
- •Додаток 11 Коефіцієнт об’ємного теплового розширення деяких рідин
Контрольні запитання
1. Який газ називають ідеальним?
2. Сформулюйте і поясніть закон Дальтона.
3. Запишіть і поясніть рівняння Менделєєва–Клапейрона.
4. Запишіть і поясніть основне рівняння молекулярно-кінетичної теорії газів.
5. Чим зумовлений тиск газу на стінку посудини і від чого він залежить?
6. Для чого в цій роботі використовують рідини, які легко випаровуються за кімнатної температури?
7. Сформулюйте і запишіть закони, які описують ізопроцеси в ідеальному газі.
8. У чому полягає фізичний зміст універсальної газової сталої? Як її обчислити?
Лабораторна робота №211. Визначення середньої довжини вільного пробігу та ефективного діаметра молекул повітря
Завдання: визначити експериментально середню довжину вільного пробігу та ефективний діаметр молекул повітря шляхом дослідження його проходження через вузький капіляр.
Приладдя: установка для визначення довжини вільного пробігу молекул повітря; секундомір; термометр; барометр.
Теоретичний матеріал, який необхідно засвоїти під час підготовки до виконання роботи: основне рівняння молекулярно-кінетичної теорії (МКТ) газів; довжина вільного пробігу та ефективний діаметр молекул; середня, середня квадратична та імовірніша швидкість молекул; розподіл молекул за швидкостями; рівняння стану ідеального газу; внутрішнє тертя в газах; формула Пуазейля.
Л
Рис. 12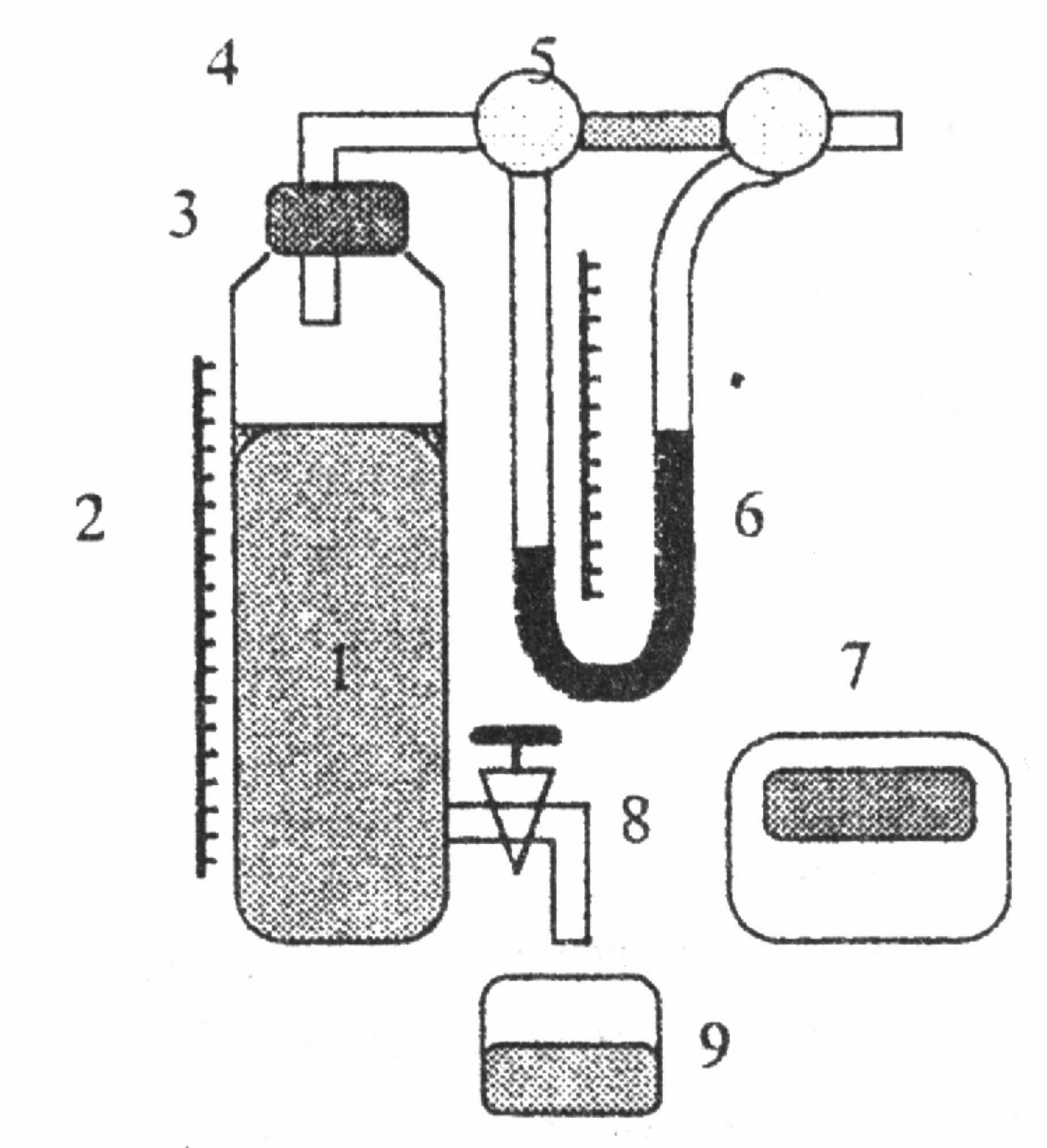
1). § 15.1, c. 263–269; § 14.8, c. 251–255;
2). § 13.1, c. 9–12; § 13.5, c. 17–22;
§ 13.10, c. 27–29;
3). § 42–43, с. 129–138;
4). § 42–44, с. 75–78, § 46,48, с. 81–85.
Опис установки. Установка для визна-чення довжини вільного пробігу молекул газу (рис. 12) містить циліндричну посудину 1, заповнену дистильованою водою і щільно закриту корком 3. Через корок проходить скляна трубка 4, з’єднана з капіляром 5. Манометр 6 призначений для вимірювання різниці тисків повітря на кінцях капіляра 5. В нижній частині посудини 1 розміщений зливний кран 8, за допомогою якого вода з посудини може повільно витікати в мірну склянку 9. Зміну рівня води в посудині 1 вимірюють за допомогою лінійки 2. Секундомір 7 призначений для вимірювання часу проходження повітря через капіляр 5.
Ідея роботи та виведення робочих формул. Молекули газу рухаються хаотично і стикаються одна з одною. Шлях, який молекула проходить між двома послідовними зіткненнями, називають довжиною вільного пробігу , а мінімальну відстань, на яку зближуються молекули під час зіткнення, – ефективним діаметром молекули de. Мікропараметри газу (розмір і маса молекул, швидкість, довжина вільного пробігу та ін.) пов’язані з макропараметрами (тиск, об’єм, температура) рівняннями молекулярно-кінетичної теорії. Отже, вимірявши макропараметри газу, можна за відповідними співвідношеннями розрахувати його мікропараметри.
Згідно з МКТ, коефіцієнт динамічної в’язкості газів
![]() ,
(1)
,
(1)
де – коефіцієнт динамічної в’язкості; – густина; v – середня швидкість теплового руху молекул.
Величинаv залежить від температури Т і молекулярної маси газу :
 ,
(2)
,
(2)
де R – універсальна газова стала.
Густину
газу
можна розрахувати, користуючись
рівнянням Менделєєва–Клапейрона
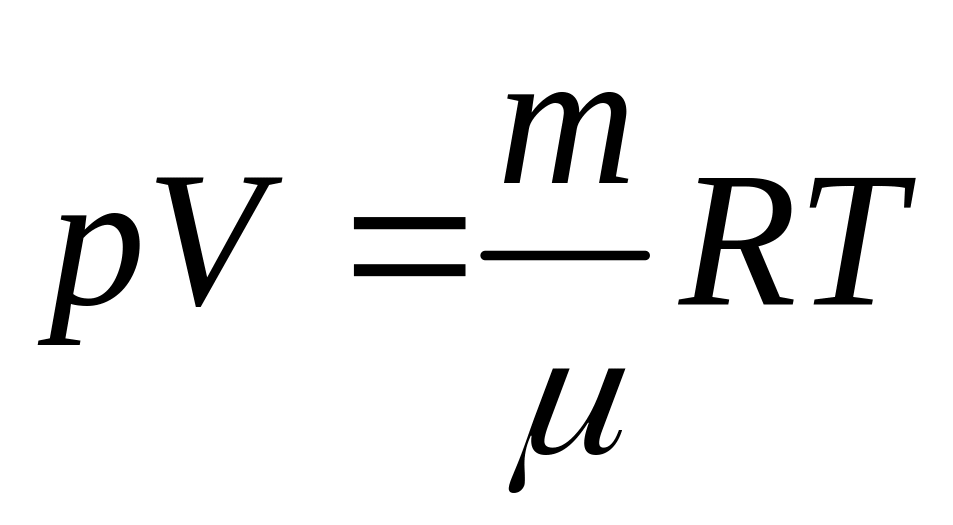 ,
або
,
або
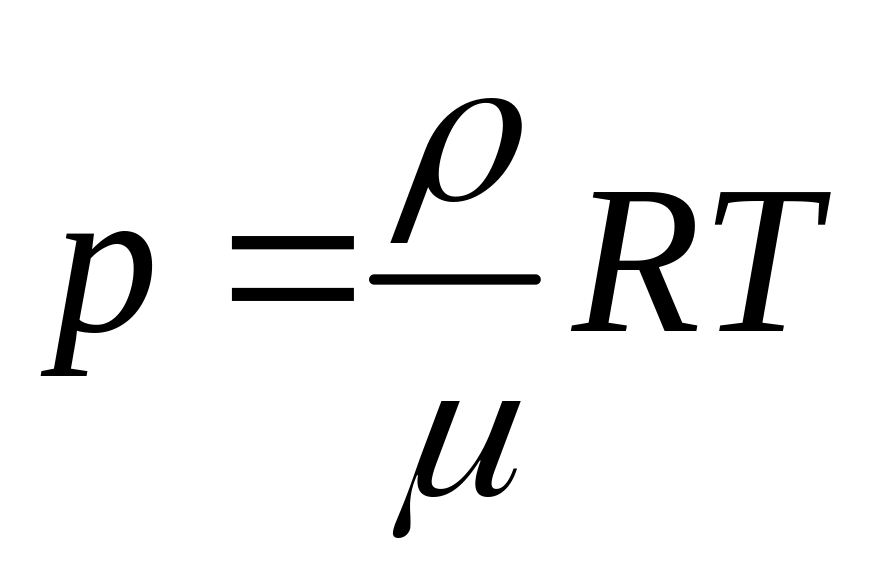 ,
оскільки
,
оскільки
![]() .
Звідси
.
Звідси
![]() .
(3)
.
(3)
Тут P, V і Т – тиск, об’єм і температура газу; m – маса газу.
Якщо газ проходить через капіляр довжиною l і радіусом r, то його коефіцієнт в’язкості , як і для рідин, визначають за формулою Пуазейля
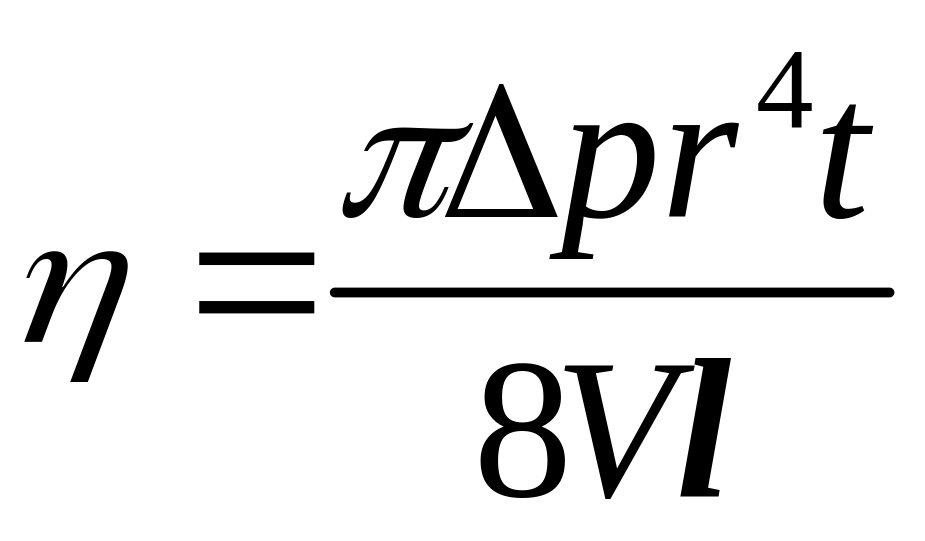 ,
(4)
,
(4)
де P – різниця тисків на кінцях капіляра; t – час протікання газу об’ємом V через капіляр. Підставимо вирази (2)–(4) в (1), отримаємо рівняння, з якого обчислимо:
 .
(5)
.
(5)
Величину P в цій роботі визначають за допомогою манометра 6:
P=gh, (6)
а V– за зміною рівнів води в посудині 1:
V
= S
(H1
– H2),
або
![]() ,
(7)
,
(7)
де D – внутрішній діаметр посудини 1; Н1 і Н2 – висоти рівнів води в посудині на початку і в кінці вимірювання.
Підставимо (6 ) і (7) у (5), отримаємо
 ,
,
або
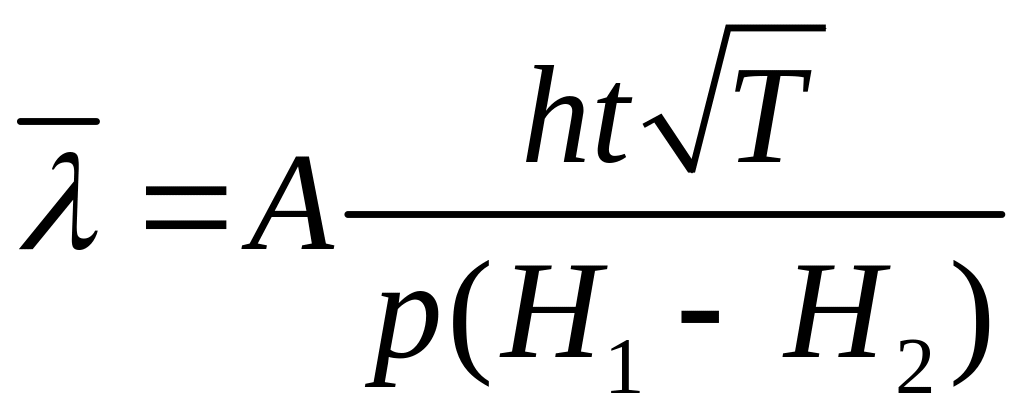 ,
(8)
,
(8)
де А – стала приладу (зазначена в паспорті ).
Розрахуємо тепер ефективний діаметр молекули повітря. З молекулярно-кінетичної теорії газів відомо, що
![]() ,
(9)
,
(9)
де n – концентрація молекул, яку можна визначити з рівняння стану ідеального газу р = nkТ, звідки
![]() ,
(10)
,
(10)
де k=1,38 · 10 -23 Дж/К – стала Больцмана.
Підставимо (10) у (9) і розв’яжемо отримане рівняння відносно de, матимемо
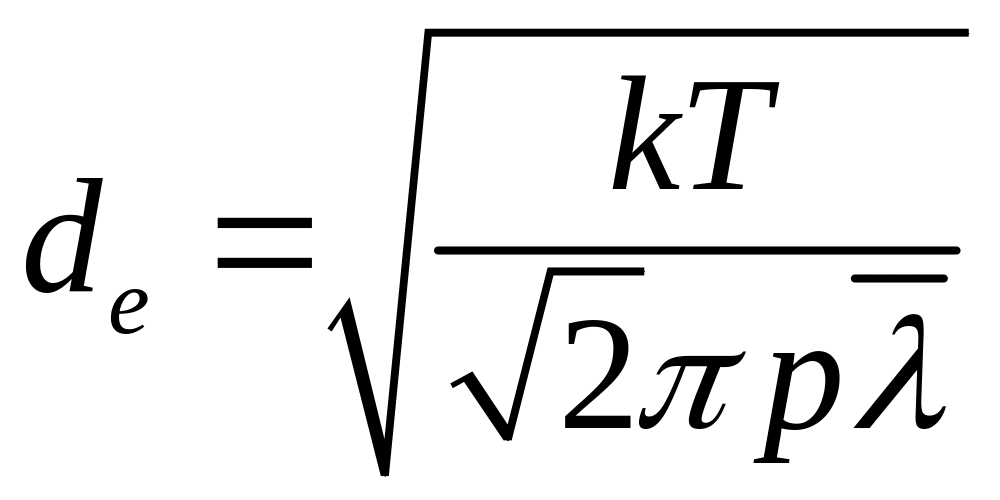 .
(11)
.
(11)
Вирази (8) і (11) є робочими формулами лабораторної роботи.
