
- •Предисловие
- •Модуль курса общей химии «Учение о растворах. Протолитические и гетерогенные равновесия»
- •Темы занятий модуля Для студентов лечебного и педиатрического факультетов
- •Для студентов стоматологического факультета
- •Для студентов медико-профилактического факультета
- •Для студентов фармацевтического факультета
- •Литература
- •Введение
- •Тема: Вода как универсальный биорастворитель. Коллигативные свойства растворов электролитов и неэлектролитов
- • Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Свойства и функции воды
- •1) Растворение веществ с ионным типом связи
- •Гидратация ионов
- •Коллигативные свойства растворов
- •К коллигативным свойствам относятся:
- •Диффузия;
- •Диффузия
- •Осмос. Осмотическое давление
- •Изотонический раствор
- •Гипертонический раствор
- •Гипотонический раствор
- •При снижении осмотического давления крови до 400-350 кПа н аступает гибель организма.
- •Давление насыщенного пара растворителя над раствором
- •Повышение температуры кипения и понижение температуры кристаллизации раствора по сравнению с растворителем
- •Для растворов электролитов в математическое выражение II закона Рауля вводится изотонический коэффициент I:
- •Типовые упражнения и задачи с решениями
- •Переход от массовой доли к молярной концентрации осуществляется по формуле:
- •Обучающие тесты
- •Задачи и упражнения для самостоятельного решения
- •Учебно-исследовательская лабораторная работа Тема: Осмос Опыт №1: Наблюдение явлений плазмолиза и гемолиза
- •Тема: Протолитические процессы и равновесия. Водородный показатель. Колориметрическое определение рН
- •Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Э лектролиты
- •Вывод закона разведения Оствальда:
- •Петер-Йозеф-Вильгельм Дебай (24.03.1884-2.11.1966).
- •Биологическая роль электролитов в организме
- •Средние ежедневные поступления и потери жидкости у взрослых
- •Причины нарушения водного обмена
- •Баланс электролитов в организме
- •Водно-электролитный баланс биологических жидкостей в организме человека
- •Ионное произведение воды. Водородный и гидроксильный показатели
- •Характеристика среды раствора
- •Диапазон изменения рН биологических жидкостей
- •Интервал рН перехода окраски индикаторов
- •Типовые упражнения и задачи с решениями
- •Ответ: степень ионизации гликолевой кислоты 5,44×10–2.
- •Ответ: общая кислотность уксусной кислоты 1,75×10–5 моль/л.
- •Обучающие тесты
- •У чебно-исследовательская лабораторная работа Тема: Определение рН растворов
- •Опыт № 1. Определение рН биологической жидкости с помощью универсального индикатора
- •Опыт № 2. Одноцветные и двуцветные индикаторы
- •Опыт № 3. Смещение равновесия диссоциации уксусной кислоты и гидроксида аммония
- •Тема: Протолитические процессы и равновесия. Теории кислот и оснований. Гидролиз
- • Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Типы протолитических реакций
- •Электронная теория Льюиса
- •Жесткие, мягкие кислоты и основания (жмко)
- •Типовые упражнения и задачи с решениями
- •Задачи и упражнения для самостоятельного решения
- •У чебно-исследовательская лабораторная работа Тема: Гидролиз солей
- •Тема: Протолитические процессы и равновесия. Буферные растворы
- •Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Типовые упражнения и задачи с решениями
- •Учебно-исследовательская лабораторная работа Тема: Буферные системы. Буферные системы организма
- •Опыт 2.1. Определение способности буферных растворов сохранять рН при добавлении щелочей
- •Опыт 2.2. Определение способности буферных растворов сохранять рН при добавлении кислот
- •Опыт 2.3. Определение способности буферных растворов сохранять рН при разбавлении
- •Тема: Протолитические процессы и равновесия. Буферные системы организма
- •Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Гидрокарбонатная буферная система
- •Гидрофосфатная буферная система
- •Белковая буферная система
- •Гемоглобиновая буферная система
- •Бикарбонатной буферных систем
- •Диапазон изменения значений рН при различных типах нарушения кислотно-основного баланса в организме
- •Причины и классификация ацидоза и алкалоза
- •Основные показатели крови при нарушении кислотно-основного баланса
- •Типовые упражнения и задачи с решениями
- •Обучающие тесты
- •Учебно-исследовательская лабораторная работа Тема: Определение буферной емкости сыворотки крови
- •Тема: Гетерогенные процессы и равновесия
- •Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Взаимосвязь Ks и растворимости s:
- •Конкурирующие гетерогенные процессы: конкуренция за катион или анион
- •Формирование костной ткани
- •Патологические гетерогенные процессы в организме
- •Т иповые упражнения и задачи с решениями
- •Обучающие тесты
- •Задачи и упражнения для самостоятельного решения
- •У чебно-исследовательская лабораторная работа Тема: Гетерогенные равновесия
- •Опыт № 1. Условия образования осадка
- •Опыт № 2. Влияние одноименного иона на образование осадка
- •Опыт № 3. Влияние константы растворимости электролитов на их способность к переосаждению
- •Опыт № 4. Условия растворения осадка
- •Теоретические вопросы к контрольной работе по модулю для студентов лечебного и педиатрического факультетов
- •Для студентов стоматологического и медико-профилактического факультетов
- •Экзаменационные теоретические вопросы для студентов лечебного и педиатрического факультетов
- •Для студентов стоматологического факультета
- •Для студентов медико-профилактического факультета
- •Приложение
- •1. Константы некоторых жидкостей, применяемых в качестве растворителей
- •2. Коэффициенты активности f ионов в водных растворах
- •3. Средние значения водородного показателя (рН) биологических жидкостей
- •4. Ионное произведение воды kw при различных температурах
- •5. Силовые показатели и константы ионизации кислот по реакции
- •6. Константы растворимости некоторых малорастворимых солей и гидроксидов (25оС)
- •7. Константы нестойкости комплексных ионов в водных растворах (25оС)
- •8. Измененения содержания воды в организме в зависимости от возраста
- •9. Распределение воды в организме в зависимости от пола
- •10. Основные элементы жидкостных компартментов организма
- •11. Вещества определяющие осмоляльность плазмы
- •12. Наиболее часто используемые кристаллоидные растворы
- •Оглавление
Изотонический раствор
Гипертонический раствор
Гипотонический раствор

Вид
спереди
Вид
в профиль
Нормальные
клетки
(осмотическое равновесие)
Сморщиваюшиеся
клетки (зубчатые)
Набухшие
клетки (гемолизированные)
Рис. 7. Действие осмотического давления на клетки

У животных, которые способны менять количество потребляемой воды в зависимости от обстоятельств, действует особая система осморегуляции. Например, осмолярность мочи бобра, не испытывающего дефицита воды, равна 0,6 осмоль/л, а у живущего в пустыне тушканчика – 9 осмоль/л. У пресноводных рыб тка
невые жидкости гипертоничны по отношению к пресной воде, поэтому такие рыбы накачивают воду путем осмоса через жаберные щели, выводя ее потом из организма с большим объемом разведенной мочи. Напротив, у морских рыб тканевые жидкости гипотоничны по отношению к морской воде, поэтому они через жаберные щели выделяют воду, а для ее компенсации пьют морскую воду. Моча, выделяемая такими рыбами, изотонична морской воде и объем ее очень мал.
При снижении осмотического давления крови до 400-350 кПа н аступает гибель организма.
Онкотическое давление – осмотическое давление, создаваемое за счёт наличия белков в биожидкостях организма. Оно составляет 0,5% от суммарного осмотического давления плазмы крови. В результате понижения онкотического давления при гипопротеинемии происходит перераспределение жидкости в сторону ткани и возникновение онкотических отёков («голодных» или «почечных»).
Давление насыщенного пара растворителя над раствором
Д авление
насыщенного пара над растворителем
(ро)
– давление,
при котором при данной температуре в
системе «жидкость–пар» наступает
динамическое равновесие, характеризующееся
равенством скоростей испарения и
конденсации.
авление
насыщенного пара над растворителем
(ро)
– давление,
при котором при данной температуре в
системе «жидкость–пар» наступает
динамическое равновесие, характеризующееся
равенством скоростей испарения и
конденсации.
Давление насыщенного Давление насыщенного
 пара
растворителя р0
> p
пара растворителя
пара
растворителя р0
> p
пара растворителя
Чистый растворитель Раствор

 – частица
растворителя; – частица растворенного
нелетучего вещества
– частица
растворителя; – частица растворенного
нелетучего вещества
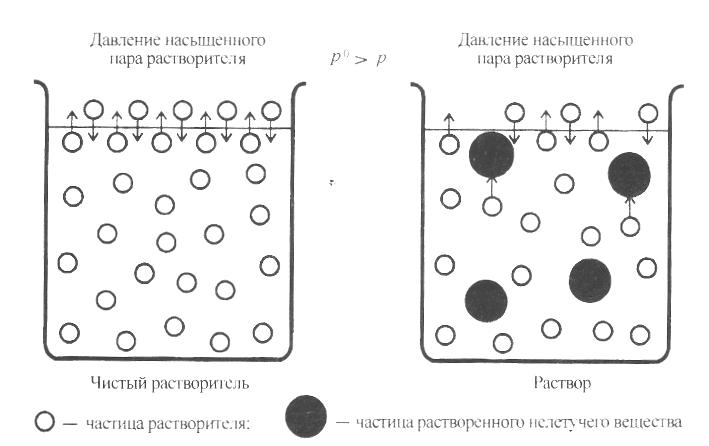
Рис. 8. Испарение чистого растворителя и испарение растворителя
из раствора
Если в растворитель ввести нелетучий неэлектролит (рис. 8), то испарение молекул растворителя уменьшится вследствие:
уменьшения подвижности молекул растворителя за счёт межмолекулярного и ион-дипольного взаимодействия растворитель–вещество;
уменьшения поверхности испарения, т.к. часть поверхности занята молекулами нелетучего вещества;
уменьшения молярной доли растворителя и нарушения за счёт этого равновесия жидкость-пар. В соответствии с принципом Ле Шателье начинает протекать процесс, стремящийся ослабить влияние воздействия, т.е. конденсация, что и приводит к уменьшению количества пара, а, следовательно, и к снижению его давления над раствором по сравнению с растворителем.
Давление насыщенного пара растворителя над раствором всегда меньше, чем над чистым растворителем.
Математически это выражается с помощью I закона Рауля.
I закон Рауля
– относительное понижение давления
насыщенного пара растворителя над
раствором в сравнении с его давлением
над растворителем, равно молярной доле
растворенного вещества (N):
закон Рауля
– относительное понижение давления
насыщенного пара растворителя над
раствором в сравнении с его давлением
над растворителем, равно молярной доле
растворенного вещества (N):
![]() ;
;
![]() ,
,
где Ро – давление насыщенного пара над растворителем;
Р – давление насыщенного пара над раствором;
n(X) и n(р-ля) – количество растворенного вещества и растворителя.
Для растворов электролитов в математическое выражение I закона Рауля вводится изотонический коэффициент:
![]()
Температуры кипения и кристаллизации растворов непосредственно связаны с давлением над ними насыщенного пара растворителя.
