
- •Предисловие
- •Модуль курса общей химии «Учение о растворах. Протолитические и гетерогенные равновесия»
- •Темы занятий модуля Для студентов лечебного и педиатрического факультетов
- •Для студентов стоматологического факультета
- •Для студентов медико-профилактического факультета
- •Для студентов фармацевтического факультета
- •Литература
- •Введение
- •Тема: Вода как универсальный биорастворитель. Коллигативные свойства растворов электролитов и неэлектролитов
- • Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Свойства и функции воды
- •1) Растворение веществ с ионным типом связи
- •Гидратация ионов
- •Коллигативные свойства растворов
- •К коллигативным свойствам относятся:
- •Диффузия;
- •Диффузия
- •Осмос. Осмотическое давление
- •Изотонический раствор
- •Гипертонический раствор
- •Гипотонический раствор
- •При снижении осмотического давления крови до 400-350 кПа н аступает гибель организма.
- •Давление насыщенного пара растворителя над раствором
- •Повышение температуры кипения и понижение температуры кристаллизации раствора по сравнению с растворителем
- •Для растворов электролитов в математическое выражение II закона Рауля вводится изотонический коэффициент I:
- •Типовые упражнения и задачи с решениями
- •Переход от массовой доли к молярной концентрации осуществляется по формуле:
- •Обучающие тесты
- •Задачи и упражнения для самостоятельного решения
- •Учебно-исследовательская лабораторная работа Тема: Осмос Опыт №1: Наблюдение явлений плазмолиза и гемолиза
- •Тема: Протолитические процессы и равновесия. Водородный показатель. Колориметрическое определение рН
- •Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Э лектролиты
- •Вывод закона разведения Оствальда:
- •Петер-Йозеф-Вильгельм Дебай (24.03.1884-2.11.1966).
- •Биологическая роль электролитов в организме
- •Средние ежедневные поступления и потери жидкости у взрослых
- •Причины нарушения водного обмена
- •Баланс электролитов в организме
- •Водно-электролитный баланс биологических жидкостей в организме человека
- •Ионное произведение воды. Водородный и гидроксильный показатели
- •Характеристика среды раствора
- •Диапазон изменения рН биологических жидкостей
- •Интервал рН перехода окраски индикаторов
- •Типовые упражнения и задачи с решениями
- •Ответ: степень ионизации гликолевой кислоты 5,44×10–2.
- •Ответ: общая кислотность уксусной кислоты 1,75×10–5 моль/л.
- •Обучающие тесты
- •У чебно-исследовательская лабораторная работа Тема: Определение рН растворов
- •Опыт № 1. Определение рН биологической жидкости с помощью универсального индикатора
- •Опыт № 2. Одноцветные и двуцветные индикаторы
- •Опыт № 3. Смещение равновесия диссоциации уксусной кислоты и гидроксида аммония
- •Тема: Протолитические процессы и равновесия. Теории кислот и оснований. Гидролиз
- • Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Типы протолитических реакций
- •Электронная теория Льюиса
- •Жесткие, мягкие кислоты и основания (жмко)
- •Типовые упражнения и задачи с решениями
- •Задачи и упражнения для самостоятельного решения
- •У чебно-исследовательская лабораторная работа Тема: Гидролиз солей
- •Тема: Протолитические процессы и равновесия. Буферные растворы
- •Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Типовые упражнения и задачи с решениями
- •Учебно-исследовательская лабораторная работа Тема: Буферные системы. Буферные системы организма
- •Опыт 2.1. Определение способности буферных растворов сохранять рН при добавлении щелочей
- •Опыт 2.2. Определение способности буферных растворов сохранять рН при добавлении кислот
- •Опыт 2.3. Определение способности буферных растворов сохранять рН при разбавлении
- •Тема: Протолитические процессы и равновесия. Буферные системы организма
- •Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Гидрокарбонатная буферная система
- •Гидрофосфатная буферная система
- •Белковая буферная система
- •Гемоглобиновая буферная система
- •Бикарбонатной буферных систем
- •Диапазон изменения значений рН при различных типах нарушения кислотно-основного баланса в организме
- •Причины и классификация ацидоза и алкалоза
- •Основные показатели крови при нарушении кислотно-основного баланса
- •Типовые упражнения и задачи с решениями
- •Обучающие тесты
- •Учебно-исследовательская лабораторная работа Тема: Определение буферной емкости сыворотки крови
- •Тема: Гетерогенные процессы и равновесия
- •Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Взаимосвязь Ks и растворимости s:
- •Конкурирующие гетерогенные процессы: конкуренция за катион или анион
- •Формирование костной ткани
- •Патологические гетерогенные процессы в организме
- •Т иповые упражнения и задачи с решениями
- •Обучающие тесты
- •Задачи и упражнения для самостоятельного решения
- •У чебно-исследовательская лабораторная работа Тема: Гетерогенные равновесия
- •Опыт № 1. Условия образования осадка
- •Опыт № 2. Влияние одноименного иона на образование осадка
- •Опыт № 3. Влияние константы растворимости электролитов на их способность к переосаждению
- •Опыт № 4. Условия растворения осадка
- •Теоретические вопросы к контрольной работе по модулю для студентов лечебного и педиатрического факультетов
- •Для студентов стоматологического и медико-профилактического факультетов
- •Экзаменационные теоретические вопросы для студентов лечебного и педиатрического факультетов
- •Для студентов стоматологического факультета
- •Для студентов медико-профилактического факультета
- •Приложение
- •1. Константы некоторых жидкостей, применяемых в качестве растворителей
- •2. Коэффициенты активности f ионов в водных растворах
- •3. Средние значения водородного показателя (рН) биологических жидкостей
- •4. Ионное произведение воды kw при различных температурах
- •5. Силовые показатели и константы ионизации кислот по реакции
- •6. Константы растворимости некоторых малорастворимых солей и гидроксидов (25оС)
- •7. Константы нестойкости комплексных ионов в водных растворах (25оС)
- •8. Измененения содержания воды в организме в зависимости от возраста
- •9. Распределение воды в организме в зависимости от пола
- •10. Основные элементы жидкостных компартментов организма
- •11. Вещества определяющие осмоляльность плазмы
- •12. Наиболее часто используемые кристаллоидные растворы
- •Оглавление
Переход от массовой доли к молярной концентрации осуществляется по формуле:
![]() ;
с(С6Н12О6)
=
;
с(С6Н12О6)
=
 = 1,2 моль/л.
= 1,2 моль/л.
Росм=1,2103 моль/м3 × 8,31 Дж/моль×310 К = 3 091 320 Па = 3091,3 кПа.
Ответ: так как 3091,3 кПа > Росм крови, то 20%-ный раствор глюкозы является гипертоническим.
Задача № 14
Что произойдет с эритроцитами при 310 К в 2%-ном растворе глюкозы (r = 1,006 г/мл)?
Решение:
Эритроциты в гипотонических растворах за счет эндоосмоса лопаются, происходит гемолиз, а в гипертонических растворах – сморщиваются (плазмолиз).
Осмотическое давление 2%-ного раствора глюкозы определяется по закону Вант-Гоффа:
Росм.
= с(Х)RT,
где
![]() ;
;
 ×R×Т
×R×Т
Росм.
=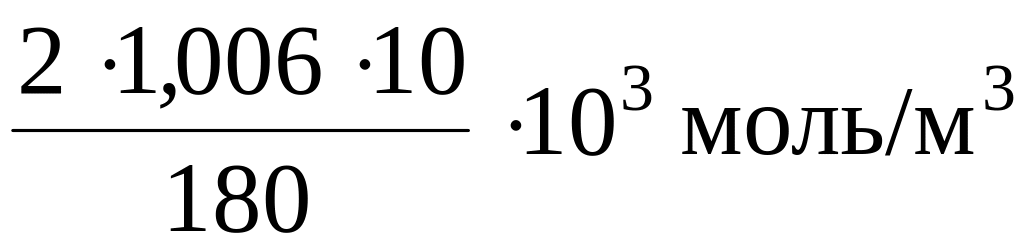 ×8,31
Дж/(моль×К)
×
310 К = 287951 Па = 287,951 кПа
×8,31
Дж/(моль×К)
×
310 К = 287951 Па = 287,951 кПа
Ответ: Росм 2%-ного раствора глюкозы меньше осмотического давления крови, поэтому с эритроцитами в таком растворе произойдет гемолиз.
Задача № 15
Осмотическое давление крови равно в норме 740-780 кПа. Вычислите осмолярность крови при 310 К.
Решение:
По уравнению Вант-Гоффа: Росм = с(Х)×R×T.
сосм(Х)
=
![]() ,
,
где сосм – осмолярная концентрация – это суммарное молярное количество всех кинетически активных, т.е. способных к самостоятельному движению, частиц, содержащихся в 1 литре раствора, независимо от их формы, размера и природы.
сосм1
=
![]() = 287,3 моль/м3
= 0,287 осмоль/л;
= 287,3 моль/м3
= 0,287 осмоль/л;
сосм2
=
![]() = 302,8 моль/м3
»
0,303 осмоль/л.
= 302,8 моль/м3
»
0,303 осмоль/л.
Ответ: осмолярность крови составляет 0,287–0,303 осмоль/л.
Задача № 16
При несахарном диабете выделяются большие объемы разбавленной мочи, осмолярность которой снижается до 0,06 осмоль/л. Вычислите осмотическое давление такой мочи при 310 К.
Решение:
Росм = с(Х)×R×T = 0,06×103 осмоль/м3 × 8,31 Дж/моль×К × 310 К=154566 Па = = 154,6 кПа.
Ответ: осмотическое давление разбавленной мочи значительно ниже осмотического давления плазмы крови.
Задача № 17
Рассчитайте осмотическое давление 0,01 М раствора KCl, при Т = 310 К, если изотонический коэффициент (i) равен 1,96. Каким будет этот раствор по отношению к плазме крови?
Решение:
Для растворов электролитов в уравнение Вант-Гоффа вводится изотонический коэффициент (i) для учета электролитической диссоциации:
Росм = i×с(Х)×R×T
Росм = 1,96×с(KCl)×R×T = 1,96×0,01×103 моль/м3×8,31 Дж/моль×К×310 К = 50491,56 Па = 50,5 кПа.
Ответ: 0,01 М раствор гипотоничен плазме крови.
Задача № 18
В качестве слабительного средства взрослым назначают принимать натощак 0,5 стакана(100 мл) раствора глауберовой соли, содержащего 20 г Na2SO410H2O. Рассчитайте осмотическое давление этого раствора при 25С и поясните механизм его действия (i = 2,75).
Решение:
По закону Вант – Гоффа для растворов электролитов
Росм(Х)
= iс(Х)RT= ;
;
Росм=![]() =4231,88
кПа.
=4231,88
кПа.
Ответ: раствор гипертоничен, т.к. его Росм больше 760 кПа, поэтому осмотическое давление в просвете кишечника повышается, вызывая тем самым поступление большого количества воды и послабляющее действие.
Задача № 19
При внутренних кровоизлияниях (легочных, желудочно-кишечных), а также для усиления диуреза внутривенно вводят от 5 до 20 мл 10%-ного раствора NaCl ( = 1,071 г/мл, i = 1,87). Рассчитайте осмотическое давление этого раствора и определите, каким он будет по отношению к плазме крови. (t = 37С).
Решение:
![]() =
1,83 моль/л
=
1,83 моль/л
Росм = iсRT = 1,871,838,314310 = 8819,92 кПа
Ответ: раствор будет гипертоничен по отношению к плазме крови.
Задача № 20
Какова степень электролитической диссоциации (a) дихлоруксусной кислоты в ее 0,01 М растворе, если при 300 К этот раствор создает осмотическое давление в 43596,4 Па?
Решение:
Так как СНСl2СООН – электролит, используется уравнение Вант-Гоффа в виде: Росм = i×с(Х)×R×T.
Из
этого уравнения
![]() ;
;
![]() =
1,75.
=
1,75.
Степень
диссоциации электролита определяется
по формуле:
![]() ,
,
где i – изотонический коэффициент;
n – число ионов, на которое распадается данный электролит;
![]() =
0,75.
=
0,75.
Ответ: степень диссоциации дихлоруксусной кислоты равна 0,75.

