
- •Предисловие
- •Модуль курса общей химии «Учение о растворах. Протолитические и гетерогенные равновесия»
- •Темы занятий модуля Для студентов лечебного и педиатрического факультетов
- •Для студентов стоматологического факультета
- •Для студентов медико-профилактического факультета
- •Для студентов фармацевтического факультета
- •Литература
- •Введение
- •Тема: Вода как универсальный биорастворитель. Коллигативные свойства растворов электролитов и неэлектролитов
- • Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Свойства и функции воды
- •1) Растворение веществ с ионным типом связи
- •Гидратация ионов
- •Коллигативные свойства растворов
- •К коллигативным свойствам относятся:
- •Диффузия;
- •Диффузия
- •Осмос. Осмотическое давление
- •Изотонический раствор
- •Гипертонический раствор
- •Гипотонический раствор
- •При снижении осмотического давления крови до 400-350 кПа н аступает гибель организма.
- •Давление насыщенного пара растворителя над раствором
- •Повышение температуры кипения и понижение температуры кристаллизации раствора по сравнению с растворителем
- •Для растворов электролитов в математическое выражение II закона Рауля вводится изотонический коэффициент I:
- •Типовые упражнения и задачи с решениями
- •Переход от массовой доли к молярной концентрации осуществляется по формуле:
- •Обучающие тесты
- •Задачи и упражнения для самостоятельного решения
- •Учебно-исследовательская лабораторная работа Тема: Осмос Опыт №1: Наблюдение явлений плазмолиза и гемолиза
- •Тема: Протолитические процессы и равновесия. Водородный показатель. Колориметрическое определение рН
- •Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Э лектролиты
- •Вывод закона разведения Оствальда:
- •Петер-Йозеф-Вильгельм Дебай (24.03.1884-2.11.1966).
- •Биологическая роль электролитов в организме
- •Средние ежедневные поступления и потери жидкости у взрослых
- •Причины нарушения водного обмена
- •Баланс электролитов в организме
- •Водно-электролитный баланс биологических жидкостей в организме человека
- •Ионное произведение воды. Водородный и гидроксильный показатели
- •Характеристика среды раствора
- •Диапазон изменения рН биологических жидкостей
- •Интервал рН перехода окраски индикаторов
- •Типовые упражнения и задачи с решениями
- •Ответ: степень ионизации гликолевой кислоты 5,44×10–2.
- •Ответ: общая кислотность уксусной кислоты 1,75×10–5 моль/л.
- •Обучающие тесты
- •У чебно-исследовательская лабораторная работа Тема: Определение рН растворов
- •Опыт № 1. Определение рН биологической жидкости с помощью универсального индикатора
- •Опыт № 2. Одноцветные и двуцветные индикаторы
- •Опыт № 3. Смещение равновесия диссоциации уксусной кислоты и гидроксида аммония
- •Тема: Протолитические процессы и равновесия. Теории кислот и оснований. Гидролиз
- • Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Типы протолитических реакций
- •Электронная теория Льюиса
- •Жесткие, мягкие кислоты и основания (жмко)
- •Типовые упражнения и задачи с решениями
- •Задачи и упражнения для самостоятельного решения
- •У чебно-исследовательская лабораторная работа Тема: Гидролиз солей
- •Тема: Протолитические процессы и равновесия. Буферные растворы
- •Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Типовые упражнения и задачи с решениями
- •Учебно-исследовательская лабораторная работа Тема: Буферные системы. Буферные системы организма
- •Опыт 2.1. Определение способности буферных растворов сохранять рН при добавлении щелочей
- •Опыт 2.2. Определение способности буферных растворов сохранять рН при добавлении кислот
- •Опыт 2.3. Определение способности буферных растворов сохранять рН при разбавлении
- •Тема: Протолитические процессы и равновесия. Буферные системы организма
- •Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Гидрокарбонатная буферная система
- •Гидрофосфатная буферная система
- •Белковая буферная система
- •Гемоглобиновая буферная система
- •Бикарбонатной буферных систем
- •Диапазон изменения значений рН при различных типах нарушения кислотно-основного баланса в организме
- •Причины и классификация ацидоза и алкалоза
- •Основные показатели крови при нарушении кислотно-основного баланса
- •Типовые упражнения и задачи с решениями
- •Обучающие тесты
- •Учебно-исследовательская лабораторная работа Тема: Определение буферной емкости сыворотки крови
- •Тема: Гетерогенные процессы и равновесия
- •Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Взаимосвязь Ks и растворимости s:
- •Конкурирующие гетерогенные процессы: конкуренция за катион или анион
- •Формирование костной ткани
- •Патологические гетерогенные процессы в организме
- •Т иповые упражнения и задачи с решениями
- •Обучающие тесты
- •Задачи и упражнения для самостоятельного решения
- •У чебно-исследовательская лабораторная работа Тема: Гетерогенные равновесия
- •Опыт № 1. Условия образования осадка
- •Опыт № 2. Влияние одноименного иона на образование осадка
- •Опыт № 3. Влияние константы растворимости электролитов на их способность к переосаждению
- •Опыт № 4. Условия растворения осадка
- •Теоретические вопросы к контрольной работе по модулю для студентов лечебного и педиатрического факультетов
- •Для студентов стоматологического и медико-профилактического факультетов
- •Экзаменационные теоретические вопросы для студентов лечебного и педиатрического факультетов
- •Для студентов стоматологического факультета
- •Для студентов медико-профилактического факультета
- •Приложение
- •1. Константы некоторых жидкостей, применяемых в качестве растворителей
- •2. Коэффициенты активности f ионов в водных растворах
- •3. Средние значения водородного показателя (рН) биологических жидкостей
- •4. Ионное произведение воды kw при различных температурах
- •5. Силовые показатели и константы ионизации кислот по реакции
- •6. Константы растворимости некоторых малорастворимых солей и гидроксидов (25оС)
- •7. Константы нестойкости комплексных ионов в водных растворах (25оС)
- •8. Измененения содержания воды в организме в зависимости от возраста
- •9. Распределение воды в организме в зависимости от пола
- •10. Основные элементы жидкостных компартментов организма
- •11. Вещества определяющие осмоляльность плазмы
- •12. Наиболее часто используемые кристаллоидные растворы
- •Оглавление
Тема: Вода как универсальный биорастворитель. Коллигативные свойства растворов электролитов и неэлектролитов
Цели изучения: сформировать знания о свойствах воды как универсального растворителя, коллигативных свойствах растворов, а также ценностное отношение к ним, как профессионально значимым; научиться выполнять расчеты осмотического давления для растворов электролитов и неэлектролитов, а также расчеты с использованием законов Рауля; наблюдать в эксперименте явления осмоса.

Повторить: строение молекулы воды, ее физико-химические свойства, биологическую роль, теорию электролитической диссоциации Аррениуса (ТЭД).
Учебно-целевые вопросы
Вода как универсальный биологический растворитель.
Коллигативные свойства растворов (определение, примеры).
Понижение давления насыщенного пара над раствором в сравнении с растворителем (I закон Рауля).
Повышение температуры кипения и понижение температуры кристаллизации растворов по сравнению с растворителем (II закон Рауля). Физический смысл криоскопической и эбулиоскопической констант. Применение криоскопии и эбулиоскопии в медико-биологических исследованиях.
Диффузия и осмос. Понятие о полупроницаемых мембранах. Эндо- и экзоосмос.
Осмотическое давление, закон Вант-Гоффа, его математическое выражение. Биологическая роль осмоса. Осмотическое давление крови. Осмолярность и осмоляльность крови. Осмотический «шок» и осмотический «конфликт».
Особенности коллигативных свойств растворов электролитов. Изотонический коэффициент.
Изотонические, гипертонические, гипотонические растворы, применение этих растворов в медицине.
Краткая теоретическая часть
Среди биологических систем и лекарственных препаратов наиболее распространены водные растворы, поэтому для изучения их свойств и получения таких растворов необходимо знать свойства воды как универсального биологического растворителя.
Вода – вещество без вкуса, цвета и запаха. При атмосферном давлении 101,3 кПа температура кипения её равна 373,15 К, а температура замерзания – 273,15 К.

За счет двух неподеленных электронных пар на атоме кислорода и двух атомов водорода молекула воды может образовывать водородные связи с четырьмя окружающими её молекулами воды (рис. 1).
Рис. 1. Схема объединения молекул воды
Такую «воздушную» структуру имеет лед, поэтому при равных массах он занимает больший объем, чем вода, и имеет меньшую плотность ( = 0,92 г/см3). При плавлении льда водородные связи частично рвутся, но и за счет оставшихся связей вода имеет более высокую температуру кипения и более низкую температуру замерзания (сравните, если вода не была бы ассоциирована, то имела бы tплавл. = –100оС и tкип. = –80оС).
Максимальную плотность вода имеет при t = +4oC. Аномалия плотности воды имеет огромное значение для жизни живых существ, населяющих замерзающие водоемы. Поверхностные слои воды при температурах ниже +4оС не опускаются на дно, т.к. при охлаждении они становятся более легкими, поэтому верхние слои воды могут затвер
девать, в то время как в глубинах водоемов сохраняется температура +4оС. В этих условиях жизнь продолжается. Если бы плотность льда была больше плотности жидкой воды, то водоемы промерзли бы до дна и живые организмы в них погибли.
Т ип
гибридизации атомных орбиталей кислорода
в молекуле Н2О
– sp3,
причем две орбитали заняты неподеленными
электронными парами.
ип
гибридизации атомных орбиталей кислорода
в молекуле Н2О
– sp3,
причем две орбитали заняты неподеленными
электронными парами.
С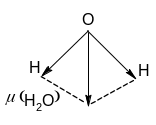 троение
молекулы воды уголковое, она представляет
собой диполь с валентным углом 104,3о
(рис. 2).
троение
молекулы воды уголковое, она представляет
собой диполь с валентным углом 104,3о
(рис. 2).
Рис. 2. Схема строения молекулы воды
Организм человека на 60% состоит из воды, из них 42% приходится на внутриклеточную, а остальная часть на внеклеточную (межклеточную) жидкость, которую подразделяют на внутрисосудистую и интерстициальную (межтканевую) жидкость.
Потребность в воде взрослого человека составляет 35 г в день на 1 кг массы тела, а грудного ребенка – в 3-4 раза больше. Гибель организма наступает при потере 20% воды.
Благодаря своим уникальным свойствам вода является средой, растворителем и метаболитом (табл. 1).
Таблица 1
