
- •Предисловие
- •Модуль курса общей химии «Учение о растворах. Протолитические и гетерогенные равновесия»
- •Темы занятий модуля Для студентов лечебного и педиатрического факультетов
- •Для студентов стоматологического факультета
- •Для студентов медико-профилактического факультета
- •Для студентов фармацевтического факультета
- •Литература
- •Введение
- •Тема: Вода как универсальный биорастворитель. Коллигативные свойства растворов электролитов и неэлектролитов
- • Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Свойства и функции воды
- •1) Растворение веществ с ионным типом связи
- •Гидратация ионов
- •Коллигативные свойства растворов
- •К коллигативным свойствам относятся:
- •Диффузия;
- •Диффузия
- •Осмос. Осмотическое давление
- •Изотонический раствор
- •Гипертонический раствор
- •Гипотонический раствор
- •При снижении осмотического давления крови до 400-350 кПа н аступает гибель организма.
- •Давление насыщенного пара растворителя над раствором
- •Повышение температуры кипения и понижение температуры кристаллизации раствора по сравнению с растворителем
- •Для растворов электролитов в математическое выражение II закона Рауля вводится изотонический коэффициент I:
- •Типовые упражнения и задачи с решениями
- •Переход от массовой доли к молярной концентрации осуществляется по формуле:
- •Обучающие тесты
- •Задачи и упражнения для самостоятельного решения
- •Учебно-исследовательская лабораторная работа Тема: Осмос Опыт №1: Наблюдение явлений плазмолиза и гемолиза
- •Тема: Протолитические процессы и равновесия. Водородный показатель. Колориметрическое определение рН
- •Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Э лектролиты
- •Вывод закона разведения Оствальда:
- •Петер-Йозеф-Вильгельм Дебай (24.03.1884-2.11.1966).
- •Биологическая роль электролитов в организме
- •Средние ежедневные поступления и потери жидкости у взрослых
- •Причины нарушения водного обмена
- •Баланс электролитов в организме
- •Водно-электролитный баланс биологических жидкостей в организме человека
- •Ионное произведение воды. Водородный и гидроксильный показатели
- •Характеристика среды раствора
- •Диапазон изменения рН биологических жидкостей
- •Интервал рН перехода окраски индикаторов
- •Типовые упражнения и задачи с решениями
- •Ответ: степень ионизации гликолевой кислоты 5,44×10–2.
- •Ответ: общая кислотность уксусной кислоты 1,75×10–5 моль/л.
- •Обучающие тесты
- •У чебно-исследовательская лабораторная работа Тема: Определение рН растворов
- •Опыт № 1. Определение рН биологической жидкости с помощью универсального индикатора
- •Опыт № 2. Одноцветные и двуцветные индикаторы
- •Опыт № 3. Смещение равновесия диссоциации уксусной кислоты и гидроксида аммония
- •Тема: Протолитические процессы и равновесия. Теории кислот и оснований. Гидролиз
- • Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Типы протолитических реакций
- •Электронная теория Льюиса
- •Жесткие, мягкие кислоты и основания (жмко)
- •Типовые упражнения и задачи с решениями
- •Задачи и упражнения для самостоятельного решения
- •У чебно-исследовательская лабораторная работа Тема: Гидролиз солей
- •Тема: Протолитические процессы и равновесия. Буферные растворы
- •Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Типовые упражнения и задачи с решениями
- •Учебно-исследовательская лабораторная работа Тема: Буферные системы. Буферные системы организма
- •Опыт 2.1. Определение способности буферных растворов сохранять рН при добавлении щелочей
- •Опыт 2.2. Определение способности буферных растворов сохранять рН при добавлении кислот
- •Опыт 2.3. Определение способности буферных растворов сохранять рН при разбавлении
- •Тема: Протолитические процессы и равновесия. Буферные системы организма
- •Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Гидрокарбонатная буферная система
- •Гидрофосфатная буферная система
- •Белковая буферная система
- •Гемоглобиновая буферная система
- •Бикарбонатной буферных систем
- •Диапазон изменения значений рН при различных типах нарушения кислотно-основного баланса в организме
- •Причины и классификация ацидоза и алкалоза
- •Основные показатели крови при нарушении кислотно-основного баланса
- •Типовые упражнения и задачи с решениями
- •Обучающие тесты
- •Учебно-исследовательская лабораторная работа Тема: Определение буферной емкости сыворотки крови
- •Тема: Гетерогенные процессы и равновесия
- •Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Взаимосвязь Ks и растворимости s:
- •Конкурирующие гетерогенные процессы: конкуренция за катион или анион
- •Формирование костной ткани
- •Патологические гетерогенные процессы в организме
- •Т иповые упражнения и задачи с решениями
- •Обучающие тесты
- •Задачи и упражнения для самостоятельного решения
- •У чебно-исследовательская лабораторная работа Тема: Гетерогенные равновесия
- •Опыт № 1. Условия образования осадка
- •Опыт № 2. Влияние одноименного иона на образование осадка
- •Опыт № 3. Влияние константы растворимости электролитов на их способность к переосаждению
- •Опыт № 4. Условия растворения осадка
- •Теоретические вопросы к контрольной работе по модулю для студентов лечебного и педиатрического факультетов
- •Для студентов стоматологического и медико-профилактического факультетов
- •Экзаменационные теоретические вопросы для студентов лечебного и педиатрического факультетов
- •Для студентов стоматологического факультета
- •Для студентов медико-профилактического факультета
- •Приложение
- •1. Константы некоторых жидкостей, применяемых в качестве растворителей
- •2. Коэффициенты активности f ионов в водных растворах
- •3. Средние значения водородного показателя (рН) биологических жидкостей
- •4. Ионное произведение воды kw при различных температурах
- •5. Силовые показатели и константы ионизации кислот по реакции
- •6. Константы растворимости некоторых малорастворимых солей и гидроксидов (25оС)
- •7. Константы нестойкости комплексных ионов в водных растворах (25оС)
- •8. Измененения содержания воды в организме в зависимости от возраста
- •9. Распределение воды в организме в зависимости от пола
- •10. Основные элементы жидкостных компартментов организма
- •11. Вещества определяющие осмоляльность плазмы
- •12. Наиболее часто используемые кристаллоидные растворы
- •Оглавление
Учебно-исследовательская лабораторная работа Тема: Определение буферной емкости сыворотки крови
Цель работы: На основании полученных экспериментальных данных сопоставить буферную емкость сыворотки крови по кислоте и основанию.
Оборудование и реактивы: 2 колбы, пипетки Мора на 10 мл, сыворотка крови, фенолфталеин, бромкрезоловый пурпурный, 0,1 н. раствор NaOH, 0,1 н. раствор HCl.
Порядок выполнения
Отмерьте в 2 колбы по 10 мл сыворотки крови (рН = 7,4). В одну из них добавьте 2 капли фенолфталеина и оттитруйте 0,1 н. раствором щелочи до появления розового окрашивания (рН = 8,4). В другую добавьте 2 капли бромкрезолового пурпурного и оттитруйте 0,1 н. раствором кислоты до появления зеленоватого окрашивания (рН = 6,4).
Результаты занесите в таблицу.
Рассчитайте буферную емкость крови.
Таблица
Титрант |
Vср, мл |
рН |
|
Кислота |
|
|
|
Щелочь |
|
|
|
План оформления отчета
Дата и название работы.
Цель работы.
Краткое описание проведения опыта. Расчет буферной емкости сыворотки крови по кислоте и основанию.
Выводы: используя соотношение концентраций компонентов, находящихся в сыворотке крови буферных систем,
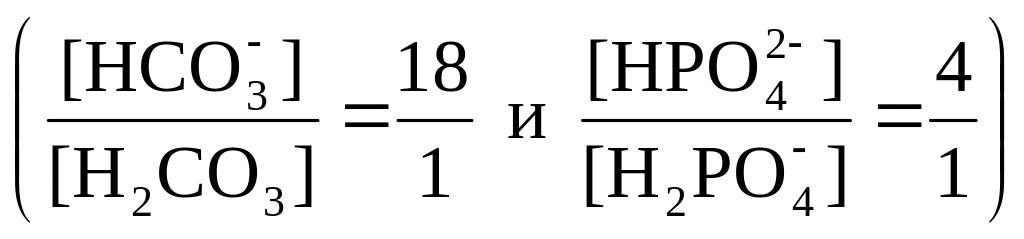 объясните, почему ее буферная емкость
по кислоте больше, чем по основанию.
Покажите механизм действия буферных
систем.
объясните, почему ее буферная емкость
по кислоте больше, чем по основанию.
Покажите механизм действия буферных
систем.
Тема: Гетерогенные процессы и равновесия
Цели изучения: сформировать знания о сущности гетерогенных процессов и установления гетерогенного равновесия, условиях его смещения, Ks, научиться рассчитывать Ks, растворимость малорастворимых веществ, прогнозировать возможность образования и растворения осадков; выработать ценностное отношение к полученным знаниям и умениям, необходимых для дальнейшего медицинского образования.
П овторить: растворимость веществ в воде, основные типы равновесий в растворах, константу равновесия, принцип Ле Шателье.
Учебно-целевые вопросы
Растворимость веществ, единицы количественного выражения растворимости.
Растворы насыщенные, ненасыщенные, пересыщенные. Суть гетерогенного равновесия, основное условие его существования. Константа гетерогенного равновесия (Ks), ее значение.
Изолированные и совмещенные гетерогенные равновесия. Условия смещения гетерогенного равновесия.
Гетерогенные равновесия в живом организме, химизм образования костной, зубной ткани. Изоморфизм.
Понятие о химизме патологических гетерогенных процессов, их возможной коррекции.
Краткая теоретическая часть
Вещество + растворитель ((;(( раствор
Насыщенный раствор |
Ненасыщенный раствор |
Пересыщенный раствор |
|
|
|
Растворимость |
S = с(Х) насыщенный раствор |
г/100 г растворителя |
хорошо |
1 моль/л и больше |
10г/100 и больше |
мало |
0,1 моль/л и меньше |
1г/100 и меньше |
К онстанта
растворимости, KS
(ПР)
– стехиометрическое произведение
равновесных концентраций ионов
малорастворимого электролита в его
насыщенном растворе при данных условиях.
онстанта
растворимости, KS
(ПР)
– стехиометрическое произведение
равновесных концентраций ионов
малорастворимого электролита в его
насыщенном растворе при данных условиях.
Са3(РО4)2
((;((
3Са2+(р-р)
+ 2РО![]() (р-р)
(р-р)
KS = [Са2+]3[РО ]2
Насыщенный
раствор
– термодинамически устойчивая равновесная
система, характеризующаяся равенством
скоростей растворения и кристаллизации
![]() .
.
KtnAnm(тв) ((((((;кристаллизация; ((((((;растворение nKtm+(р-р) + mAnn–(р-р)
![]()
т.к. [KtmAnm] = const, то Kравн[KtmAnm] = const = Ks,
где Ks – константа растворимости, зависящая от природы малорастворимого электролита, растворителя и температуры.
Ks = [Ktm+ ]n [Ann–]m
