
- •Предисловие
- •Программа курса «Молекулярная физика. Термодинамика.»
- •2. Учебно-тематический план
- •3. Содержание курса
- •4. Примерная тематика семинарских занятий
- •5. Средства обеспечения дисциплины
- •Введение
- •Все вещества состоят из атомов или молекул
- •Атомы и молекулы веществ находятся в состоянии беспорядочного движения
- •Между атомами и молекулами вещества действуют как силы притяжения, так и силы отталкивания.
- •Глава 1 Термодинамика
- •§1. Температура и термодинамическое равновесие
- •Давление
- •§2. Уравнение состояния идеального газа
- •§3. Законы идеальных газов
- •Изотермический процесс
- •Изобарический процесс
- •Закон Авогадро
- •Закон Дальтона
- •§4. Первое начало термодинамики
- •§5. Макроскопическая работа
- •I начало термодинамики для системы в адиабатической оболочке
- •§6. Внутренняя энергия
- •§7. Количество теплоты. Математическая формулировка первого начала термодинамики
- •§8. Различные приложения I начала термодинамики. Теплоёмкость
- •§9. Внутренняя энергия идеального газа. Закон Джоуля
- •Уравнение Роберта Майера
- •§10. Адиабатический процесс. Уравнение Пуассона
- •Работа при адиабатическом изменении объёма газа
- •§11. Политропический процесс
- •Вопросы и задания для самостоятельной работы студентов Основы термодинамики. I начало термодинамики
- •§12. II начало термодинамики
- •Различные формулировки основного постулата, выражающего II начало термодинамики
- •§13. Равновесные состояния
- •§14. Обратимые и необратимые процессы
- •Необратимость и вероятность
- •§15. Цикл Карно
- •Коэффициент полезного действия в цикле Карно
- •§16. Холодильная машина
- •§17. Свободная энергия
- •§18. Энтропия
- •§19. Некоторые термодинамические соотношения
- •§20. Закон возрастания энтропии. Второе начало термодинамики
- •Увеличение энтропии при теплопередаче
- •§21. Энтропия и вероятность
- •§22. Энтропия и беспорядок
- •§23. Третье начало термодинамики
- •Вопросы для контроля самостоятельной работы студентов
- •II начало термодинамики. Энтропия.
- •Глава 2. Неравновесная термодинамика §1. Основные принципы линейной термодинамики
- •§2. Нелинейная термодинамика
- •§3. Принцип синергетики
- •Свойства и примеры самоорганизации диссипативных структур
- •Глава 3. Статистическая физика и её применение к идеальному газу
- •§1. Давление газа с точки зрения молекулярно – кинетической теории
- •§2. Температура как мера средней энергии хаотичного движения молекул
- •Скорость газовых молекул
- •§3. Броуновское движение
- •§4. Кинетическая теория теплоты Внутренняя энергия идеального газа
- •§5. Классическая теория теплоёмкости и её недостатки
- •§6. Барометрическая формула
- •Закон Больцмана
- •§7. Распределение молекул по скоростям
- •§8. Функция распределения
- •§9. Формула Максвелла
- •§10. Средняя арифметическая, средняя квадратичная и наивероятнейшая скорости молекул
- •§11. Среднее число молекул, сталкивающихся со стенкой сосуда
- •Вопросы для контроля знаний студентов Молекулярно-кинетическая теория
- •Глава 4. Явления переноса §1. Столкновение молекул и явления переноса
- •§2. Среднее число столкновений в единицу времени и средняя длина свободного пробега молекул
- •§3. Рассеяние молекулярного пучка в газе
- •§4. Явление переноса в газах. Уравнение переноса
- •§5. Диффузия
- •§6. Нестационарная диффузия
- •§7. Теплопроводность газов
- •§8. Вязкость газов (внутреннее трение)
- •§9. Соотношения между коэффициентами переноса
- •§10. Физические явления в разреженных газах
- •Вопросы для самостоятельного контроля знаний студентов Явления переноса
- •Глава 5 §1. Неидеальные газы. Уравнение Ван-дер-Ваальса. Отклонение свойств газов от идеальности
- •Уравнение Ван-Дер-Ваальса
- •§2. Учет сил отталкивания между молекулами
- •§3. Учет сил притяжения между молекулами
- •§4. Изотермы Ван-дер-Ваальса
- •§5. Критическая температура и критическое состояние
- •§6. Недостатки уравнения Ван-дер-Ваальса
- •§7. Внутренняя энергия газа Ван-дер-Ваальса
- •§8. Приведенное уравнение Ван-дер-Ваальса. Закон соответственных состояний
- •§9. Сжижение газов
- •Эффект Джоуля-Томсона
- •Вопросы для самоконтроля изученного материала Реальные газы
- •Глава 6. Жидкое состояние §1.Строение жидкостей
- •§2. Поверхностное натяжение
- •§3. Условия равновесия на границе двух сред. Краевой угол
- •§4. Граница жидкости и твердого тела
- •§5. Силы, возникающие на кривой поверхности жидкости
- •§6. Капиллярные явления
- •§7. Упругость насыщенного пара над кривой поверхностью жидкости
- •Вопросы для самоконтроля знаний студентов
- •Глава 7. Жидкие растворы §1. Свойства растворов
- •§2. Упругость насыщенного пара над идеальным раствором
- •§3. Закон Генри
- •§4. Осмотическое давление
- •Глава 8. Кристаллическое состояние §1. Отличительные черты кристаллического состояния
- •§2. Классификация кристаллов
- •§3. Физические типы кристаллических решеток
- •§4. Тепловое движение в кристаллах
- •Глава 9. Фазовые переходы §1. Фаза и фазовые равновесия
- •§2. Условия равновесия фаз химически однородного вещества
- •§3. Уравнение Клапейрона
- •Вопросы для самоконтроля знаний студентов
- •Содержание
§5. Силы, возникающие на кривой поверхности жидкости
Кривизна поверхности жидкости приводит к появлению сил, действующих на жидкость под этой поверхностью.
Р ассмотрим
сферическую каплю радиусом
ассмотрим
сферическую каплю радиусом
![]() (рис.7).
(рис.7).
При увеличении
радиуса сферы растет площадь его
поверхности, а вместе с ней и поверхностная
энергия. А
это может происходить только за счет
совершения работы внешними силами.
Наоборот, при уменьшении радиуса капли
поверхностная энергия уменьшается. Это
значит, что работа производится силами,
действующими в самой капле. Если
на каплю не действуют внешние силы, то
они стремятся занять наименьший объем,
т.е. объем жидкости под сферической
поверхностью всегда несколько сжат.
Это приводит к тому, что жидкость в капле
испытывает дополнительное давление,
направленное радиально перпендикулярно
к ее поверхности. Пусть под действием
этого давления жидкий шар уменьшит
объем на
![]() .
При этом производится работа сжатия
жидкости за счет уменьшения поверхностной
энергии капли. Работа сжатия
.
При этом производится работа сжатия
жидкости за счет уменьшения поверхностной
энергии капли. Работа сжатия
![]() равна:
равна:
![]() ,
(6.7)
,
(6.7)
а уменьшение
поверхностной энергии
![]() равна:
равна:
, (6.8)
где
- уменьшение
поверхности шара, связанное с уменьшением
радиуса капли на
![]() .
Для шара
.
Для шара
![]() и
и
![]() .
Отсюда следует:
.
Отсюда следует:
![]() .
.
Подставляя эти
значения для
и
в (6.7) и (6.8) и
принимая во внимание, что
![]() ,
получаем:
,
получаем:
![]() ,
,
откуда имеем для давления, оказываемого на жидкость ее кривой поверхностью следующее выражение:
![]() .
(6.9)
.
(6.9)
Если поверхность жидкости цилиндрическая, то
![]() ,
,
где - длина цилиндра. Соответственно
![]() .
.
Подставляя эти значения и в формулы (6.7) и (6.8) аналогично получим:
![]() .
(6.10)
.
(6.10)
В общем случае поверхности любой формы давление, обусловленное кривизной поверхности, выражаются уравнением, известным под названием уравнения Лапласа:
![]() ,
(6.11)
,
(6.11)
где
![]() и
и
![]() - главные
радиусы кривизны для данного элемента
поверхности.
- главные
радиусы кривизны для данного элемента
поверхности.
В случае сферы = и формула (6.11) переходит в (6.9). В случае цилиндра один из главных радиусов равняется , а другой совпадает с радиусом цилиндра. Соответственно, формула (6.11) переходит в (6.10). Дополнительное давление, определяемое формулой (6.11) направлено к центру кривизны поверхности.
§6. Капиллярные явления
В случае, когда жидкость находится в узком сосуде, влияние стенок простирается на всю поверхность жидкости, и она оказывается искривленной на всем своем протяжении.
Если размеры сосуда, в котором находится жидкость, сравнимы с радиусом кривизны поверхности жидкости, то такие сосуды называются капиллярными. Явления, происходящие в таких сосудах, называются капиллярными явлениями.
Рассмотрим некоторые явления, связанные с капиллярностью.
П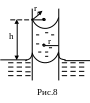 оскольку
в капиллярных сосудах жидкость имеет
кривую поверхность, здесь появляется
дополнительное давление, вызванное
кривизной поверхности. Следствием этого
является капиллярный подъем. На рис.8
изображена узкая труба, опущенная в
широкий сосуд с жидкостью. Пусть стенки
сосуда смачиваются жидкостью. Тогда
жидкость, протекающая в трубку, образует
вогнутый мениск. Пусть трубка настолько
узка, что ее радиус сравним с радиусом
оскольку
в капиллярных сосудах жидкость имеет
кривую поверхность, здесь появляется
дополнительное давление, вызванное
кривизной поверхности. Следствием этого
является капиллярный подъем. На рис.8
изображена узкая труба, опущенная в
широкий сосуд с жидкостью. Пусть стенки
сосуда смачиваются жидкостью. Тогда
жидкость, протекающая в трубку, образует
вогнутый мениск. Пусть трубка настолько
узка, что ее радиус сравним с радиусом
![]() мениска.
Вследствие кривизны мениска
появляется дополнительное давление,
направленное к центру кривизны мениска,
т.е. вверх, равное
мениска.
Вследствие кривизны мениска
появляется дополнительное давление,
направленное к центру кривизны мениска,
т.е. вверх, равное
![]() .
Под действием этого давления жидкость
поднимается по трубке до уровня
.
Под действием этого давления жидкость
поднимается по трубке до уровня
![]() ,
при котором гидростатическое давление
,
при котором гидростатическое давление
![]() столба
жидкости высотой
,
уравновешивают избыточное давление,
т.е.
столба
жидкости высотой
,
уравновешивают избыточное давление,
т.е.
![]() ,
(6.12)
,
(6.12)
где
- плотность
жидкости,
![]() - ускорение
свободного падения. Из (4.12) следует, что
высота подъема жидкости
будет равна
- ускорение
свободного падения. Из (4.12) следует, что
высота подъема жидкости
будет равна
![]() .
(6.13)
.
(6.13)
Поскольку радиус
кривизны
![]() трудно
определить экспериментально, появляется
необходимость выражения
через радиус
трубки
.
Для этого воспользуемся рисунком 9.
трудно
определить экспериментально, появляется
необходимость выражения
через радиус
трубки
.
Для этого воспользуемся рисунком 9.
Ц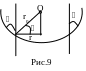 ентр
сферы, частью которой является мениск,
находится в точке О.
Краевой угол жидкости, соприкасающийся
со стенками капилляра, равен
ентр
сферы, частью которой является мениск,
находится в точке О.
Краевой угол жидкости, соприкасающийся
со стенками капилляра, равен
![]() .
Из чертежа видно, что
.
Из чертежа видно, что
![]() .
Поэтому формулу (6.13) можно переписать
в виде:
.
Поэтому формулу (6.13) можно переписать
в виде:
![]() .
(6.14)
.
(6.14)
Для жидкости,
полностью смачивающей стенки капилляра
=0,
![]() и
и
![]() .
(6.15)
.
(6.15)
Как следует из (6.15), высота подъема жидкости будет тем больше, чем меньше радиус капилляра и больше коэффициент поверхностного натяжения.
Если жидкость не смачивает капилляр, то картина будет обратной, так как мениск будет выпуклой, а центр кривизны будет находиться внутри жидкости, и давление Лапласа будет направлено вниз. Уровень жидкости в
к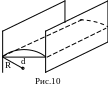 апилляре
будет ниже уровня в сосуде, в который
определен капилляр. Разность уровней
в этом случае будет также определяться
формулой (6.14) или (6.15). Жидкость может
подняться вверх и в том случае, когда
она находится между пластинами,
разделенными узким зазором. Если пластины
параллельны друг другу, то мениск имеет
цилиндрическую форму, соответственно,
дополнительное давление будет равно
апилляре
будет ниже уровня в сосуде, в который
определен капилляр. Разность уровней
в этом случае будет также определяться
формулой (6.14) или (6.15). Жидкость может
подняться вверх и в том случае, когда
она находится между пластинами,
разделенными узким зазором. Если пластины
параллельны друг другу, то мениск имеет
цилиндрическую форму, соответственно,
дополнительное давление будет равно
![]() ,
где
-радиус
мениска. Условие равновесия требует
выполнения условия:
,
где
-радиус
мениска. Условие равновесия требует
выполнения условия:
![]() ,
(6.16)
,
(6.16)
откуда
![]() .
Из рисунка 10 видно, что
.
Из рисунка 10 видно, что
![]() ,
где
-
расстояние между пластинами. Тогда
высоту подъема жидкости можно определить
по формуле
,
где
-
расстояние между пластинами. Тогда
высоту подъема жидкости можно определить
по формуле
![]() .
(6.17)
.
(6.17)
