
- •Специальные разделы оптического материаловедения
- •Термодинамика фазовых равновесий
- •1.1 Общие сведения о термодинамике
- •1 Предмет термодинамики1
- •1.1.2 Термодинамическая система, виды систем
- •Изолированные системы – те, которые не имеют возможности обмениваться веществом и энергией с окружением и имеющие постоянный объем.
- •1.1.3 Параметры состояния, параметры процессов
- •1.1.4 Функции состояния
- •1.1.5 Виды процессов
- •1.1.6 Внутренняя энергия, теплота и работа
- •1.1.7 Максимальная работа при изобарических, изотермических, адиабатических и изохорных процессах
- •1.2 Законы термодинамики
- •1.2.2 II закон термодинамики и энтропия как термодинамическая функция
- •1.2.3 Энтропия и термодинамическая вероятность. III закон термодинамики
- •Следствия Законов
- •1.2.5 Термодинамические функции, важные для материаловедения.
- •1.2.6 Применение термодинамических понятий в других областях науки
- •1.3 Производные термодинамических потенциалов и фазовые переходы
- •1.3.1 Первые производные термодинамических потенциалов, их физический
- •1.3.2 Вторые производные термодинамических потенциалов (соотношения
- •1.3.3 Фазовые переходы I и II рода.
- •1.3.4 Фазовые переходы I рода. Барическая зависимость фазовых переходов I рода:
- •1.4 Теория фазовых равновесий
- •1.4.1 Понятия «фазовые равновесия», «компонент», «диаграмма состояний»,
- •1.4.2 Понятие химического потенциала. Условия равновесия фаз. Правило фаз
- •1.4.3 Диаграмма состояний однокомпонентной системы
- •1.4.5 Эвтектики (двухкомпонентные системы). Линии ликвидуса и солидуса.
- •1.4.6 Твердые растворы (двухкомпонентные системы). Значение твердых
- •1.4.7 Ограниченные твердые растворы
- •1.4.8 Упорядочение твердых растворов
- •1.4.9 Полная несмешиваемость в жидком и в твердом состояниях
- •1.4.10 Системы с расслаиванием в жидком состоянии. Стабильное и
- •1.4.11 Системы с образованием химических соединений (двухкомпонентные
- •1.4.12 Системы с образованием химических соединений (двухкомпонентные
- •1.4.13 Трёхкомпонентные системы (принципы изображения,
- •1.4.14 Комбинация элементов диаграмм состояний. Физико-химический анализ.
- •2. Фазовые переходы и кинетическая теория стеклования
- •2.1 Стеклование
- •2.1.1 Принципиальная особенность фазовых переходов I и II рода в общей
- •2.1.2 Природа взаимодействия в конденсированных системах (общие
- •Ионное взаимодействие
- •Взаимодействие в металлах
- •Ковалентное взаимодействие
- •Водородные связи
- •Взаимодействие Ван-дер-Ваальса
- •Энергия химических связей
- •2.1.3 Основные особенности строения жидкостей и принцип их обобщенного
- •2.1.4 Общие сведения о релаксационных процессах как о процессах перехода от
- •2.1.5 Равновесные и мгновенные свойства жидкостей
- •2.1.6 Переохлажденные жидкости как частный случай метастабильного
- •2.1.7 Проявление стеклования на свойствах жидкостей
- •2.1.8 Определение стеклообразного состояния как лабильного (абсолютно
- •2.1.9 Математическое описание стеклования в кинетической теории. Твердо- и
- •2.1.10 Время релаксации структуры и его зависимость от температуры.
- •2.1.11 Соотношение температур стеклования и плавления (правило «2/3»
- •2.2 Кристаллизация расплавов стекол
- •2.2.1 Термодинамические особенности метастабильной жидкости
- •2.2.2 Работа образования зародыша кристаллизации20
- •2.2.3 Кривые Таммана а) скорость зарождения и кривая зарождения.
- •Б) скорость роста и кривая роста.
- •2.2.4 Методы изучения кристаллизационной способности и её
- •А) политермический метод и диаграммы кристаллизационной способности
- •Б) фазовый состав и морфология кристаллов.
- •В) дифференциальный термический анализ.
- •Г) скорость кристаллизации
- •2.2.5 Типы кристаллизации
- •2.2.6 Катализированная кристаллизация; ситаллы
- •2.2.7 Связь кристаллизационной способности с диаграммой состояния
- •3.Термодинамика стеклообразного состояния
- •3.1.1 Термодинамические переменные, используемые при математическом
- •3.1.2 Математическое описание избыточной свободной энергии лабильной
- •3.1.3 Математическое условие стеклования, налагаемое на изменения
- •3.1.4 Соотношение Пригожина-Дефея и его экспериментальная проверка
- •3.1.5 Термодинамический инвариант стеклообразного состояния
- •3.1.6 Следствия, вытекающие из соотношений термодинамики
- •5. Релаксационные процессы в стеклообразном состоянии. Ионная проводимость и ионный обмен
- •5.1.1 Зависимость температуры стеклования от скорости охлаждения
- •5.1.2 Процессы и законы релаксационных изменений свойств, структурная
- •5.1.3 Оценка времени достижения равновесного состояния в процессе отжига
- •5.1.4 Физическое старение стекла при комнатной температуре52
- •5.1.5 Релаксационные явления при переходе через температуру стеклования
- •5.1.6 «Кроссовер эффект»
- •5.1.7 Расчёт изменения свойств при отжиге стекол на основании
- •5.2 Природа ионной проводимости и диффузии в стеклах.
- •5.2.1 Структура стекла и основы механизма
- •5.2.2 Законы диффузии и соотношение Нернста – Эйнштейна
- •5.2.3 Основное статистическое уравнение проводимости. Энергия активации.
- •5.2.4 Общие корреляции, ряд подвижностей
- •5.2.5 Основные закономерности электропроводности, определяемые составом
- •5.2.6 Ионообменные процессы и проблемы современной оптической технологии
- •5.2.7 Ионообменные процессы с растворами. Стеклянный электрод.
- •6. Взаимосвязь между основными видами релаксационных процессов в стеклах
- •6.4.1 Соотношение Максвелла для проводимости диэлектриков
- •6.4.2 Соотношение Максвелла для проводимости диэлектриков как основа связи
- •6.4.3 Экспериментальная проверка возможности расчёта температуры «ионного» максимума внутреннего трения по данным проводимости
- •7. Основные принципы химической устойчивости стекол
- •7.1.1 Практическая значимость свойства и его физико-химическое
- •7.1.2 Методы испытания и классификация стекол по группам
- •Группы химической устойчивости бесцветного оптического стекла к действию кислоты и дистиллированной воды
- •Группы химической устойчивости бесцветного оптического стекла к действию влажной атмосферы
- •7.1.3 Влияние компонентов состава стекла на химическую устойчивость
- •7.1.4 Способы защиты оптических деталей от химического разрушения
- •8. Специфика некоторых структурных явлений в регистрирующих средах
- •8.1. Фотоструктурные изменения в халькогенидных стеклах, их существо и
- •8.2 Структурно-фазовые изменения в жидких кристаллах и физико-химическая
- •8.2.1 Общие представления о жидких кристаллах
- •8.2.2 Специфика изменения электрических и магнитных свойств при
1.2.3 Энтропия и термодинамическая вероятность. III закон термодинамики
(тепловая теорема Нернста). Вычисление энтропии при абсолютном нуле
Статистическая природа второго закона была показана Больцманом (1896). Она основывается на понятии термодинамической вероятности. Термодинамическая вероятность W отличается от математической. Термодинамическая вероятность не может быть меньше единицы. Она определяется следующим образом. Если система образована частицами, общее число которых есть N, то общее число перестановок в системе равно N!. Однако сами частицы могут подразделяться по определенным признакам в группы. В каждую группу может входить некоторое число частиц Ni.
Внутри каждой группы также возможны перестановки, их число в каждой группе есть Ni!. Термодинамическая вероятность определена как
W
=
![]() =
=
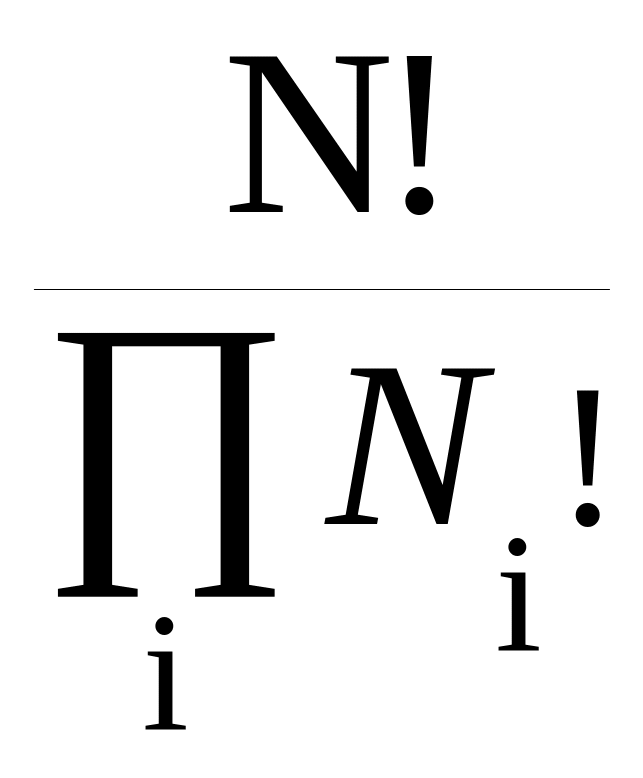 .
.
С другой стороны, энтропия системы S есть сумма энтропий составляющих её частей: S = ∑Si. Поэтому единственный вид функциональной зависимости энтропии S от W должен иметь вид S = k lnW. Отдельно доказывается, что k есть постоянная Больцмана kB.
Раздел теоретической физики, занимающийся моделированием термодинамических функций веществ на основе статистической физики, называется статистической термодинамикой.
Если энтропия системы больше нуля, это значит, что при данной энергии системы её состояние реализуется больше чем одним способом.
Различительные признаки частиц, по которым частицы (молекулы) распределяются по группам, могут соответствовать различающимся видам движений. Имея в виду поступательные, вращательные степени свободы, степени свободы вращения структурных групп внутри молекул (внутреннее вращение), колебательные движения атомов, движения электронов, энтропию системы можно представить как
S = Sпост. + Sвращ. + Sвн. вращ. + Sкол. + Sэл..
Некоторые из этих слагаемых могут также представлять сумму других составляющих.
Вероятности Wi , входящие в выражения Si = kBlnWi рассчитываются на основе теории сумм состояний соответствующих движений. Из эксперимента берутся соответствующие этим движениям частоты (колебательные, вращательные и др. – спектроскопические данные).
К различительным признакам относятся и различающиеся структуры, существующие одновременно.
Вопрос о том, каково значение энтропии вещества при абсолютном нуле, возник в начале 20-го века. в связи с необходимостью расчета химических равновесий при высоких температурах. Как мы увидим позже, энтропия является производной свободной энергии по температуре (со знаком «минус»), и для того, чтобы знать свободную энергию вещества при высокой температуре, необходимо проинтегрировать энтропию от нижнего предела, равного 0 К. Для этого нужно знать постоянную интегрирования. Нернст положил её равной нулю, что соответствовало ST=0 = 0 (тепловая теорема Нернста, 1906).
Этот вопрос позднее был существенно разработан в работах Планка и многих других исследователей. Было показано, что определение нулевой энтропии имеет значение III закона термодинамики. Сегодня есть несколько формулировок этого закона. Вот одна из них:
«По мере приближения температуры к 0 К энтропия всякой равновесной системы при изотермических процессах перестаёт зависеть от каких-либо термодинамических параметров состояния и в пределе (Т = 0 ) принимает одну и ту же для всех систем постоянную величину, которую можно принять равной нулю»5.
Для нас этот закон важен потому, что стекло не является равновесной системой, поскольку его структура заморожена и соответствует структуре жидкости при температуре стеклования. Стеклование – не равновесный переход, а переход, в котором нарушаются условия равновесности процесса. Поэтому при условиях действия III закона (Т→0) энтропия стекла стремится не к нулю, а к конечному положительному значению. Это соответствует тому, что в структуре стекла (при его определенной энергии) существует суперпозиция различающихся структурных состояний и это состояние не является внутренне равновесным.
Однако, не всякая система, сохраняющая структуру, соответствующую высокой температуре, является неравновесной в упомянутом смысле. Метастабильное состояние кристалла, избежавшего превращения в стабильное состояние, должно иметь нулевую энтропию, равную нулю. Метастабильное состояние, в отличие от стеклообразного состояния, внутренне равновесно и его энтропия должна следовать III закону. Действительно, энтропия метастабильного белого олова, которое ниже 13.2 ºС должно было бы превратиться в серое, устойчивое при низких температурах, при Т→0 также стремится к нулю. Дело в том, что структура и серого олова и белого олова при Т→0 является единственной, другие структуры здесь не существуют.
Мы упоминали о возможности расчета энтропии на основании статистической термодинамики с использованием спектроскопических данных. Следующий пример (таблица 1) показывает, насколько точно термодинамический эксперимент для азота (N2) соответствует найденной таким образом цифре при условии справедливости III закона6.
Приращение энтропии на участке температур от Т1 до Т2 рассчитывается на основании значений экспериментально найденной функциональной зависимости теплоемкости Ср(Т) на этом же интервале:
∆S
=
 .
.
Приращение энтропии при фазовом переходе рассчитывается по теплоте фазового перехода и его температуре:
∆Sф.п.
=
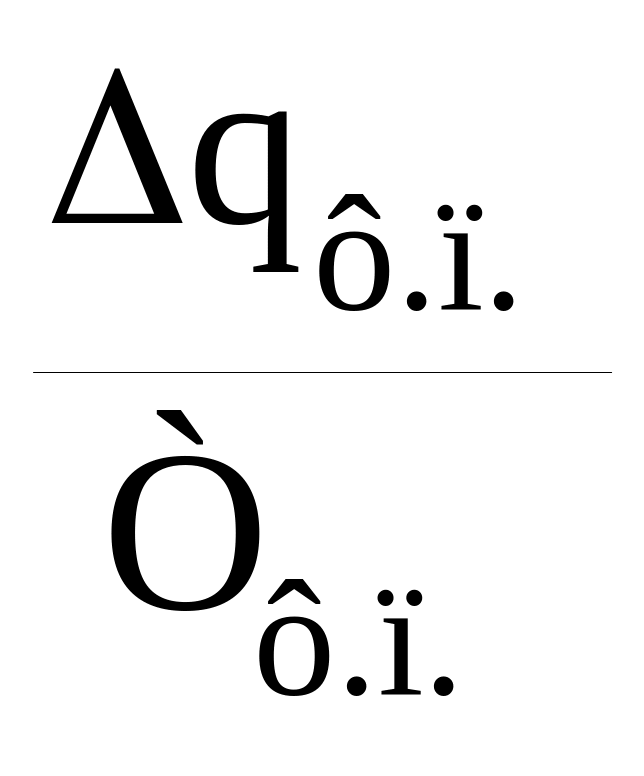 .
.
Рассчитанное значение энтропии пара для Т = 77.32 К с использованием спектроскопических данных равно 152.38 Дж/моль∙К. При точности эксперимента порядка 0.4 Дж/моль∙К, которая соответствует использовавшимся методам измерений, введения постоянной интегрирования не требуется, III закон справедлив.
Таблица 1. Расчёт энтропии азота при 0К (из книги: J.Wilks, The Third Law of Thermodynamics, Oxford, 1972).
Интервал т-р, К, или фазовый переход |
∆S, Дж/моль∙К |
0 – 10 (экстраполяция теплоёмкости по формуле Дебая) |
1.916 |
10 – 35.61 |
25.246 |
35.61 фазовый переход в крист. состоянии |
6.427 |
35.61 – 63.14 |
23.384 |
63.14 плавление |
11.418 |
63.14 – 77.32 |
11.414 |
77.32 испарение (кипение) |
72.120 |
поправка на неидеальность пара |
0.920 |
сумма |
152.845 |
