- •Специальные разделы оптического материаловедения
- •Термодинамика фазовых равновесий
- •1.1 Общие сведения о термодинамике
- •1 Предмет термодинамики1
- •1.1.2 Термодинамическая система, виды систем
- •Изолированные системы – те, которые не имеют возможности обмениваться веществом и энергией с окружением и имеющие постоянный объем.
- •1.1.3 Параметры состояния, параметры процессов
- •1.1.4 Функции состояния
- •1.1.5 Виды процессов
- •1.1.6 Внутренняя энергия, теплота и работа
- •1.1.7 Максимальная работа при изобарических, изотермических, адиабатических и изохорных процессах
- •1.2 Законы термодинамики
- •1.2.2 II закон термодинамики и энтропия как термодинамическая функция
- •1.2.3 Энтропия и термодинамическая вероятность. III закон термодинамики
- •Следствия Законов
- •1.2.5 Термодинамические функции, важные для материаловедения.
- •1.2.6 Применение термодинамических понятий в других областях науки
- •1.3 Производные термодинамических потенциалов и фазовые переходы
- •1.3.1 Первые производные термодинамических потенциалов, их физический
- •1.3.2 Вторые производные термодинамических потенциалов (соотношения
- •1.3.3 Фазовые переходы I и II рода.
- •1.3.4 Фазовые переходы I рода. Барическая зависимость фазовых переходов I рода:
- •1.4 Теория фазовых равновесий
- •1.4.1 Понятия «фазовые равновесия», «компонент», «диаграмма состояний»,
- •1.4.2 Понятие химического потенциала. Условия равновесия фаз. Правило фаз
- •1.4.3 Диаграмма состояний однокомпонентной системы
- •1.4.5 Эвтектики (двухкомпонентные системы). Линии ликвидуса и солидуса.
- •1.4.6 Твердые растворы (двухкомпонентные системы). Значение твердых
- •1.4.7 Ограниченные твердые растворы
- •1.4.8 Упорядочение твердых растворов
- •1.4.9 Полная несмешиваемость в жидком и в твердом состояниях
- •1.4.10 Системы с расслаиванием в жидком состоянии. Стабильное и
- •1.4.11 Системы с образованием химических соединений (двухкомпонентные
- •1.4.12 Системы с образованием химических соединений (двухкомпонентные
- •1.4.13 Трёхкомпонентные системы (принципы изображения,
- •1.4.14 Комбинация элементов диаграмм состояний. Физико-химический анализ.
- •2. Фазовые переходы и кинетическая теория стеклования
- •2.1 Стеклование
- •2.1.1 Принципиальная особенность фазовых переходов I и II рода в общей
- •2.1.2 Природа взаимодействия в конденсированных системах (общие
- •Ионное взаимодействие
- •Взаимодействие в металлах
- •Ковалентное взаимодействие
- •Водородные связи
- •Взаимодействие Ван-дер-Ваальса
- •Энергия химических связей
- •2.1.3 Основные особенности строения жидкостей и принцип их обобщенного
- •2.1.4 Общие сведения о релаксационных процессах как о процессах перехода от
- •2.1.5 Равновесные и мгновенные свойства жидкостей
- •2.1.6 Переохлажденные жидкости как частный случай метастабильного
- •2.1.7 Проявление стеклования на свойствах жидкостей
- •2.1.8 Определение стеклообразного состояния как лабильного (абсолютно
- •2.1.9 Математическое описание стеклования в кинетической теории. Твердо- и
- •2.1.10 Время релаксации структуры и его зависимость от температуры.
- •2.1.11 Соотношение температур стеклования и плавления (правило «2/3»
- •2.2 Кристаллизация расплавов стекол
- •2.2.1 Термодинамические особенности метастабильной жидкости
- •2.2.2 Работа образования зародыша кристаллизации20
- •2.2.3 Кривые Таммана а) скорость зарождения и кривая зарождения.
- •Б) скорость роста и кривая роста.
- •2.2.4 Методы изучения кристаллизационной способности и её
- •А) политермический метод и диаграммы кристаллизационной способности
- •Б) фазовый состав и морфология кристаллов.
- •В) дифференциальный термический анализ.
- •Г) скорость кристаллизации
- •2.2.5 Типы кристаллизации
- •2.2.6 Катализированная кристаллизация; ситаллы
- •2.2.7 Связь кристаллизационной способности с диаграммой состояния
- •3.Термодинамика стеклообразного состояния
- •3.1.1 Термодинамические переменные, используемые при математическом
- •3.1.2 Математическое описание избыточной свободной энергии лабильной
- •3.1.3 Математическое условие стеклования, налагаемое на изменения
- •3.1.4 Соотношение Пригожина-Дефея и его экспериментальная проверка
- •3.1.5 Термодинамический инвариант стеклообразного состояния
- •3.1.6 Следствия, вытекающие из соотношений термодинамики
- •5. Релаксационные процессы в стеклообразном состоянии. Ионная проводимость и ионный обмен
- •5.1.1 Зависимость температуры стеклования от скорости охлаждения
- •5.1.2 Процессы и законы релаксационных изменений свойств, структурная
- •5.1.3 Оценка времени достижения равновесного состояния в процессе отжига
- •5.1.4 Физическое старение стекла при комнатной температуре52
- •5.1.5 Релаксационные явления при переходе через температуру стеклования
- •5.1.6 «Кроссовер эффект»
- •5.1.7 Расчёт изменения свойств при отжиге стекол на основании
- •5.2 Природа ионной проводимости и диффузии в стеклах.
- •5.2.1 Структура стекла и основы механизма
- •5.2.2 Законы диффузии и соотношение Нернста – Эйнштейна
- •5.2.3 Основное статистическое уравнение проводимости. Энергия активации.
- •5.2.4 Общие корреляции, ряд подвижностей
- •5.2.5 Основные закономерности электропроводности, определяемые составом
- •5.2.6 Ионообменные процессы и проблемы современной оптической технологии
- •5.2.7 Ионообменные процессы с растворами. Стеклянный электрод.
- •6. Взаимосвязь между основными видами релаксационных процессов в стеклах
- •6.4.1 Соотношение Максвелла для проводимости диэлектриков
- •6.4.2 Соотношение Максвелла для проводимости диэлектриков как основа связи
- •6.4.3 Экспериментальная проверка возможности расчёта температуры «ионного» максимума внутреннего трения по данным проводимости
- •7. Основные принципы химической устойчивости стекол
- •7.1.1 Практическая значимость свойства и его физико-химическое
- •7.1.2 Методы испытания и классификация стекол по группам
- •Группы химической устойчивости бесцветного оптического стекла к действию кислоты и дистиллированной воды
- •Группы химической устойчивости бесцветного оптического стекла к действию влажной атмосферы
- •7.1.3 Влияние компонентов состава стекла на химическую устойчивость
- •7.1.4 Способы защиты оптических деталей от химического разрушения
- •8. Специфика некоторых структурных явлений в регистрирующих средах
- •8.1. Фотоструктурные изменения в халькогенидных стеклах, их существо и
- •8.2 Структурно-фазовые изменения в жидких кристаллах и физико-химическая
- •8.2.1 Общие представления о жидких кристаллах
- •8.2.2 Специфика изменения электрических и магнитных свойств при
1.2 Законы термодинамики
1.2.1 I закон термодинамики4.
I закон – это закон сохранения энергии:
Разные формы энергии переходят друг в друга в строго эквивалентных отношениях, или
В любой изолированной системе общий запас энергии остаётся постоянным.
В терминах внутренней энергии, теплоты и работы эти утверждения выглядят так:
dU = δQ – δA (что соответствует U = Q – A).
Изменение внутренней энергии есть полный дифференциал, так как U – функция состояния. dU складывается из сообщенной системе теплоты δQ и работы δA, совершенной системой над окружением.
dU есть полный дифференциал, а δQ и δA – только изменения.
Можно разрядить батарейку карманного фонаря (уменьшить её внутреннюю энергию) разными способами. Этот процесс необратим. Можно заставить вертеться электромоторчик, который будет совершать некоторую работу. Тогда выделение тепла рассматривается как нежелательное явление. Можно заставить гореть электрическую лампочку, выделение тепла будет наиболее желательным процессом, потому что при этом будет максимальное количество света.
Если работа совершается над системой, то знак перед δA меняется на «+».
В отличие от теплоты Q, которая не является параметром состояния, в термодинамике вводится функция состояния, называемая энтальпией (теплосодержанием), которая определена соотношением
∆H = ∆U + p∆V (что соответствует H = U + pV).
По I закону
∆U = ∆Q – ∆A.
Для обратимых процессов (когда сил трения нет) вся работа определена как
∆A = p∆V.
Тогда получаем, что ∆H = ∆Q. Следовательно, приращение этой функции (∆H) соответствует обратимому поглощению системой тепла в количестве ∆Q.
В рассмотрение водится теплоемкость при постоянном давлении Сp = dH/dT, которая должна измеряться в условиях, соответствующих обратимому восприятию телом тепла.
Эта проблема решается в так называемых адиабатических калориметрах. Последние представляют собой очень хорошо теплоизолированные ячейки типа сосуда Дьюара. Внутри ячейки находится испытуемый образец и устройство регистрации температуры. В сосуд введены провода, через которые подается электрический ток при строго контролируемых силе и напряжении в течение определенного времени. Над образцом производится работа, но образцу не сообщается непосредственно тепло. По закону Джоуля обратимо совершаемая работа переходит в эквивалентное количество обратимо сообщаемого тепла.
Аналогично при постоянном объеме СV = dU/dT.
1.2.2 II закон термодинамики и энтропия как термодинамическая функция
состояния
Этот закон определяет направление самопроизвольных процессов. Тело падает в соответствии с законом тяготения, жидкость при охлаждении кристаллизуется, при перегреве выше точки кипения она вскипает, электрический источник тока при разрядке производит определенную работу и т.д. Возможность, направление и предел самопроизвольного протекания процесса зависят от величин и изменений факторов интенсивности, когда неравновесное состояние переходит в равновесное.
Формулировка II закона может быть дана в различных редакциях.
Теплота не может переходить сама собой от холодного тела к тёплому.
или
Невозможен процесс, единственным результатом которого было бы превращение тепла в работу, и т.д.
Наша задача состоит в том, чтобы прежде всего понять сущность теории фазовых равновесий как основы современного материаловедения. Для этого нужно понять смысл свободной энергии системы (это понятие мы введем позже). Для нас также важен смысл важнейшей термодинамической функции – энтропии, поскольку в физике стеклообразного состояния именно она представляет первостепенный интерес как функционал состояния, связанный с беспорядком.
Молодой французский инженер Сади Карно (Carnot) в 1828 г. заложил основы теории тепловых машин, из которых позже выросла термодинамика.
|
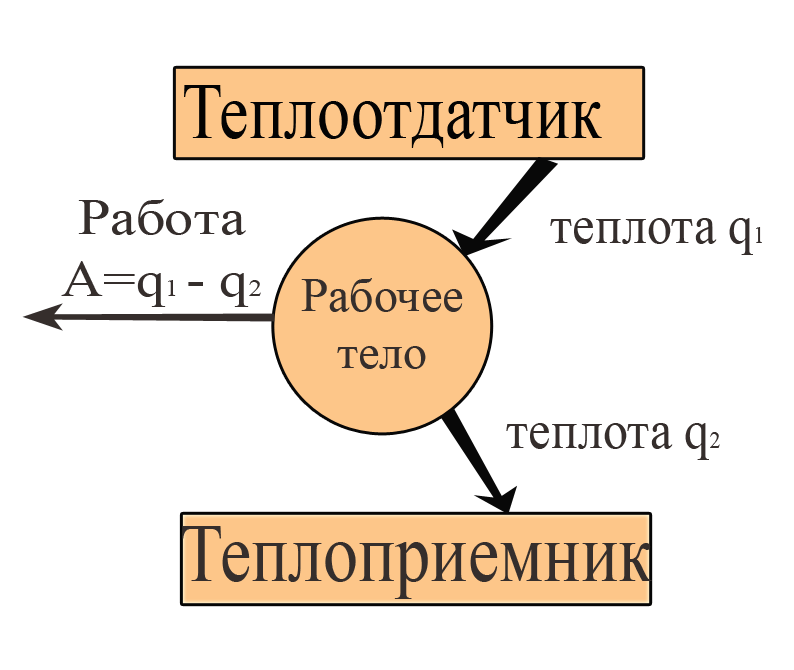
Рис. 2. Схема передачи теплоты при совершении работы. Пояснения см. в тексте. |
Речь идёт о коэффициенте полезного действия η тепловой машины. Последняя представляет собой теплоотдатчик, сообщающий рабочему телу теплоту q1 (рис. 2).
Рабочее тело – пар, действующий на поршень, способный совершать поступательные движения, превращаемые в работу A. После совершения работы рабочее тело отдает теплоприёмнику (это может быть окружающая среда) количество тепла q2. Работа является максимальной, если в машине нет трения:
A = q1 – q2 .
Тогда коэффициент полезного действия (КПД) определен как
η =
![]() =
=
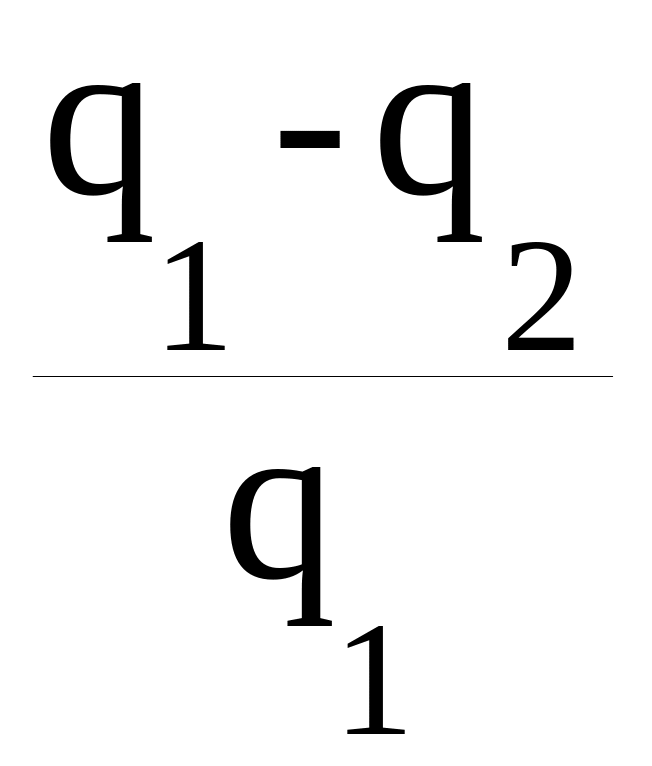 .
.
Ниже доказывается, что наибольший КПД тепловой машины не зависит от природы рабочего тела, а зависит только от температуры теплоотдатчика и теплоприемника.
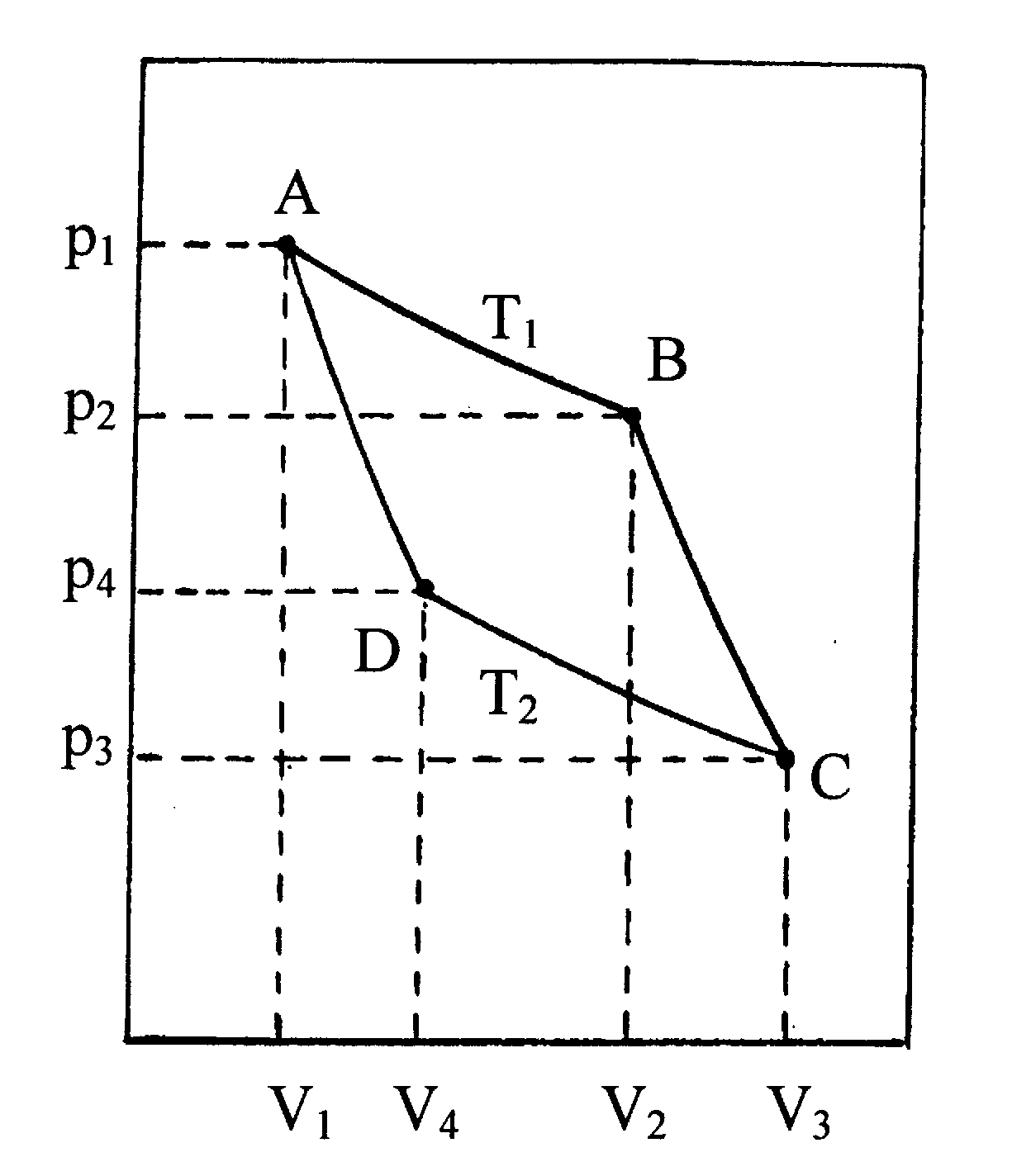
Цикл Карно (рис. 3) представляет последовательность изотермических и адиабатических процессов, в результате которых система приходит в первоначальное состояние. Пусть силы трения отсутствуют и все работы – максимально возможные.
|
Рис. 3. Пояснение цикла Карно, см. текст. |
q1 = A1
= RT1ln![]() .
.
При адиабатическом расширении (BС)
A2 = Cv(T1 – T2).
При изотермическом сжатии (CD) при температуре Т2
q2 = A3
= RT2ln![]() .
.
При адиабатическом сжатии (DA)
A4 = Cv(T2 –T1).
Специально доказывается, что
![]() =
=
![]() ( с использованием уравнений для адиабаты
p2V
( с использованием уравнений для адиабаты
p2V![]() =
p3V
=
p3V![]() и p1V
и p1V![]() =
p4V
=
p4V![]() ,
где γ =
,
где γ =
![]() ).
Из этих уравнений получаем:
).
Из этих уравнений получаем:
q1 – q2 = R(T1–T2)ln .
Используя полученное выше соотношение: q1 = RT1ln(V2/V1), разделив в предыдущем уравнении левую часть на q1, а правую на RT1ln(V2/V1), получаем
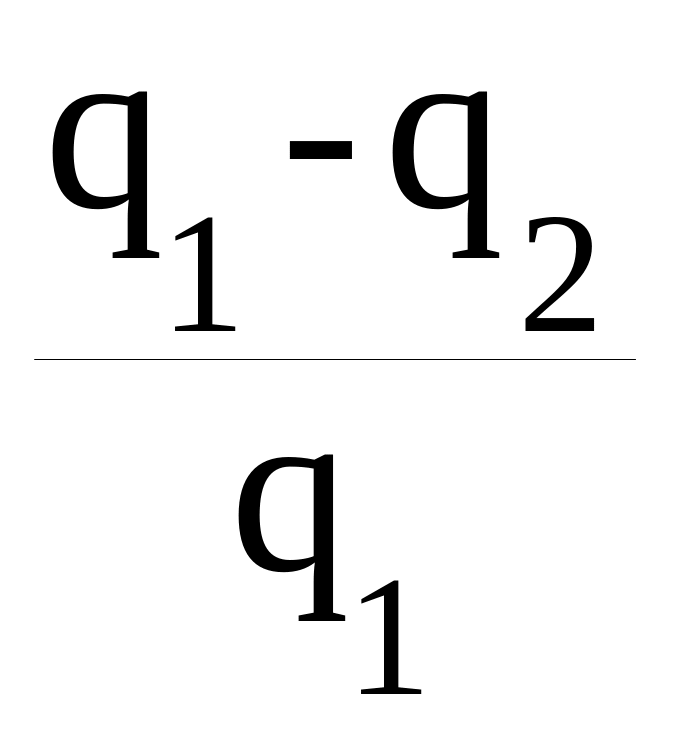 =
=
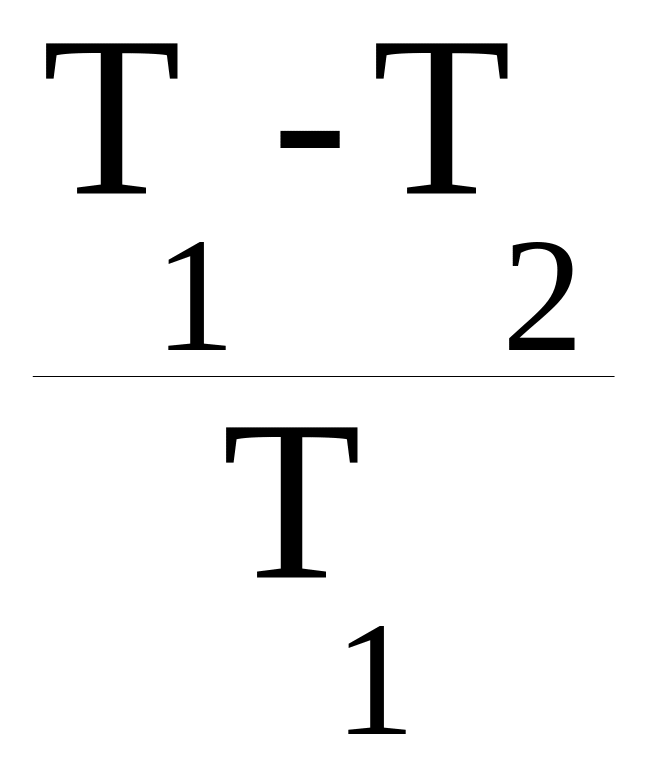 .
.
После элементарных преобразований имеем:
![]() =
=
![]() .
.
Поскольку любое изменение теплоты qi может быть представлено как малое приращение δqi, получаем, что в общем случае
![]() =
=
![]() = 0.
= 0.
В соответствии с теорией интегралов
для этого случая
![]() обладает
свойствами полного дифференциала
некоторой функции. Последняя была
названа энтропией S (
=ΔS).
обладает
свойствами полного дифференциала
некоторой функции. Последняя была
названа энтропией S (
=ΔS).
Значение S зависит только от состояния, но не от пути прихода в это состояние, если все процессы – равновесные, а состояния – обратимые.
Возвращаясь к вопросу о максимальном КПД, единственное заключение, которое можно сделать – это то, что максимальный КПД может быть достигнут только при равенстве нулю температуры приёмника, что, видимо, неосуществимо. Этот вывод был чрезвычайно важен, поскольку он показал, что коэффициент полезного действия не зависит от материала рабочего тела и даже при отсутствии трения не может быть равным 1.
При использовании полученного результата I закон выглядит следующим образом:
dU = TdS – δA.
Эта запись показывает, что при обратимых (равновесных) процессах изменение внутренней энергии не может быть полностью превращено в работу. Этот чрезвычайно важный вывод мы рассмотрим позже.
При необратимых процессах всегда
∆S > ,
поскольку при этом происходит диссипация (рассеяние) энергии, (например, при трении) имеются необратимые потери тепла. Энтропия окружения в результате возрастает.
В адиабатических процессах энтропия не изменяется (процессы изоэнтропийны), так как δq = 0.
Системы с постоянной внутренней энергией и постоянным объемом стремятся к устойчивому состоянию с максимумом энтропии (dS = 0, d2S <0). В середине 19 в. это утверждение послужило основой для гипотезы о тепловой смерти Вселенной (Клаузиус), которая предполагала, что выравнивание температуры, соответствующее максимуму энтропии, приведет к невозможности любых процессов. Позднее эта гипотеза была признана ошибочной, так как не учитывала статистическую природу Второго начала термодинамики и другие теоретические обстоятельства (например, протекание ядерных реакций и др.).