- •Специальные разделы оптического материаловедения
- •Термодинамика фазовых равновесий
- •1.1 Общие сведения о термодинамике
- •1 Предмет термодинамики1
- •1.1.2 Термодинамическая система, виды систем
- •Изолированные системы – те, которые не имеют возможности обмениваться веществом и энергией с окружением и имеющие постоянный объем.
- •1.1.3 Параметры состояния, параметры процессов
- •1.1.4 Функции состояния
- •1.1.5 Виды процессов
- •1.1.6 Внутренняя энергия, теплота и работа
- •1.1.7 Максимальная работа при изобарических, изотермических, адиабатических и изохорных процессах
- •1.2 Законы термодинамики
- •1.2.2 II закон термодинамики и энтропия как термодинамическая функция
- •1.2.3 Энтропия и термодинамическая вероятность. III закон термодинамики
- •Следствия Законов
- •1.2.5 Термодинамические функции, важные для материаловедения.
- •1.2.6 Применение термодинамических понятий в других областях науки
- •1.3 Производные термодинамических потенциалов и фазовые переходы
- •1.3.1 Первые производные термодинамических потенциалов, их физический
- •1.3.2 Вторые производные термодинамических потенциалов (соотношения
- •1.3.3 Фазовые переходы I и II рода.
- •1.3.4 Фазовые переходы I рода. Барическая зависимость фазовых переходов I рода:
- •1.4 Теория фазовых равновесий
- •1.4.1 Понятия «фазовые равновесия», «компонент», «диаграмма состояний»,
- •1.4.2 Понятие химического потенциала. Условия равновесия фаз. Правило фаз
- •1.4.3 Диаграмма состояний однокомпонентной системы
- •1.4.5 Эвтектики (двухкомпонентные системы). Линии ликвидуса и солидуса.
- •1.4.6 Твердые растворы (двухкомпонентные системы). Значение твердых
- •1.4.7 Ограниченные твердые растворы
- •1.4.8 Упорядочение твердых растворов
- •1.4.9 Полная несмешиваемость в жидком и в твердом состояниях
- •1.4.10 Системы с расслаиванием в жидком состоянии. Стабильное и
- •1.4.11 Системы с образованием химических соединений (двухкомпонентные
- •1.4.12 Системы с образованием химических соединений (двухкомпонентные
- •1.4.13 Трёхкомпонентные системы (принципы изображения,
- •1.4.14 Комбинация элементов диаграмм состояний. Физико-химический анализ.
- •2. Фазовые переходы и кинетическая теория стеклования
- •2.1 Стеклование
- •2.1.1 Принципиальная особенность фазовых переходов I и II рода в общей
- •2.1.2 Природа взаимодействия в конденсированных системах (общие
- •Ионное взаимодействие
- •Взаимодействие в металлах
- •Ковалентное взаимодействие
- •Водородные связи
- •Взаимодействие Ван-дер-Ваальса
- •Энергия химических связей
- •2.1.3 Основные особенности строения жидкостей и принцип их обобщенного
- •2.1.4 Общие сведения о релаксационных процессах как о процессах перехода от
- •2.1.5 Равновесные и мгновенные свойства жидкостей
- •2.1.6 Переохлажденные жидкости как частный случай метастабильного
- •2.1.7 Проявление стеклования на свойствах жидкостей
- •2.1.8 Определение стеклообразного состояния как лабильного (абсолютно
- •2.1.9 Математическое описание стеклования в кинетической теории. Твердо- и
- •2.1.10 Время релаксации структуры и его зависимость от температуры.
- •2.1.11 Соотношение температур стеклования и плавления (правило «2/3»
- •2.2 Кристаллизация расплавов стекол
- •2.2.1 Термодинамические особенности метастабильной жидкости
- •2.2.2 Работа образования зародыша кристаллизации20
- •2.2.3 Кривые Таммана а) скорость зарождения и кривая зарождения.
- •Б) скорость роста и кривая роста.
- •2.2.4 Методы изучения кристаллизационной способности и её
- •А) политермический метод и диаграммы кристаллизационной способности
- •Б) фазовый состав и морфология кристаллов.
- •В) дифференциальный термический анализ.
- •Г) скорость кристаллизации
- •2.2.5 Типы кристаллизации
- •2.2.6 Катализированная кристаллизация; ситаллы
- •2.2.7 Связь кристаллизационной способности с диаграммой состояния
- •3.Термодинамика стеклообразного состояния
- •3.1.1 Термодинамические переменные, используемые при математическом
- •3.1.2 Математическое описание избыточной свободной энергии лабильной
- •3.1.3 Математическое условие стеклования, налагаемое на изменения
- •3.1.4 Соотношение Пригожина-Дефея и его экспериментальная проверка
- •3.1.5 Термодинамический инвариант стеклообразного состояния
- •3.1.6 Следствия, вытекающие из соотношений термодинамики
- •5. Релаксационные процессы в стеклообразном состоянии. Ионная проводимость и ионный обмен
- •5.1.1 Зависимость температуры стеклования от скорости охлаждения
- •5.1.2 Процессы и законы релаксационных изменений свойств, структурная
- •5.1.3 Оценка времени достижения равновесного состояния в процессе отжига
- •5.1.4 Физическое старение стекла при комнатной температуре52
- •5.1.5 Релаксационные явления при переходе через температуру стеклования
- •5.1.6 «Кроссовер эффект»
- •5.1.7 Расчёт изменения свойств при отжиге стекол на основании
- •5.2 Природа ионной проводимости и диффузии в стеклах.
- •5.2.1 Структура стекла и основы механизма
- •5.2.2 Законы диффузии и соотношение Нернста – Эйнштейна
- •5.2.3 Основное статистическое уравнение проводимости. Энергия активации.
- •5.2.4 Общие корреляции, ряд подвижностей
- •5.2.5 Основные закономерности электропроводности, определяемые составом
- •5.2.6 Ионообменные процессы и проблемы современной оптической технологии
- •5.2.7 Ионообменные процессы с растворами. Стеклянный электрод.
- •6. Взаимосвязь между основными видами релаксационных процессов в стеклах
- •6.4.1 Соотношение Максвелла для проводимости диэлектриков
- •6.4.2 Соотношение Максвелла для проводимости диэлектриков как основа связи
- •6.4.3 Экспериментальная проверка возможности расчёта температуры «ионного» максимума внутреннего трения по данным проводимости
- •7. Основные принципы химической устойчивости стекол
- •7.1.1 Практическая значимость свойства и его физико-химическое
- •7.1.2 Методы испытания и классификация стекол по группам
- •Группы химической устойчивости бесцветного оптического стекла к действию кислоты и дистиллированной воды
- •Группы химической устойчивости бесцветного оптического стекла к действию влажной атмосферы
- •7.1.3 Влияние компонентов состава стекла на химическую устойчивость
- •7.1.4 Способы защиты оптических деталей от химического разрушения
- •8. Специфика некоторых структурных явлений в регистрирующих средах
- •8.1. Фотоструктурные изменения в халькогенидных стеклах, их существо и
- •8.2 Структурно-фазовые изменения в жидких кристаллах и физико-химическая
- •8.2.1 Общие представления о жидких кристаллах
- •8.2.2 Специфика изменения электрических и магнитных свойств при
1.1.5 Виды процессов
Изобарные процессы – происходящие при постоянстве давления (р = const).
Изохорные процессы – происходящие при постоянном объеме (V = const).
Изотермические процессы – происходящие при постоянной температуре (T = const).
Адиабатические процессы происходят без обмена теплом с окружением (∆Q = 0).
Обратимые процессы – те, которые происходят так, что имеется возможность возвращения системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения (например, трение в таких процессах всегда отсутствует). «Термодинамика – это теория систем, лишенных трения» (П. Дюгем, 1882).
Необратимые процессы – те, после протекания которых в окружающей среде остаются изменения. Например, наличие трения приводят к теплоте, рассеиваемой в окружение.
Последовательность обратимых процессов соответствует термину «равновесный процесс».
Стационарные процессы – те, развитие которых происходит в результате неизменности причин, вызывающих этот процесс (стационарный ≡ устоявшийся). Скорость процесса при этом может меняться со временем.
1.1.6 Внутренняя энергия, теплота и работа
Внутренняя энергия U определена полным запасом энергии системы, без различий потенциальной и кинетической видов энергии. U есть функция состояния.
Работа А соответствует величине энергии, передаваемой системой (системе) с изменением её внешних параметров. Например, если система характеризуется изменяемым параметром - объемом V, то работа равна произведению изменения объема на давление:
∆A = p∙∆V.
Вообще говоря, работа всегда равна произведению фактора интенсивности (силы, давления, электрического напряжения и пр.) на фактор ёмкости (путь, объем, сила тока, время и пр.).
Количество теплоты ∆Q соответствует количеству энергии, передаваемой системе (или получаемой ею) без изменения внешних параметров этой системы (без совершения работы). Если в результате процесса тепло выделяется, ∆Q имеет отрицательный знак, если поглощается, - положительный. Аналогично определяются знаки и ∆А. Если работа производится системой, она считается отрицательной, если окружение совершает работу, то положительной.
Работа и теплота вообще говоря не являются функциями состояния, так как они зависят от пути процесса.
Работа и теплота сами по себе не являются видами энергии, они представляют собой два различных способа передачи энергии, они характеризуют процесс энергообмена между системами и имеют размерность энергии2.
1.1.7 Максимальная работа при изобарических, изотермических, адиабатических и изохорных процессах
Для простоты рассмотрим идеальный газ, заключенный в определенном объеме при определенном давлении, когда объем может меняться за счет перемещения поршня без трения. Отсутствие трения позволяет рассматривать совершаемую работу Am как максимально полезную.
Напомним, что для моля идеального газа справедливо уравнение состояния pV = RT (один моль газа).
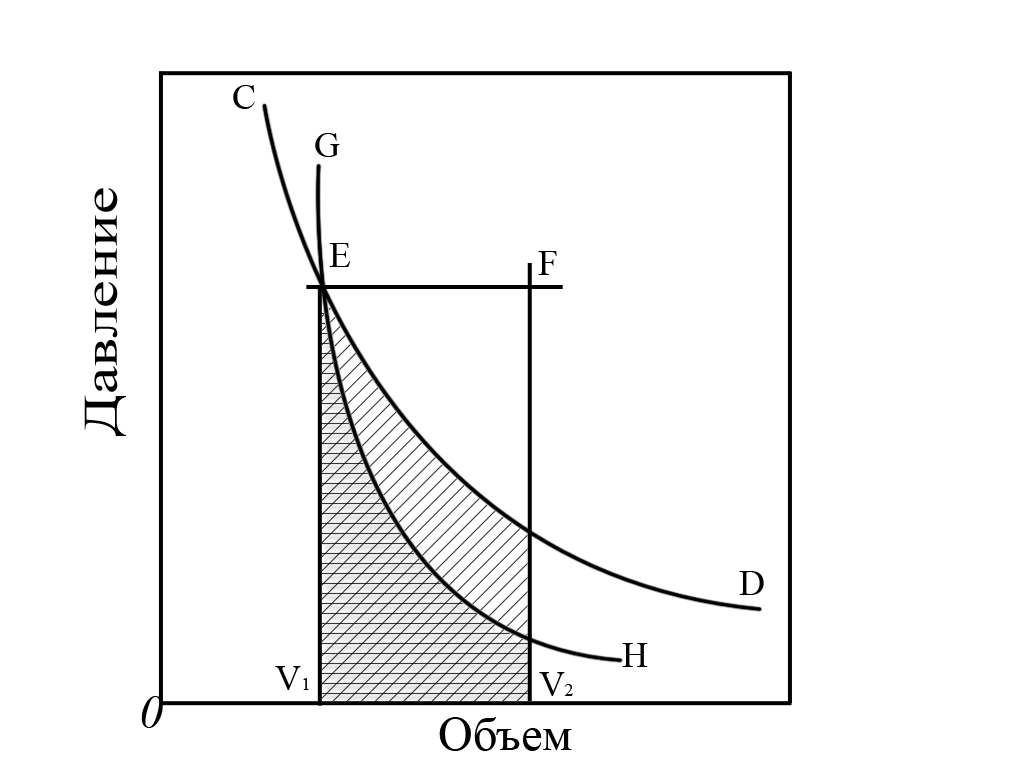
На приведенном рис. 1 в изобарном процессе мы перемещаемся из точки Е в точку F.
Линия GH соответствует адиабатическому процессу, линия CD – изотермическому.
а) При изобарном процессе
Am = p(V2 – V1).
Используя уравнение состояния, имеем
Am = R(T2 – T1).
b) При изотермическом процессе
Am
= RT
![]() = RTln (
= RTln (![]() )
= RTln(
)
= RTln(![]() ).
).
|
Рис. 1. Изменение давления от объема системы при изобарическом (EF), изотермическом (СED) и адиабатическом (GEH) процессах. |
При адиабатическом процессе тепло не подводится и не отнимается, работа совершается только за счёт изменения внутренней энергии3:
Am = Cv(T1–T2).
Здесь в выражение входит теплоемкость при постоянном объеме, и газ при свободном расширении (увеличение объема) обычно охлаждается, внутренняя энергия его уменьшается.
d) При изохорном процессе работа не совершается (внешний параметр системы не изменяется),
Am = 0.