- •Специальные разделы оптического материаловедения
- •Термодинамика фазовых равновесий
- •1.1 Общие сведения о термодинамике
- •1 Предмет термодинамики1
- •1.1.2 Термодинамическая система, виды систем
- •Изолированные системы – те, которые не имеют возможности обмениваться веществом и энергией с окружением и имеющие постоянный объем.
- •1.1.3 Параметры состояния, параметры процессов
- •1.1.4 Функции состояния
- •1.1.5 Виды процессов
- •1.1.6 Внутренняя энергия, теплота и работа
- •1.1.7 Максимальная работа при изобарических, изотермических, адиабатических и изохорных процессах
- •1.2 Законы термодинамики
- •1.2.2 II закон термодинамики и энтропия как термодинамическая функция
- •1.2.3 Энтропия и термодинамическая вероятность. III закон термодинамики
- •Следствия Законов
- •1.2.5 Термодинамические функции, важные для материаловедения.
- •1.2.6 Применение термодинамических понятий в других областях науки
- •1.3 Производные термодинамических потенциалов и фазовые переходы
- •1.3.1 Первые производные термодинамических потенциалов, их физический
- •1.3.2 Вторые производные термодинамических потенциалов (соотношения
- •1.3.3 Фазовые переходы I и II рода.
- •1.3.4 Фазовые переходы I рода. Барическая зависимость фазовых переходов I рода:
- •1.4 Теория фазовых равновесий
- •1.4.1 Понятия «фазовые равновесия», «компонент», «диаграмма состояний»,
- •1.4.2 Понятие химического потенциала. Условия равновесия фаз. Правило фаз
- •1.4.3 Диаграмма состояний однокомпонентной системы
- •1.4.5 Эвтектики (двухкомпонентные системы). Линии ликвидуса и солидуса.
- •1.4.6 Твердые растворы (двухкомпонентные системы). Значение твердых
- •1.4.7 Ограниченные твердые растворы
- •1.4.8 Упорядочение твердых растворов
- •1.4.9 Полная несмешиваемость в жидком и в твердом состояниях
- •1.4.10 Системы с расслаиванием в жидком состоянии. Стабильное и
- •1.4.11 Системы с образованием химических соединений (двухкомпонентные
- •1.4.12 Системы с образованием химических соединений (двухкомпонентные
- •1.4.13 Трёхкомпонентные системы (принципы изображения,
- •1.4.14 Комбинация элементов диаграмм состояний. Физико-химический анализ.
- •2. Фазовые переходы и кинетическая теория стеклования
- •2.1 Стеклование
- •2.1.1 Принципиальная особенность фазовых переходов I и II рода в общей
- •2.1.2 Природа взаимодействия в конденсированных системах (общие
- •Ионное взаимодействие
- •Взаимодействие в металлах
- •Ковалентное взаимодействие
- •Водородные связи
- •Взаимодействие Ван-дер-Ваальса
- •Энергия химических связей
- •2.1.3 Основные особенности строения жидкостей и принцип их обобщенного
- •2.1.4 Общие сведения о релаксационных процессах как о процессах перехода от
- •2.1.5 Равновесные и мгновенные свойства жидкостей
- •2.1.6 Переохлажденные жидкости как частный случай метастабильного
- •2.1.7 Проявление стеклования на свойствах жидкостей
- •2.1.8 Определение стеклообразного состояния как лабильного (абсолютно
- •2.1.9 Математическое описание стеклования в кинетической теории. Твердо- и
- •2.1.10 Время релаксации структуры и его зависимость от температуры.
- •2.1.11 Соотношение температур стеклования и плавления (правило «2/3»
- •2.2 Кристаллизация расплавов стекол
- •2.2.1 Термодинамические особенности метастабильной жидкости
- •2.2.2 Работа образования зародыша кристаллизации20
- •2.2.3 Кривые Таммана а) скорость зарождения и кривая зарождения.
- •Б) скорость роста и кривая роста.
- •2.2.4 Методы изучения кристаллизационной способности и её
- •А) политермический метод и диаграммы кристаллизационной способности
- •Б) фазовый состав и морфология кристаллов.
- •В) дифференциальный термический анализ.
- •Г) скорость кристаллизации
- •2.2.5 Типы кристаллизации
- •2.2.6 Катализированная кристаллизация; ситаллы
- •2.2.7 Связь кристаллизационной способности с диаграммой состояния
- •3.Термодинамика стеклообразного состояния
- •3.1.1 Термодинамические переменные, используемые при математическом
- •3.1.2 Математическое описание избыточной свободной энергии лабильной
- •3.1.3 Математическое условие стеклования, налагаемое на изменения
- •3.1.4 Соотношение Пригожина-Дефея и его экспериментальная проверка
- •3.1.5 Термодинамический инвариант стеклообразного состояния
- •3.1.6 Следствия, вытекающие из соотношений термодинамики
- •5. Релаксационные процессы в стеклообразном состоянии. Ионная проводимость и ионный обмен
- •5.1.1 Зависимость температуры стеклования от скорости охлаждения
- •5.1.2 Процессы и законы релаксационных изменений свойств, структурная
- •5.1.3 Оценка времени достижения равновесного состояния в процессе отжига
- •5.1.4 Физическое старение стекла при комнатной температуре52
- •5.1.5 Релаксационные явления при переходе через температуру стеклования
- •5.1.6 «Кроссовер эффект»
- •5.1.7 Расчёт изменения свойств при отжиге стекол на основании
- •5.2 Природа ионной проводимости и диффузии в стеклах.
- •5.2.1 Структура стекла и основы механизма
- •5.2.2 Законы диффузии и соотношение Нернста – Эйнштейна
- •5.2.3 Основное статистическое уравнение проводимости. Энергия активации.
- •5.2.4 Общие корреляции, ряд подвижностей
- •5.2.5 Основные закономерности электропроводности, определяемые составом
- •5.2.6 Ионообменные процессы и проблемы современной оптической технологии
- •5.2.7 Ионообменные процессы с растворами. Стеклянный электрод.
- •6. Взаимосвязь между основными видами релаксационных процессов в стеклах
- •6.4.1 Соотношение Максвелла для проводимости диэлектриков
- •6.4.2 Соотношение Максвелла для проводимости диэлектриков как основа связи
- •6.4.3 Экспериментальная проверка возможности расчёта температуры «ионного» максимума внутреннего трения по данным проводимости
- •7. Основные принципы химической устойчивости стекол
- •7.1.1 Практическая значимость свойства и его физико-химическое
- •7.1.2 Методы испытания и классификация стекол по группам
- •Группы химической устойчивости бесцветного оптического стекла к действию кислоты и дистиллированной воды
- •Группы химической устойчивости бесцветного оптического стекла к действию влажной атмосферы
- •7.1.3 Влияние компонентов состава стекла на химическую устойчивость
- •7.1.4 Способы защиты оптических деталей от химического разрушения
- •8. Специфика некоторых структурных явлений в регистрирующих средах
- •8.1. Фотоструктурные изменения в халькогенидных стеклах, их существо и
- •8.2 Структурно-фазовые изменения в жидких кристаллах и физико-химическая
- •8.2.1 Общие представления о жидких кристаллах
- •8.2.2 Специфика изменения электрических и магнитных свойств при
5.2.7 Ионообменные процессы с растворами. Стеклянный электрод.
Ионообменные процессы стекла с водными или другими растворами играют ключевую роль в создании стеклянных электродов, служащих для определения концентрации ионов водорода или ионов металлов. Значения pH исключительно важны во всех областях человеческой деятельности – в химической, пищевой, строительной и др. промышленностях, в медицине, в сельском хозяйстве (земледелие) и т.д.63
На рис. 81 показана схема устройства стеклянного электрода. Стеклянный электрод (1) представляет стеклянную трубку (а), имеющую в торце стеклянную мембрану (б). Внутри находится раствор кислоты известной и постоянной концентрации (в) и в нём - платиновый электрод (г). При помещении стеклянного электрода в испытуемый раствор (2) ионы из этого раствора (Н+) обмениваются с катионами в стекле и входят в его структуру. В результате устанавливается химическое равновесие между ионами водорода в стекле и ионами водорода в испытуемом растворе. Положение равновесия определяется концентрацией ионов в растворе и в стекле. В результате этого возникает скачок потенциала между стеклом и исследуемым раствором. Его можно определить с помощью второго электрода (3) (каломельного электрода сравнения), который через электролитический мостик (4) связан с испытуемым раствором. Разность потенциалов стеклянного электрода и электрода сравнения (ЭДС, V) определена логарифмом отношения концентраций в испытуемом растворе и в растворе, находящемся внутри пузырька:
ЭДС = const
+![]() ∙
ln[H+].
∙
ln[H+].
Здесь F – число Фарадея. Постоянное слагаемое здесь определяется выбранной стандартной концентрацией, составом стекла и др. факторами. Если электрод предназначен для определения концентрации других ионов, выражение аналогично.
Принцип стеклянного электрода был известен с начала 20 в. (работы В.Нернста и др.). В исследованиях природы процессов, определяющих его функционирование, и его основного материала – стекла, большую роль сыграли работы российских учёных петербургской научной школы – Б.П.Никольского, М.М.Шульца, и многих других.
-
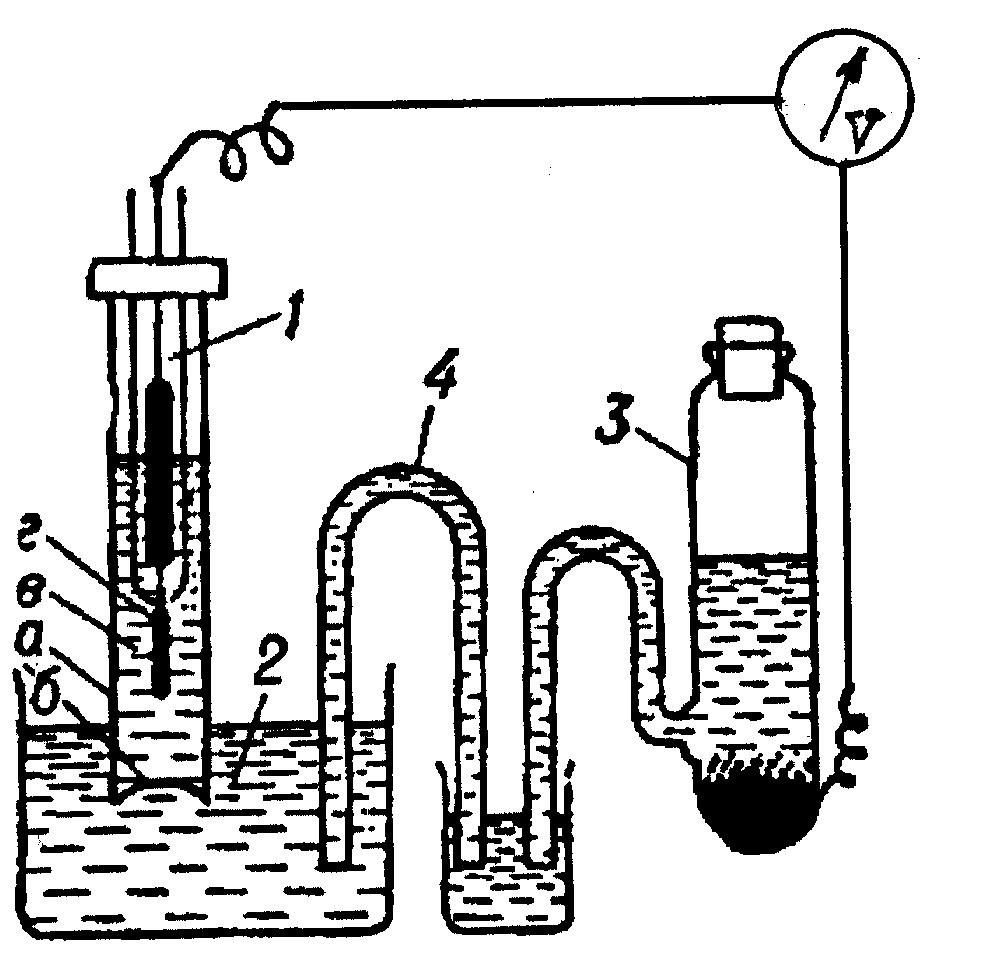
Рис. 81. Схема стеклянного электрода
(пояснения в тексте).
6. Взаимосвязь между основными видами релаксационных процессов в стеклах
6.1 Основные виды релаксационных процессов в стеклах. Внутреннее трение
Внутреннее трение (механические потери при периодическом воздействии на образец) было предметом многочисленных исследований во всех странах, проводящих исследования стеклообразного состояния, начиная с конца 50-х годов прошлого века. Эксперименты такого рода обычно производят на образцах в виде нитей, которым на нижних концах сообщается периодическое закручивающее усилие (частота f). При увеличении температуры происходит поглощение усилия, если частота воздействия совпадает с частотой релаксационных процессов в образце.
При рассмотрении отклика образца на периодическое воздействие величинами, характеризующими внутреннее трение, могут быть тангенс угла потерь tgδ, где δ – угол механических потерь; λ – логарифмический декремент затухания колебаний и Q-1, где – Q – добротность. Они соотносятся как
Q-1
= Δ![]() = tgδ
= 2.3026 λ/π.
= tgδ
= 2.3026 λ/π.
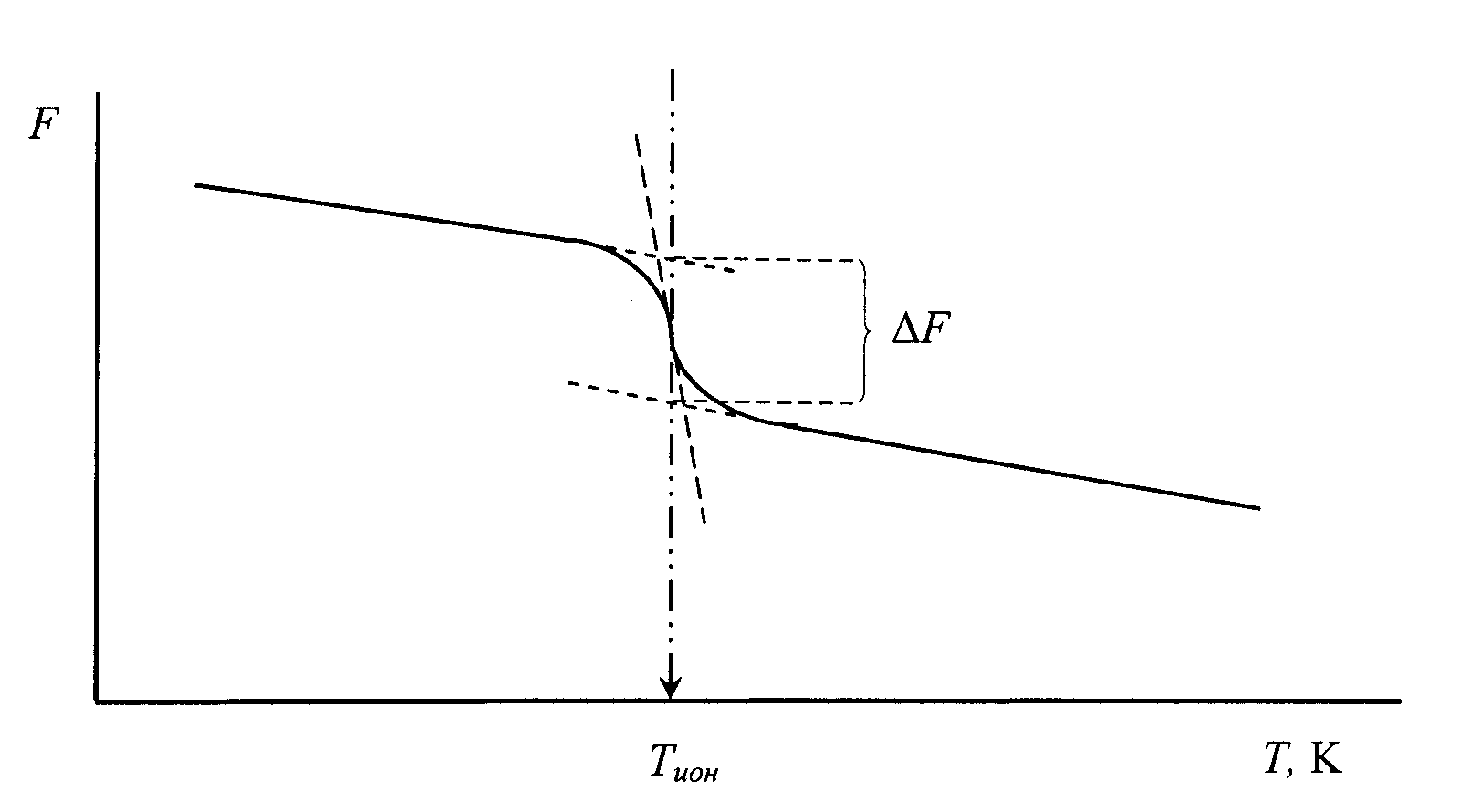
Здесь ω – угловая частота прилагаемого к образцу усилия, τ – время релаксации процесса, ответственного за поглощение механической энергии внутри образца. Сомножитель Δ определен отношением (F∞ - Fo)/F0, где F∞ модуль сдвига образца при бесконечно большой частоте (реально – при столь большой частоте, выше которой модуль сдвига уже практически не изменяется), и F0 – равновесный модуль сдвига, то есть модуль соответствующий частоте, меньше которой механическое воздействие с частотой ω поглощается. Отношение (F∞ - Fo)/F0 называется дефектом модуля. Эта величина наиболее просто находится из измерений модуля упругости по данным скорости распространения акустических колебаний (см. рис. 82). Условием максимума поглощения является равенство ω∙τ = 1.
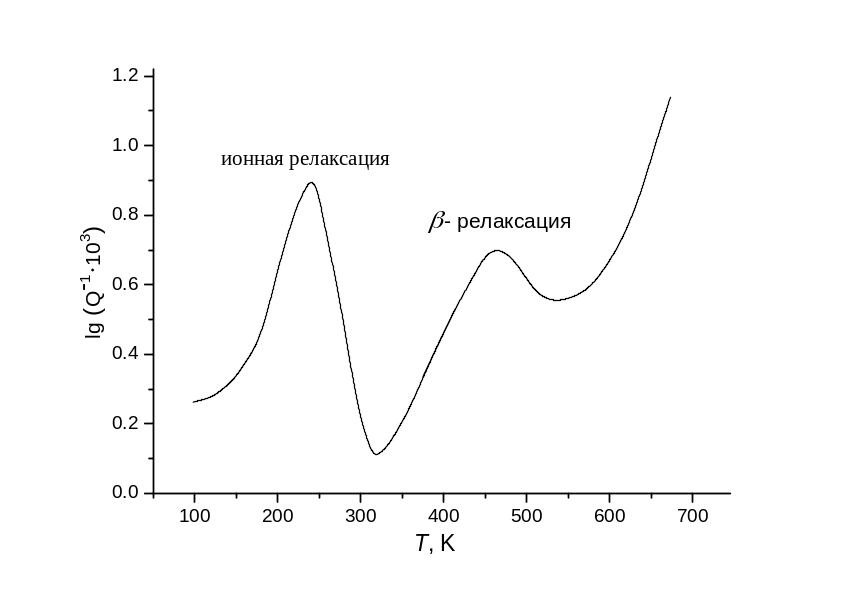
Типичная кривая температурных изменений Q-1 (ниже температуры стеклования) для щелочно-силикатного стекла при постоянной частоте воздействия ω = 2πf приведена на
рис. 83. Здесь видны два максимума. Максимум при низких температурах («щелочной») относят к поглощению на движении свободных щелочных ионов в структуре. При использовании частот f от 0.5 до 10 Гц он расположен в области ~250 – 300 К.
Второй максимум (β-релаксация) относят
к движению немостиковых атомов кислорода
в структурных единицах типа ≡Si–O![]() .
Такая интерпретация является общепринятой.
Однако атрибуция второго максимума в
стеклах более сложного состава (содержащих
помимо щелочного оксида также оксиды
щелочноземельных металлов или содержащих
одновременно два типа щелочных ионов)
может быть неоднозначной. Второй максимум
может искажаться (перекрываться) так
называемым «смешанным щелочным» пиком
или пиком, связанным с сопряженным
движением щелочного и щелочноземельного
катионов. Интерпретация деталей кривых
внутреннего трения в этих случаях до
сих пор остаётся весьма дискуссионной.
Далее мы будем рассматривать только
случаи, интерпретация которых не вызывает
сомнений.
.
Такая интерпретация является общепринятой.
Однако атрибуция второго максимума в
стеклах более сложного состава (содержащих
помимо щелочного оксида также оксиды
щелочноземельных металлов или содержащих
одновременно два типа щелочных ионов)
может быть неоднозначной. Второй максимум
может искажаться (перекрываться) так
называемым «смешанным щелочным» пиком
или пиком, связанным с сопряженным
движением щелочного и щелочноземельного
катионов. Интерпретация деталей кривых
внутреннего трения в этих случаях до
сих пор остаётся весьма дискуссионной.
Далее мы будем рассматривать только
случаи, интерпретация которых не вызывает
сомнений.
|
Рис. 82. Пояснение сущности возникновения дефекта модуля сдвига и положения максиму внутреннего терния на примере ионной релаксации.
|
|
Рис. 83. Максимумы внутреннего трения в стекле состава Na2O∙3SiO2; f = 0.4 Гц . |
Третий максимум, при температурах более высоких чем положение максимума β-релаксации, на рисунке отсутствует. Он соответствует структурной релаксации, которая обеспечивается механизмом вязкого течения (её называют α-релаксацией). В соответствии с уравнением Максвелла, упругое механическое воздействие в этом случае поглощается полностью и производит необратимую вязкую деформацию. Поэтому правая ветвь кривой, соответствующая спаданию поглощения (правее максимума) в таком эксперименте построена быть не может. Для нахождения положения максимума α-релаксации используют составные образцы в виде сэндвичей: на поверхность тугоплавкого материала (например, кварцевого стекла или сапфира) наносят слой изучаемого стекла. Тогда поглощение всего образца при α-релаксации изучаемого стекла не гасится полностью – остаётся фон от подложки и дефект модуля позволяет найти положение температуры максимума α-релаксации изучаемого стекла, аналогично графику рис. 82.
6.2 Расчёт температур максимума α-релаксации на основании уравнения Максвелла
Уравнение Максвелла имеет вид
F∞· τM = η.
Мгновенный модуль сдвига F∞, получаемый при 298 K, может отличаться от модуля сдвига F∞, соответствующего Tg , лишь незначительно (не боле 3-5 %), поскольку температурный коэффициент модуля ниже температуры стеклования очень мал. Время релаксации Максвелла τM является критерием перехода в твердоподобное состояние (в стекло). Условие ν∙τM =1, где ν = частота внешнего воздействия на систему, позволяет найти коэффициент ньютоновской вязкости, который соответствует Tα. Поэтому мы в состоянии найти Tα, основываясь на частоте f и значении модуля при комнатной температуре F∞, если известна экспериментальная зависимость logη от температуры. Таблица подтверждает правильность таких расчётов. Отношение рассчитанных Tα к измеренным составляет 1.0080.016.
Таблица. Сопоставление значений Tα, рассчитанных по уравнению Максвелла и экспериментально найденных по изучению внутреннего трения.
Состав стекла |
f , Гц
|
F∞, ГПа , 298 K |
log(η, Па∙с) |
Tα, К |
|
Раcсчитано |
Эксперимент |
||||
SiO2*) |
0.8 |
31.5 |
10.59 |
155315 |
1511 |
Оконное стекло**) |
1 |
27.4 |
10.44 |
8665 |
876 |
Оконное стекло**) |
1 |
27.4 |
10.44 |
8665 |
861 |
Оконное стекло**) |
0.005 |
27.4 |
12.74 |
8145 |
805 |
25Na2O∙75SiO2 |
0.3 |
24.2 |
10.91 |
7606 |
770 |
25Na2O∙75SiO2 |
1 |
24.2 |
10.38 |
7736 |
783 |
33Na2O∙67SiO2 |
5) |
24.5 |
9.69 |
7659 |
757 |
20K2O∙80SiO2 |
0.3 |
19.8 |
10.81 |
7997 |
776 |
20K2O∙80SiO2 |
1 |
19.8 |
10.29 |
8137 |
792 |
*) Получено плавлением природного бразильского кварца в кислородно-водородном пламени. Вязкость соответствует именно такому способу получения стекла.
**)14.76Na2O;0.45K2O;6.7CaO;4.14MgO;1.84Al2O3;71.54SiO2; 0.11Fe2O3;0.46SO3 (мол..%, по анализу).
6.3 Релаксационные процессы β-типа, их природа и значение
Как упоминалось, этот максимум соответствует движению немостиковых атомов кислорода. К сожалению, о его природе более ничего не известно, поэтому использовать уравнение Максвелла для расчёта температур его положения сегодня нельзя.
Однако в разделе «Физическое старение стекла при комнатной температуре» упоминалось, что частоты релаксации, соответствующие различным каналам релаксационного процесса старения, соответствуют именно этому виду релаксации.
Если общее выражение для времени релаксации для набора каналов старения записывается как
lgτi = γi×T13.5 + b,
то для каждого канала по значениям γi можно рассчитать величины свободных энергий активации ∆Gi≠ для каждого канала. Поскольку универсальное значение слагаемого b соответствует классическому значению предэкспоненциального сомножителя в уравнении для частоты релаксации (lg(τi-1) = 13 при выражении времени в с), то
для каждого канала по уравнению
lg(τi-1) = 13 − ∆Gi≠/2.3RTi
можно рассчитать значение температуры Ti, при которой эта частота (τi-1) будет соответствовать частоте f.
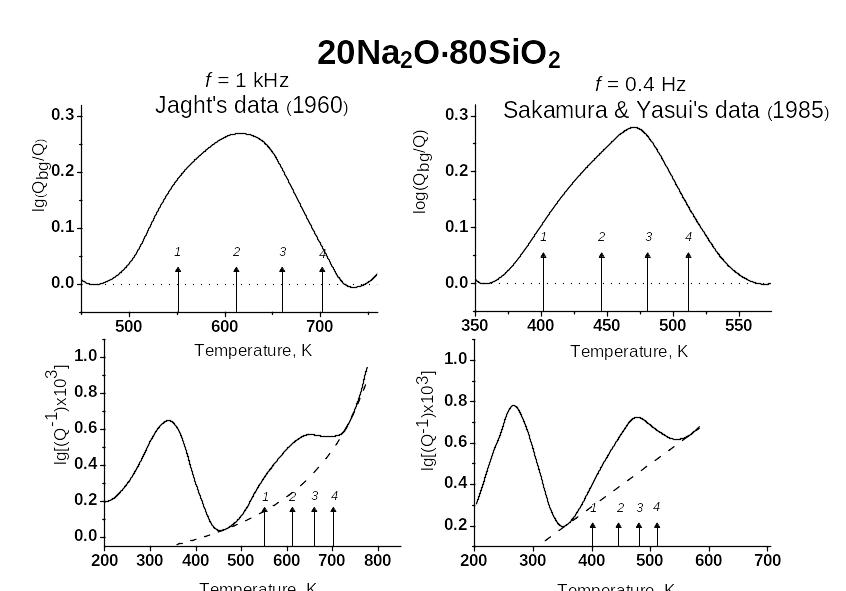
Оказывается, что эти температуры точно вписываются в максимум внутреннего трения, соответствующий β-релаксации (пример – на рис. 84).
|
Рис. 84. Положение температур, соответствующих релаксационным каналам старения (с 1 по 4) для стекла 20 Na2O∙80SiO2 при двух частотах по данным разных авторов. В нижней части рисунков показана общая картина внутреннего трения , включающая (слева) «ионный» максимум. (S.V.Nemilov, Glass Sci. and Technol. v.78, No 6, 269-278, 2005). |
Таким образом, предположение что старение стекол при комнатной температуре обусловлено небольшими смещениями немостиковых атомов кислорода, совершенно оправдано.
6.4 Ионный максимум и связь внутреннего трения с проводимостью на
основании теории Максвелла
Ионный максимум, находящийся в области ~230 - 450 К (в зависимости от частоты эксперимента), изначально связывали со смещениями ионов, ответственных за ионную проводимость при постоянном напряжении. Основанием было совпадение энергий активации проводимости и энергии активации внутреннего трения, если энергии активации последнего вида релаксации рассчитывать на основании обычной аррениусовской зависимости как коэффициент ΔE
f = f0 ∙exp( - ΔE/RT).
Доказательство справедливости этого отождествления с привлечением теории Максвелла было недавно дано С.В. Немиловым (Journ. Non-Cryst. Solids, 2011, V. 357, № 4, p. 1243-1263 2011; Фиика. и химия стекла, 2012, т. 38, № 1, с. 39-57; Glass Phys. and Chem. 2012, vol.38 No1, pp. 27-40)64.