
- •Специальные разделы оптического материаловедения
- •Термодинамика фазовых равновесий
- •1.1 Общие сведения о термодинамике
- •1 Предмет термодинамики1
- •1.1.2 Термодинамическая система, виды систем
- •Изолированные системы – те, которые не имеют возможности обмениваться веществом и энергией с окружением и имеющие постоянный объем.
- •1.1.3 Параметры состояния, параметры процессов
- •1.1.4 Функции состояния
- •1.1.5 Виды процессов
- •1.1.6 Внутренняя энергия, теплота и работа
- •1.1.7 Максимальная работа при изобарических, изотермических, адиабатических и изохорных процессах
- •1.2 Законы термодинамики
- •1.2.2 II закон термодинамики и энтропия как термодинамическая функция
- •1.2.3 Энтропия и термодинамическая вероятность. III закон термодинамики
- •Следствия Законов
- •1.2.5 Термодинамические функции, важные для материаловедения.
- •1.2.6 Применение термодинамических понятий в других областях науки
- •1.3 Производные термодинамических потенциалов и фазовые переходы
- •1.3.1 Первые производные термодинамических потенциалов, их физический
- •1.3.2 Вторые производные термодинамических потенциалов (соотношения
- •1.3.3 Фазовые переходы I и II рода.
- •1.3.4 Фазовые переходы I рода. Барическая зависимость фазовых переходов I рода:
- •1.4 Теория фазовых равновесий
- •1.4.1 Понятия «фазовые равновесия», «компонент», «диаграмма состояний»,
- •1.4.2 Понятие химического потенциала. Условия равновесия фаз. Правило фаз
- •1.4.3 Диаграмма состояний однокомпонентной системы
- •1.4.5 Эвтектики (двухкомпонентные системы). Линии ликвидуса и солидуса.
- •1.4.6 Твердые растворы (двухкомпонентные системы). Значение твердых
- •1.4.7 Ограниченные твердые растворы
- •1.4.8 Упорядочение твердых растворов
- •1.4.9 Полная несмешиваемость в жидком и в твердом состояниях
- •1.4.10 Системы с расслаиванием в жидком состоянии. Стабильное и
- •1.4.11 Системы с образованием химических соединений (двухкомпонентные
- •1.4.12 Системы с образованием химических соединений (двухкомпонентные
- •1.4.13 Трёхкомпонентные системы (принципы изображения,
- •1.4.14 Комбинация элементов диаграмм состояний. Физико-химический анализ.
- •2. Фазовые переходы и кинетическая теория стеклования
- •2.1 Стеклование
- •2.1.1 Принципиальная особенность фазовых переходов I и II рода в общей
- •2.1.2 Природа взаимодействия в конденсированных системах (общие
- •Ионное взаимодействие
- •Взаимодействие в металлах
- •Ковалентное взаимодействие
- •Водородные связи
- •Взаимодействие Ван-дер-Ваальса
- •Энергия химических связей
- •2.1.3 Основные особенности строения жидкостей и принцип их обобщенного
- •2.1.4 Общие сведения о релаксационных процессах как о процессах перехода от
- •2.1.5 Равновесные и мгновенные свойства жидкостей
- •2.1.6 Переохлажденные жидкости как частный случай метастабильного
- •2.1.7 Проявление стеклования на свойствах жидкостей
- •2.1.8 Определение стеклообразного состояния как лабильного (абсолютно
- •2.1.9 Математическое описание стеклования в кинетической теории. Твердо- и
- •2.1.10 Время релаксации структуры и его зависимость от температуры.
- •2.1.11 Соотношение температур стеклования и плавления (правило «2/3»
- •2.2 Кристаллизация расплавов стекол
- •2.2.1 Термодинамические особенности метастабильной жидкости
- •2.2.2 Работа образования зародыша кристаллизации20
- •2.2.3 Кривые Таммана а) скорость зарождения и кривая зарождения.
- •Б) скорость роста и кривая роста.
- •2.2.4 Методы изучения кристаллизационной способности и её
- •А) политермический метод и диаграммы кристаллизационной способности
- •Б) фазовый состав и морфология кристаллов.
- •В) дифференциальный термический анализ.
- •Г) скорость кристаллизации
- •2.2.5 Типы кристаллизации
- •2.2.6 Катализированная кристаллизация; ситаллы
- •2.2.7 Связь кристаллизационной способности с диаграммой состояния
- •3.Термодинамика стеклообразного состояния
- •3.1.1 Термодинамические переменные, используемые при математическом
- •3.1.2 Математическое описание избыточной свободной энергии лабильной
- •3.1.3 Математическое условие стеклования, налагаемое на изменения
- •3.1.4 Соотношение Пригожина-Дефея и его экспериментальная проверка
- •3.1.5 Термодинамический инвариант стеклообразного состояния
- •3.1.6 Следствия, вытекающие из соотношений термодинамики
- •5. Релаксационные процессы в стеклообразном состоянии. Ионная проводимость и ионный обмен
- •5.1.1 Зависимость температуры стеклования от скорости охлаждения
- •5.1.2 Процессы и законы релаксационных изменений свойств, структурная
- •5.1.3 Оценка времени достижения равновесного состояния в процессе отжига
- •5.1.4 Физическое старение стекла при комнатной температуре52
- •5.1.5 Релаксационные явления при переходе через температуру стеклования
- •5.1.6 «Кроссовер эффект»
- •5.1.7 Расчёт изменения свойств при отжиге стекол на основании
- •5.2 Природа ионной проводимости и диффузии в стеклах.
- •5.2.1 Структура стекла и основы механизма
- •5.2.2 Законы диффузии и соотношение Нернста – Эйнштейна
- •5.2.3 Основное статистическое уравнение проводимости. Энергия активации.
- •5.2.4 Общие корреляции, ряд подвижностей
- •5.2.5 Основные закономерности электропроводности, определяемые составом
- •5.2.6 Ионообменные процессы и проблемы современной оптической технологии
- •5.2.7 Ионообменные процессы с растворами. Стеклянный электрод.
- •6. Взаимосвязь между основными видами релаксационных процессов в стеклах
- •6.4.1 Соотношение Максвелла для проводимости диэлектриков
- •6.4.2 Соотношение Максвелла для проводимости диэлектриков как основа связи
- •6.4.3 Экспериментальная проверка возможности расчёта температуры «ионного» максимума внутреннего трения по данным проводимости
- •7. Основные принципы химической устойчивости стекол
- •7.1.1 Практическая значимость свойства и его физико-химическое
- •7.1.2 Методы испытания и классификация стекол по группам
- •Группы химической устойчивости бесцветного оптического стекла к действию кислоты и дистиллированной воды
- •Группы химической устойчивости бесцветного оптического стекла к действию влажной атмосферы
- •7.1.3 Влияние компонентов состава стекла на химическую устойчивость
- •7.1.4 Способы защиты оптических деталей от химического разрушения
- •8. Специфика некоторых структурных явлений в регистрирующих средах
- •8.1. Фотоструктурные изменения в халькогенидных стеклах, их существо и
- •8.2 Структурно-фазовые изменения в жидких кристаллах и физико-химическая
- •8.2.1 Общие представления о жидких кристаллах
- •8.2.2 Специфика изменения электрических и магнитных свойств при
5.2.6 Ионообменные процессы и проблемы современной оптической технологии
Принцип формирования профиля показателя преломления в элементах градиентной оптики62
Элементы градиентной оптики (граданы) представляют собой оптические детали, в которых существует градиент показателя преломления, созданный искусственным путём за счет наведения градиента концентрации. Например, если стекло, в состав которого входит оксид щелочного металла, поместить в контакт с расплавом соли, содержащим другие ионы того же заряда, то между стеклом и расплавом начнет происходить обмен ионами. Ионы из стекла будут переходить в расплав (их там нет и существует движущая сила процесса – разность химических потенциалов) и из расплава ионы будут входить в стекло, замещая вышедшие ионы:
Na+(стекло) + KNO3 (расплав) ↔ K+ (стекло) + NaNO3 (расплав).
Распространение чужеродного иона в стекле от поверхности вглубь определяется процессами диффузии. Возникающее распределение концентрации будет постепенным – на поверхности замещение максимальное. Состав поверхностного слоя и концентрация входящего иона на поверхности, задаваемая составом соляного расплава, определяет его диффузию иона внутрь образца. При этом ионы, находящиеся в объеме и выходящие на поверхность, будут обмениваться местами с ионами, входящими в объем (диффузантами), этот процесс характеризуется коэффициентом взаимодиффузии. Процесс взаимодиффузии отличается от процесса самодиффузии, при котором ион входит в стекло с поверхности, но встречного потока нет.
Для выбора состава стекла, состава соляного расплава и параметров технологического режима (температуры, времени), необходимых для достижения требуемого профиля показателя преломления, нужно знать природу таких процессов и уметь математически моделировать результат всей процедуры. При этом важны многие обстоятельства, о которых мы здесь только упомянем, поскольку вся проблема могла бы составить предмет специального курса.
-
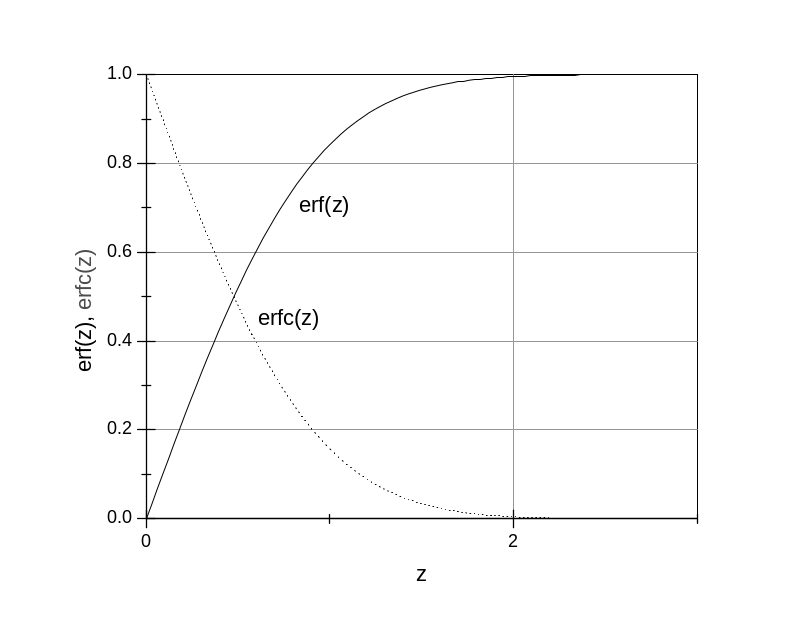
Рис. 78. Функции erf(z) и erfc (z), используемые
при программировании изменения свойств
в процессе ионного обмена.
Следует помнить, что линейная связь показателя преломления и концентрации существует не всегда. Это – некоторый идеальный случай. Знание реального концентрационного профиля при ионном обмене первостепенно по своей важности.
Наиболее прост идеальный - линейный - случай, когда коэффициент диффузии не зависит от концентрации диффузанта. Практически он никогда не реализуется. В этом случае профиль концентрации при диффузии в полубесконечную пластину должен соответствовать erfc- фунцкии от аргумента
z = x(4Dt)-1/2,
где х – координата, t –
время, D – коэффициент
диффузии. Сама erfc(z) = 1 – erf(z),
где erf(z)
=
![]()
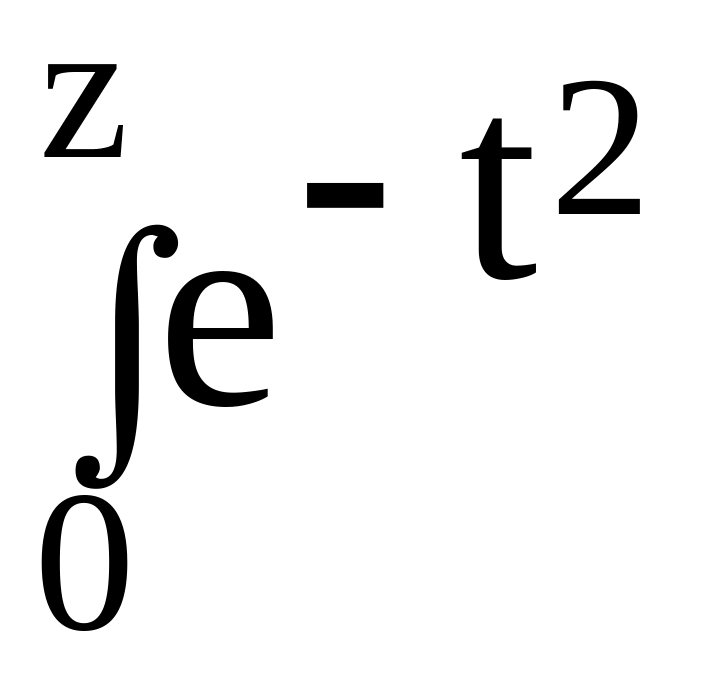 dt
есть функция Лапласа (функция ошибок).
Она табулирована и ее значения (меняющиеся
плавно) можно найти в математических
справочниках. Изменение этих функций
от z показано на рис. 78.
Здесь нужно заметить, что использование
приведенных выше функций имеет совершенно
ясный смысл в описании возникновения
профиля показателя преломления, поскольку
законы Фика определяют коэффициент
диффузии как характеристику
распределения именно концентрации в
образце. Важно только, постоянен ли
коэффициент диффузии в зависимости
от концентрации.
dt
есть функция Лапласа (функция ошибок).
Она табулирована и ее значения (меняющиеся
плавно) можно найти в математических
справочниках. Изменение этих функций
от z показано на рис. 78.
Здесь нужно заметить, что использование
приведенных выше функций имеет совершенно
ясный смысл в описании возникновения
профиля показателя преломления, поскольку
законы Фика определяют коэффициент
диффузии как характеристику
распределения именно концентрации в
образце. Важно только, постоянен ли
коэффициент диффузии в зависимости
от концентрации.
Особенности ионообменных процессов между стеклами и расплавами солей
В реальных случаях коэффициент диффузии всегда зависти от концентрации.
Показатель преломления уменьшается от поверхности вглубь образца, если диффундирует катион, сообщающий стеклу больший показатель преломления, чем показатель исходного стекла. Профиль показателя преломления, если он не очень глубок (<150 мкм) экспериментально устанавливается по результатам измерения модовых спектров плоских оптических волноводов, полученных для каждого стекла заданного состава в результате ионного обмена.
-
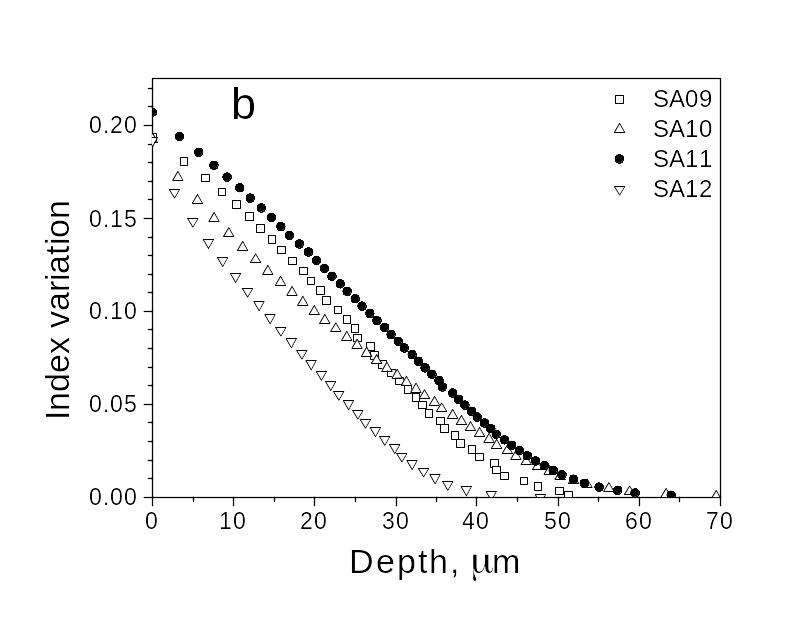
Рис. 79. Изменение показателя преломления от глубины
проникновения диффузанта с поверхности.
Эксперимент для образцов, отличающихся составом.
На рис.79 показан пример распределения показателя преломления (для длины волны λ = 0.63 мкм) по глубине (от поверхности вглубь) для нескольких близких составов стекол (диффузант – ион Ag+).
Для глубоких профилей используются интерферометрические или рефрактометрические методы.
Соответствующий этим профилям показателя профиль коэффициента диффузии D поучается математической обработкой с применением поясненных выше функций.
-
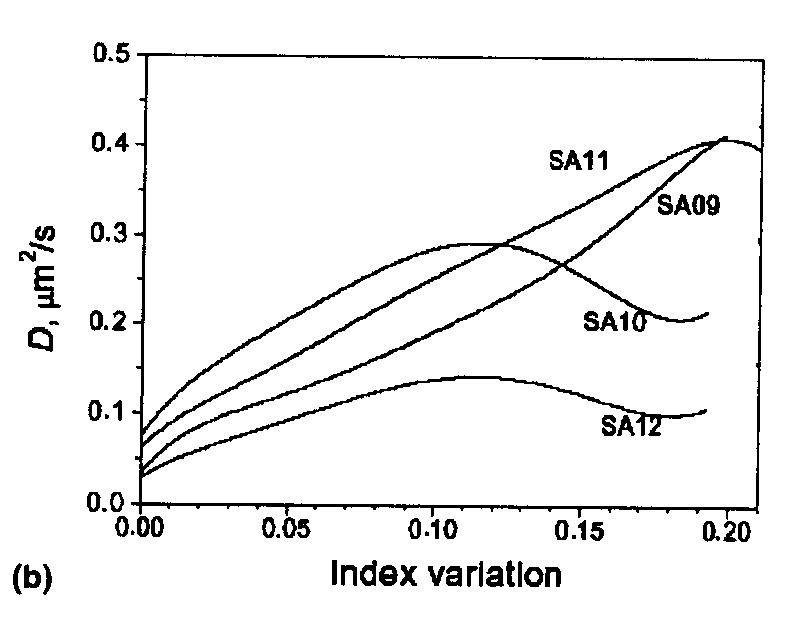
Рис. 80. Изменение рассчитанного эффективного коэффициента
диффузии от показателя преломления в профиле
показателя, представленного на рис.79.
При этом полагается, что закон Фика справедлив, но коэффициент диффузии непостоянен. Эти результаты приведены на рис. 80.
Естественно, что от поверхности «вглубь» образца изменяется концентрация диффузанта и коэффициент диффузии меняется с этой концентрацией. Одна из причин зависимости D от концентрации (которая существует всегда) может быть пояснена строгим рассмотрением совокупности противоположно направленных ионных потоков от поверхности «внутрь» образца и «изнутри» к поверхности. Это рассмотрение основано на принципах неравновесной термодинамики (используется соотношение Онзагера).
Если концентрации ионов сортов А и В обозначены как с1 и с2 соответственно и с1 + с2 = 1, то коэффициент взаимодиффузии D определен уравнением
D =
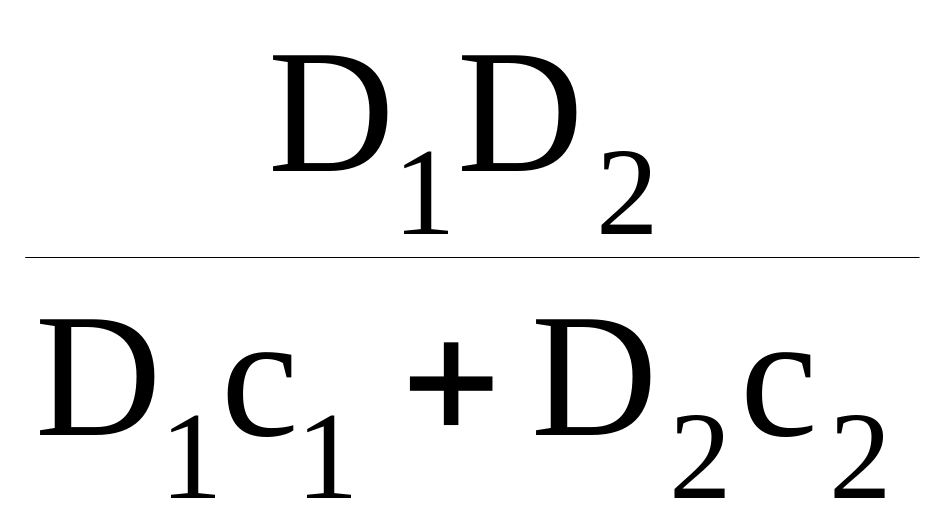
Таким образом, зависимость D от коэффициентов самодиффузии ионов D1 и D2 изначально предопределяет нелинейную зависимость D от концентрации.
Другие причины появления нелинейности состоят в том, что при ионном обмене могут возникать внутренние напряжения из-за того, что «новый» ион входит в структуру стекла, не соответствующую размеру этого иона. Сами напряжения существенно влияют на коэффициент диффузии и на функцию распределения концентрации. Напряжения изменяют как рефракцию иона, так и рефракцию атомов кислорода в его окружении. Возможность «подстраивания» структуры к диффундирующему иону характеризуется отношением
Ф = τd/τα,
где τd - характеристическое время диффузии, а τα– характеристическое время релаксации структуры. Математический анализ показывает, что закон Фика работает либо при Ф < 0.001, либо при Ф > 100 000. Это соответствует температурам ионного обмена либо ниже, либо выше Тg примерно на 200 – 300 К.
Выбор температуры ионного обмена очень важен прежде всего для создания абсолютной величины перепада показателя. Если ионы Ag+ в принципе (как одни из самых поляризуемых) способны создавать очень высокий прирост показателя, то условия проведения ионного обмена при Т < Тg позволяют достичь значений прироста показателя около 0.2. Это очень высокие значения, не реализуемые в других условиях.
Профиль концентрации и функция градана как элемента оптической системы зависят также от формы первоначального образца, подвергаемого ионному обмену (пластина, цилиндр, шар). Например, градан в виде пластины может заменить цилиндрическую линзу, градан в виде цилиндра может заменить сферическую линзу и т.д. Все эти случаи исследовались теоретически и экспериментально. В настоящее время найдены математические методы расчета, позволяющие получать заданный профиль показателя преломления соответственно предполагаемому использованию получаемой оптической детали.
При проникновении из расплава внутрь цилиндрического образца иона с высокой поляризуемостью возникает «отрицательная» линза. Её можно перевести в «положительную» линзу, если образец, полностью проработанный до середины, вновь поместить в соляной расплав с ионом низкой поляризуемости. Такие «ванны» можно менять по нескольку раз для достижения нужного профиля показателя.
При всей сложности проблемы для получения образца с заданными оптическими характеристиками все технологические параметры процесса ионного обмена рассчитываются математически с необходимой точностью с использованием компьютерной техники.
Размер деталей градиентной оптики может быть практически любым, минимальные диаметры линз имеют порядок 0.1 см.
При обработке стекла кислотой или водными растворами щелочные ионы замещаются на протоны (Н+). Однако для практических целей такие процессы большого интереса не представляют.
