- •Специальные разделы оптического материаловедения
- •Термодинамика фазовых равновесий
- •1.1 Общие сведения о термодинамике
- •1 Предмет термодинамики1
- •1.1.2 Термодинамическая система, виды систем
- •Изолированные системы – те, которые не имеют возможности обмениваться веществом и энергией с окружением и имеющие постоянный объем.
- •1.1.3 Параметры состояния, параметры процессов
- •1.1.4 Функции состояния
- •1.1.5 Виды процессов
- •1.1.6 Внутренняя энергия, теплота и работа
- •1.1.7 Максимальная работа при изобарических, изотермических, адиабатических и изохорных процессах
- •1.2 Законы термодинамики
- •1.2.2 II закон термодинамики и энтропия как термодинамическая функция
- •1.2.3 Энтропия и термодинамическая вероятность. III закон термодинамики
- •Следствия Законов
- •1.2.5 Термодинамические функции, важные для материаловедения.
- •1.2.6 Применение термодинамических понятий в других областях науки
- •1.3 Производные термодинамических потенциалов и фазовые переходы
- •1.3.1 Первые производные термодинамических потенциалов, их физический
- •1.3.2 Вторые производные термодинамических потенциалов (соотношения
- •1.3.3 Фазовые переходы I и II рода.
- •1.3.4 Фазовые переходы I рода. Барическая зависимость фазовых переходов I рода:
- •1.4 Теория фазовых равновесий
- •1.4.1 Понятия «фазовые равновесия», «компонент», «диаграмма состояний»,
- •1.4.2 Понятие химического потенциала. Условия равновесия фаз. Правило фаз
- •1.4.3 Диаграмма состояний однокомпонентной системы
- •1.4.5 Эвтектики (двухкомпонентные системы). Линии ликвидуса и солидуса.
- •1.4.6 Твердые растворы (двухкомпонентные системы). Значение твердых
- •1.4.7 Ограниченные твердые растворы
- •1.4.8 Упорядочение твердых растворов
- •1.4.9 Полная несмешиваемость в жидком и в твердом состояниях
- •1.4.10 Системы с расслаиванием в жидком состоянии. Стабильное и
- •1.4.11 Системы с образованием химических соединений (двухкомпонентные
- •1.4.12 Системы с образованием химических соединений (двухкомпонентные
- •1.4.13 Трёхкомпонентные системы (принципы изображения,
- •1.4.14 Комбинация элементов диаграмм состояний. Физико-химический анализ.
- •2. Фазовые переходы и кинетическая теория стеклования
- •2.1 Стеклование
- •2.1.1 Принципиальная особенность фазовых переходов I и II рода в общей
- •2.1.2 Природа взаимодействия в конденсированных системах (общие
- •Ионное взаимодействие
- •Взаимодействие в металлах
- •Ковалентное взаимодействие
- •Водородные связи
- •Взаимодействие Ван-дер-Ваальса
- •Энергия химических связей
- •2.1.3 Основные особенности строения жидкостей и принцип их обобщенного
- •2.1.4 Общие сведения о релаксационных процессах как о процессах перехода от
- •2.1.5 Равновесные и мгновенные свойства жидкостей
- •2.1.6 Переохлажденные жидкости как частный случай метастабильного
- •2.1.7 Проявление стеклования на свойствах жидкостей
- •2.1.8 Определение стеклообразного состояния как лабильного (абсолютно
- •2.1.9 Математическое описание стеклования в кинетической теории. Твердо- и
- •2.1.10 Время релаксации структуры и его зависимость от температуры.
- •2.1.11 Соотношение температур стеклования и плавления (правило «2/3»
- •2.2 Кристаллизация расплавов стекол
- •2.2.1 Термодинамические особенности метастабильной жидкости
- •2.2.2 Работа образования зародыша кристаллизации20
- •2.2.3 Кривые Таммана а) скорость зарождения и кривая зарождения.
- •Б) скорость роста и кривая роста.
- •2.2.4 Методы изучения кристаллизационной способности и её
- •А) политермический метод и диаграммы кристаллизационной способности
- •Б) фазовый состав и морфология кристаллов.
- •В) дифференциальный термический анализ.
- •Г) скорость кристаллизации
- •2.2.5 Типы кристаллизации
- •2.2.6 Катализированная кристаллизация; ситаллы
- •2.2.7 Связь кристаллизационной способности с диаграммой состояния
- •3.Термодинамика стеклообразного состояния
- •3.1.1 Термодинамические переменные, используемые при математическом
- •3.1.2 Математическое описание избыточной свободной энергии лабильной
- •3.1.3 Математическое условие стеклования, налагаемое на изменения
- •3.1.4 Соотношение Пригожина-Дефея и его экспериментальная проверка
- •3.1.5 Термодинамический инвариант стеклообразного состояния
- •3.1.6 Следствия, вытекающие из соотношений термодинамики
- •5. Релаксационные процессы в стеклообразном состоянии. Ионная проводимость и ионный обмен
- •5.1.1 Зависимость температуры стеклования от скорости охлаждения
- •5.1.2 Процессы и законы релаксационных изменений свойств, структурная
- •5.1.3 Оценка времени достижения равновесного состояния в процессе отжига
- •5.1.4 Физическое старение стекла при комнатной температуре52
- •5.1.5 Релаксационные явления при переходе через температуру стеклования
- •5.1.6 «Кроссовер эффект»
- •5.1.7 Расчёт изменения свойств при отжиге стекол на основании
- •5.2 Природа ионной проводимости и диффузии в стеклах.
- •5.2.1 Структура стекла и основы механизма
- •5.2.2 Законы диффузии и соотношение Нернста – Эйнштейна
- •5.2.3 Основное статистическое уравнение проводимости. Энергия активации.
- •5.2.4 Общие корреляции, ряд подвижностей
- •5.2.5 Основные закономерности электропроводности, определяемые составом
- •5.2.6 Ионообменные процессы и проблемы современной оптической технологии
- •5.2.7 Ионообменные процессы с растворами. Стеклянный электрод.
- •6. Взаимосвязь между основными видами релаксационных процессов в стеклах
- •6.4.1 Соотношение Максвелла для проводимости диэлектриков
- •6.4.2 Соотношение Максвелла для проводимости диэлектриков как основа связи
- •6.4.3 Экспериментальная проверка возможности расчёта температуры «ионного» максимума внутреннего трения по данным проводимости
- •7. Основные принципы химической устойчивости стекол
- •7.1.1 Практическая значимость свойства и его физико-химическое
- •7.1.2 Методы испытания и классификация стекол по группам
- •Группы химической устойчивости бесцветного оптического стекла к действию кислоты и дистиллированной воды
- •Группы химической устойчивости бесцветного оптического стекла к действию влажной атмосферы
- •7.1.3 Влияние компонентов состава стекла на химическую устойчивость
- •7.1.4 Способы защиты оптических деталей от химического разрушения
- •8. Специфика некоторых структурных явлений в регистрирующих средах
- •8.1. Фотоструктурные изменения в халькогенидных стеклах, их существо и
- •8.2 Структурно-фазовые изменения в жидких кристаллах и физико-химическая
- •8.2.1 Общие представления о жидких кристаллах
- •8.2.2 Специфика изменения электрических и магнитных свойств при
2.1.7 Проявление стеклования на свойствах жидкостей
В процессе охлаждения жидкости параметры, описывающие её состояние (например, объем V, теплосодержание H), изменяются непрерывно и плавно, поскольку структура жидкости успевает подстроиться под изменение температуры и для каждого её значения свойство равновесно. В этом случае обобщенный структурный параметр ξ записывается только как функция температуры и давления как ξ = ξ(p,T). За время наблюдения структура всегда успевает подстраиваться к равновесной и время не является аргументом.
Однако, в силу того, что скорость изменения структуры непрерывно уменьшается при охлаждении, а ξ = ξ(p,T,t) в некоторый момент процесса охлаждения наступает такая температура, когда структура не успевает перейти в равновесное состояние. Поскольку все свойства жидкости и её параметры состояния определены структурой, закон изменения свойств от температуры после этого станет другим (структура замораживается). В этом случае зависимости температурных изменений свойств будут характеризоваться меньшим температурным коэффициентом - рис. 24 и 25.
Состояние жидкости с замороженной структурой было названо нами состоянием стекла.
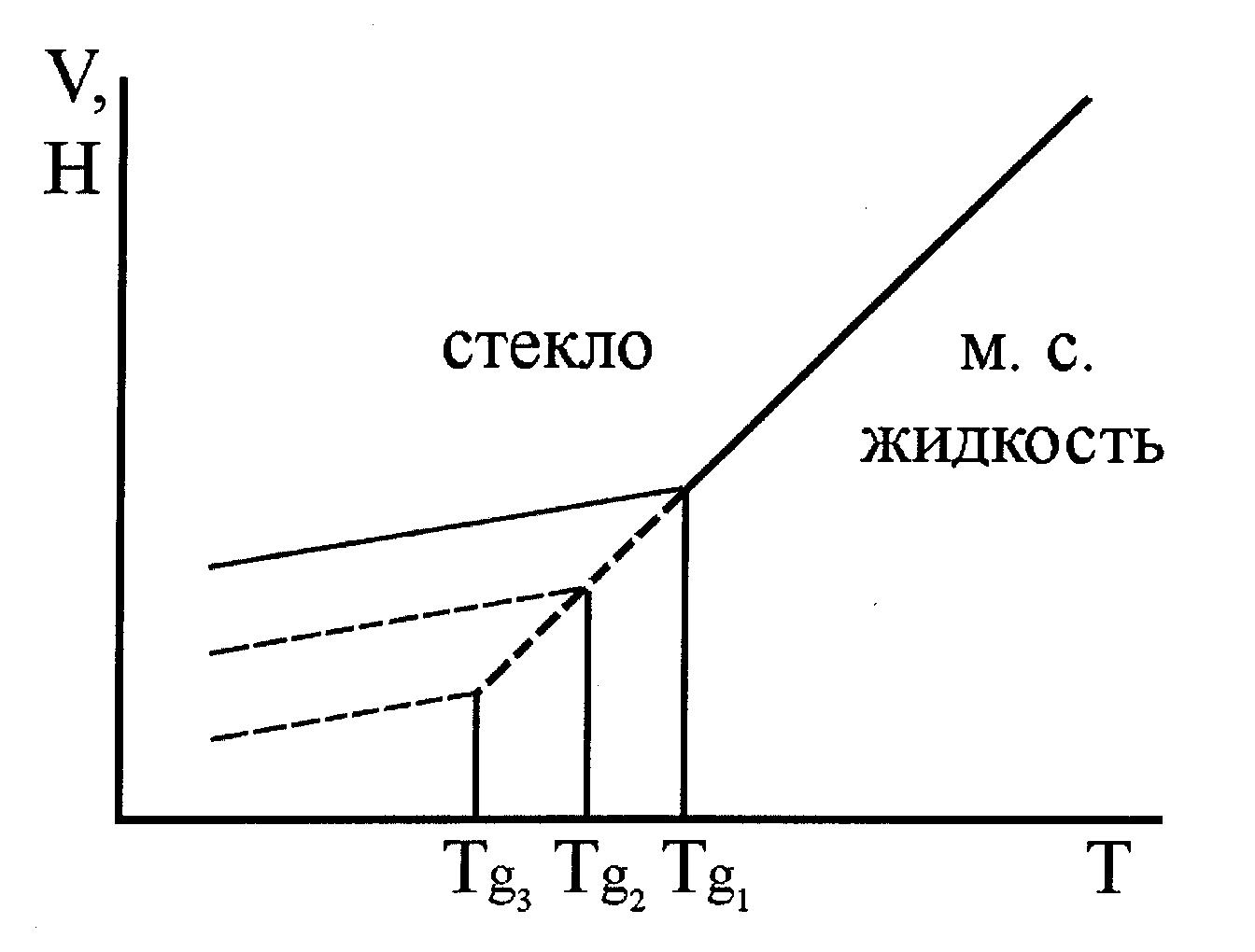
Температура стеклования Tg - это температура, соответствующая пересечению кривых свойств метастабильной (переохлажденной) жидкости и свойств состояния с замороженной структурой (стекла).
Величина Tg зависит от скорости охлаждения. При более медленном охлаждении Tg всегда становится ниже.
Температура, которая в процессе охлаждения в последний момент соответствовала равновесной структуре жидкости, называется структурной температурой стекла или фиктивной температурой Тула16. Обычно она обозначается как Tf, в процессе отжига Tf снижается. Для решения ряда вопросов можно принимать близость Tf и Tg.
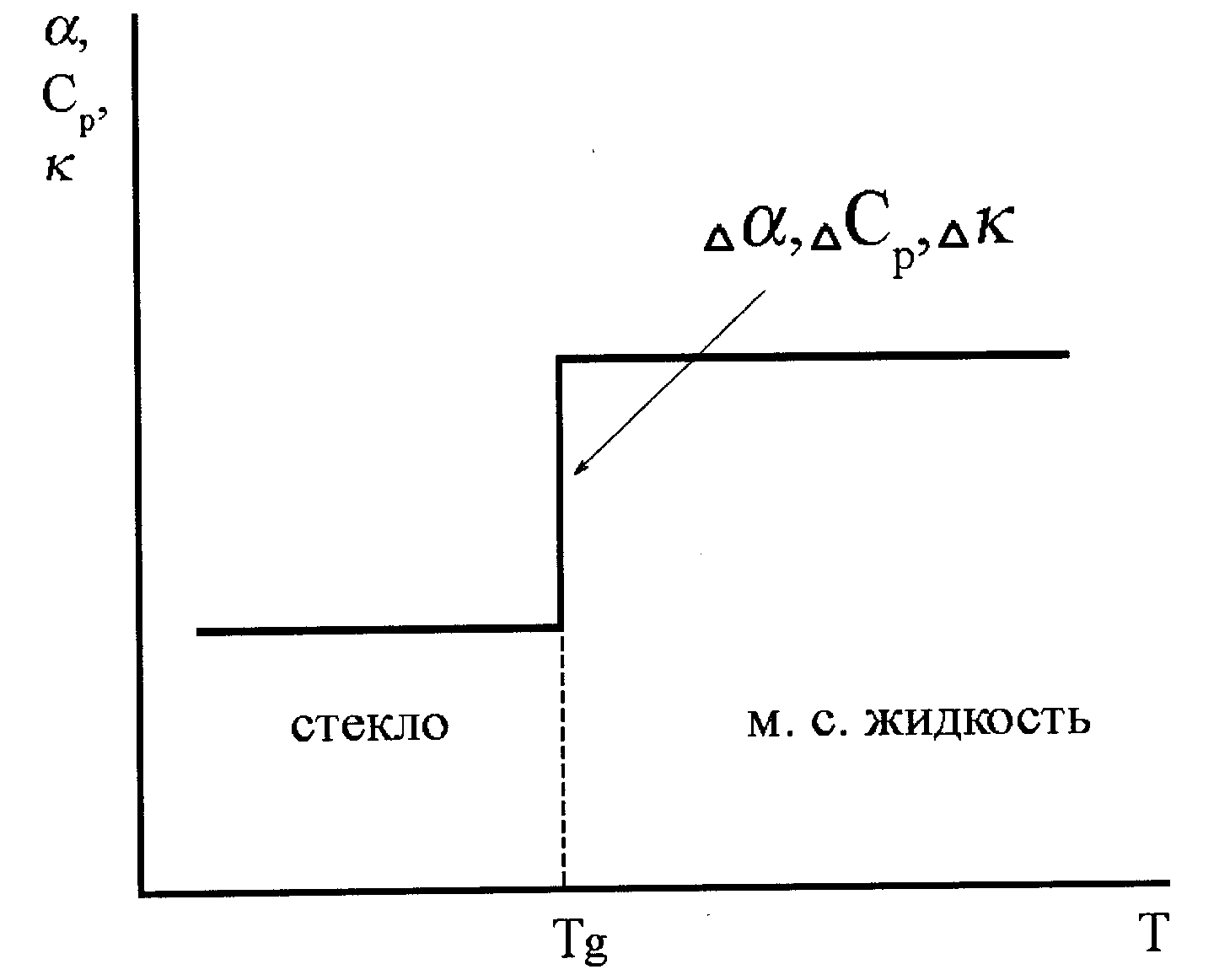
Все перечисленные признаки стеклования проявляются в виде скачков в изменении тех свойств, которые являются производными от перечисленных выше параметров. Так, коэффициент объемного термического расширения α = (1/V)∙(∂V/∂T)р, теплоемкость Cp = ∂H/∂T, сжимаемость κT = - (1/V)∙(∂V/∂p)Т при переходе через Tg изменяются скачком (см. рис.24 и 25). Однако, такая картина скачкообразного изменения свойств при стекловании идеализирована по нескольким причинам.
Отчасти из-за того, что всегда существует статистическое распределение времен релаксации около наиболее вероятного значения, перечисленные выше признаки Tg (изломы или скачки) размыты. Это справедливо для кривых, полученных в режиме охлаждения расплава, но не справедливо для кривых, полученных в режиме нагревания стекла при переходе к состоянию метастабильной жидкости. Причина последнего в том, что обратимый переход между этими двумя состояниями невозможен.
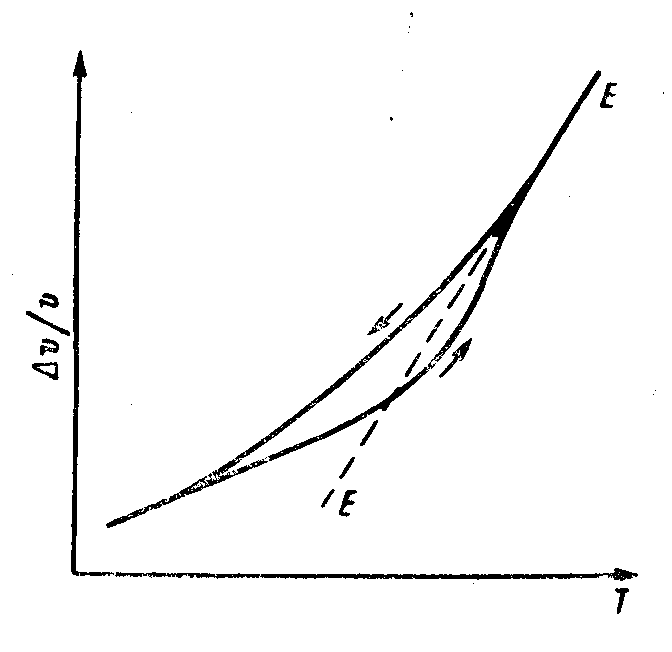
Из-за наличия спектров времён релаксации, их зависимости от значения фиктивной температуры, которая по мере протекания процессов всё время изменяется, появляются возможности продолжения релаксационного процесса при нагревании стекла в области чуть ниже температур стеклования. Объем и теплосодержание при этом уменьшаются. Поэтому реальные кривые, полученные при нагревании стекла значительно сложнее.
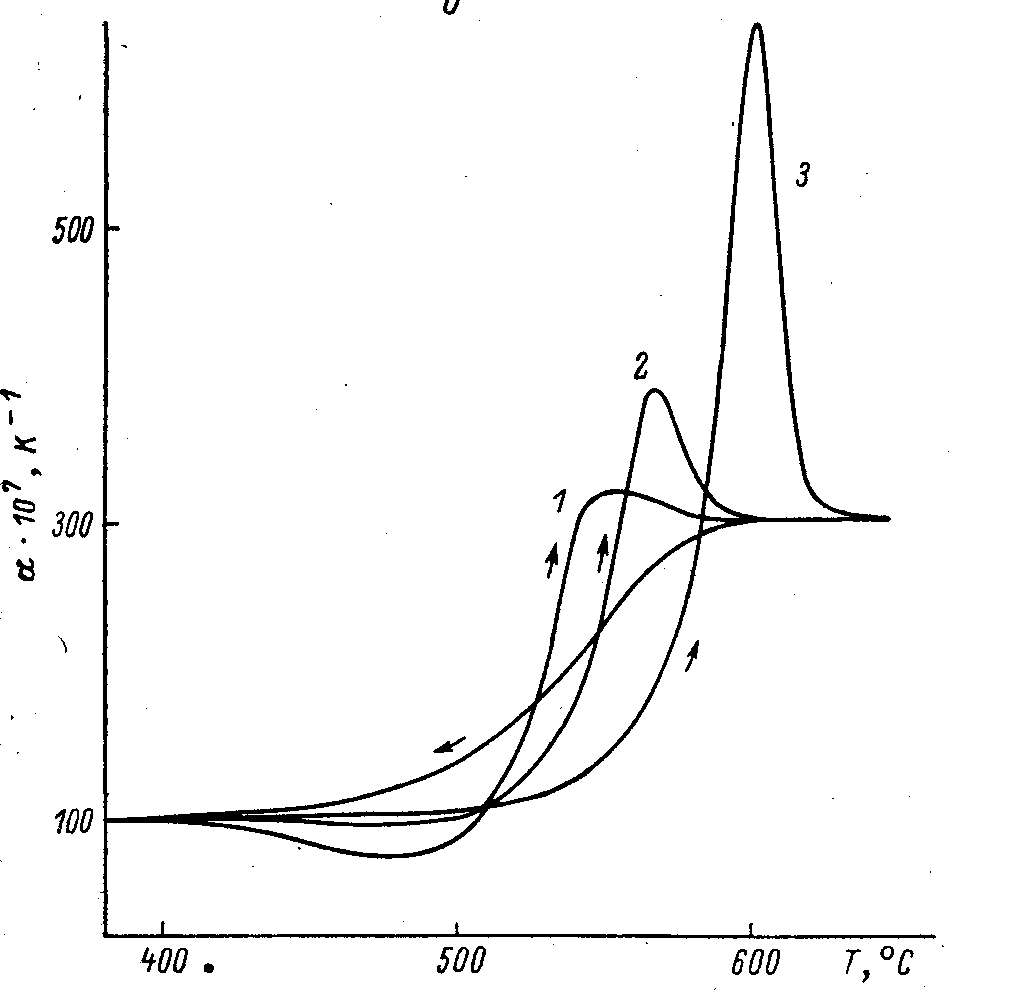
При нагревании образовавшегося стекла на кривых рис. 26 чуть ниже Tg измеренный ход кривой смещается вниз и на производной (величине свойства), рис 27, появляется небольшой минимум, а при Tg - небольшой максимум. Это связано исключительно с релаксационными процессами при повторном прохождении области стеклования «снизу» «вверх». Иногда эти явления называют «эффектами памяти».
Все описанные особенности изменения свойств рассчитываются количественно на основании кинетической теории стеклования. Точность расчётов зависит от принятых упрощений. Алгоритмы расчётов и более глубокое обсуждение проблемы можно найти в книге О.В.Мазурин «Стеклование», Л. Изд-во «Наука», 1986.
В технике за стандартное значение Tg принято то, которое получают при скорости охлаждения 3 К/мин. Ему примерно соответствует вязкость 1013.3 пуаз (П) или 12.5 Па∙с. Однако несущественные отклонения от указанной скорости (в разы, но не на порядки) изменяет эту величину вязкости непринципиально, поэтому чаще всего Tg сопоставляют вязкость 1013 П.
|
Рис. 24. Идеализированное изменение удельного объема жидкости или теплосодержания при стекловании. Последовательность температур стеклования Tg1 > Tg2 > Tg3 соответствует последовательности уменьшения скоростей охлаждения стеклообразующего расплава. |
|
Рис. 25. Идеализированное изменение коэффициента теплового расширения (α), теплоемкости (Ср) и сжимаемости (κ) при переходе через температуру стеклования. |
|
Рис. 26 Реальное изменение объема в области стеклования. ЕЕ΄- равновесная температурная зависимость объема (из книги М.М.Мазурин и М.М.Шульц Современные представления о строении стекол и их свойствах. Наука, Л. 1988. |
|
Рис. 27. Реальное изменение коэффициента термического расширения в области стеклования, если стекло получали при скорости охлаждении жидкости3К/мин, а нагревали со скоростями (К/мин) 0.15; 3 и 60. Ссылка та же. |