- •Специальные разделы оптического материаловедения
- •Термодинамика фазовых равновесий
- •1.1 Общие сведения о термодинамике
- •1 Предмет термодинамики1
- •1.1.2 Термодинамическая система, виды систем
- •Изолированные системы – те, которые не имеют возможности обмениваться веществом и энергией с окружением и имеющие постоянный объем.
- •1.1.3 Параметры состояния, параметры процессов
- •1.1.4 Функции состояния
- •1.1.5 Виды процессов
- •1.1.6 Внутренняя энергия, теплота и работа
- •1.1.7 Максимальная работа при изобарических, изотермических, адиабатических и изохорных процессах
- •1.2 Законы термодинамики
- •1.2.2 II закон термодинамики и энтропия как термодинамическая функция
- •1.2.3 Энтропия и термодинамическая вероятность. III закон термодинамики
- •Следствия Законов
- •1.2.5 Термодинамические функции, важные для материаловедения.
- •1.2.6 Применение термодинамических понятий в других областях науки
- •1.3 Производные термодинамических потенциалов и фазовые переходы
- •1.3.1 Первые производные термодинамических потенциалов, их физический
- •1.3.2 Вторые производные термодинамических потенциалов (соотношения
- •1.3.3 Фазовые переходы I и II рода.
- •1.3.4 Фазовые переходы I рода. Барическая зависимость фазовых переходов I рода:
- •1.4 Теория фазовых равновесий
- •1.4.1 Понятия «фазовые равновесия», «компонент», «диаграмма состояний»,
- •1.4.2 Понятие химического потенциала. Условия равновесия фаз. Правило фаз
- •1.4.3 Диаграмма состояний однокомпонентной системы
- •1.4.5 Эвтектики (двухкомпонентные системы). Линии ликвидуса и солидуса.
- •1.4.6 Твердые растворы (двухкомпонентные системы). Значение твердых
- •1.4.7 Ограниченные твердые растворы
- •1.4.8 Упорядочение твердых растворов
- •1.4.9 Полная несмешиваемость в жидком и в твердом состояниях
- •1.4.10 Системы с расслаиванием в жидком состоянии. Стабильное и
- •1.4.11 Системы с образованием химических соединений (двухкомпонентные
- •1.4.12 Системы с образованием химических соединений (двухкомпонентные
- •1.4.13 Трёхкомпонентные системы (принципы изображения,
- •1.4.14 Комбинация элементов диаграмм состояний. Физико-химический анализ.
- •2. Фазовые переходы и кинетическая теория стеклования
- •2.1 Стеклование
- •2.1.1 Принципиальная особенность фазовых переходов I и II рода в общей
- •2.1.2 Природа взаимодействия в конденсированных системах (общие
- •Ионное взаимодействие
- •Взаимодействие в металлах
- •Ковалентное взаимодействие
- •Водородные связи
- •Взаимодействие Ван-дер-Ваальса
- •Энергия химических связей
- •2.1.3 Основные особенности строения жидкостей и принцип их обобщенного
- •2.1.4 Общие сведения о релаксационных процессах как о процессах перехода от
- •2.1.5 Равновесные и мгновенные свойства жидкостей
- •2.1.6 Переохлажденные жидкости как частный случай метастабильного
- •2.1.7 Проявление стеклования на свойствах жидкостей
- •2.1.8 Определение стеклообразного состояния как лабильного (абсолютно
- •2.1.9 Математическое описание стеклования в кинетической теории. Твердо- и
- •2.1.10 Время релаксации структуры и его зависимость от температуры.
- •2.1.11 Соотношение температур стеклования и плавления (правило «2/3»
- •2.2 Кристаллизация расплавов стекол
- •2.2.1 Термодинамические особенности метастабильной жидкости
- •2.2.2 Работа образования зародыша кристаллизации20
- •2.2.3 Кривые Таммана а) скорость зарождения и кривая зарождения.
- •Б) скорость роста и кривая роста.
- •2.2.4 Методы изучения кристаллизационной способности и её
- •А) политермический метод и диаграммы кристаллизационной способности
- •Б) фазовый состав и морфология кристаллов.
- •В) дифференциальный термический анализ.
- •Г) скорость кристаллизации
- •2.2.5 Типы кристаллизации
- •2.2.6 Катализированная кристаллизация; ситаллы
- •2.2.7 Связь кристаллизационной способности с диаграммой состояния
- •3.Термодинамика стеклообразного состояния
- •3.1.1 Термодинамические переменные, используемые при математическом
- •3.1.2 Математическое описание избыточной свободной энергии лабильной
- •3.1.3 Математическое условие стеклования, налагаемое на изменения
- •3.1.4 Соотношение Пригожина-Дефея и его экспериментальная проверка
- •3.1.5 Термодинамический инвариант стеклообразного состояния
- •3.1.6 Следствия, вытекающие из соотношений термодинамики
- •5. Релаксационные процессы в стеклообразном состоянии. Ионная проводимость и ионный обмен
- •5.1.1 Зависимость температуры стеклования от скорости охлаждения
- •5.1.2 Процессы и законы релаксационных изменений свойств, структурная
- •5.1.3 Оценка времени достижения равновесного состояния в процессе отжига
- •5.1.4 Физическое старение стекла при комнатной температуре52
- •5.1.5 Релаксационные явления при переходе через температуру стеклования
- •5.1.6 «Кроссовер эффект»
- •5.1.7 Расчёт изменения свойств при отжиге стекол на основании
- •5.2 Природа ионной проводимости и диффузии в стеклах.
- •5.2.1 Структура стекла и основы механизма
- •5.2.2 Законы диффузии и соотношение Нернста – Эйнштейна
- •5.2.3 Основное статистическое уравнение проводимости. Энергия активации.
- •5.2.4 Общие корреляции, ряд подвижностей
- •5.2.5 Основные закономерности электропроводности, определяемые составом
- •5.2.6 Ионообменные процессы и проблемы современной оптической технологии
- •5.2.7 Ионообменные процессы с растворами. Стеклянный электрод.
- •6. Взаимосвязь между основными видами релаксационных процессов в стеклах
- •6.4.1 Соотношение Максвелла для проводимости диэлектриков
- •6.4.2 Соотношение Максвелла для проводимости диэлектриков как основа связи
- •6.4.3 Экспериментальная проверка возможности расчёта температуры «ионного» максимума внутреннего трения по данным проводимости
- •7. Основные принципы химической устойчивости стекол
- •7.1.1 Практическая значимость свойства и его физико-химическое
- •7.1.2 Методы испытания и классификация стекол по группам
- •Группы химической устойчивости бесцветного оптического стекла к действию кислоты и дистиллированной воды
- •Группы химической устойчивости бесцветного оптического стекла к действию влажной атмосферы
- •7.1.3 Влияние компонентов состава стекла на химическую устойчивость
- •7.1.4 Способы защиты оптических деталей от химического разрушения
- •8. Специфика некоторых структурных явлений в регистрирующих средах
- •8.1. Фотоструктурные изменения в халькогенидных стеклах, их существо и
- •8.2 Структурно-фазовые изменения в жидких кристаллах и физико-химическая
- •8.2.1 Общие представления о жидких кристаллах
- •8.2.2 Специфика изменения электрических и магнитных свойств при
1.4.5 Эвтектики (двухкомпонентные системы). Линии ликвидуса и солидуса.
Значение эвтектик в материаловедении
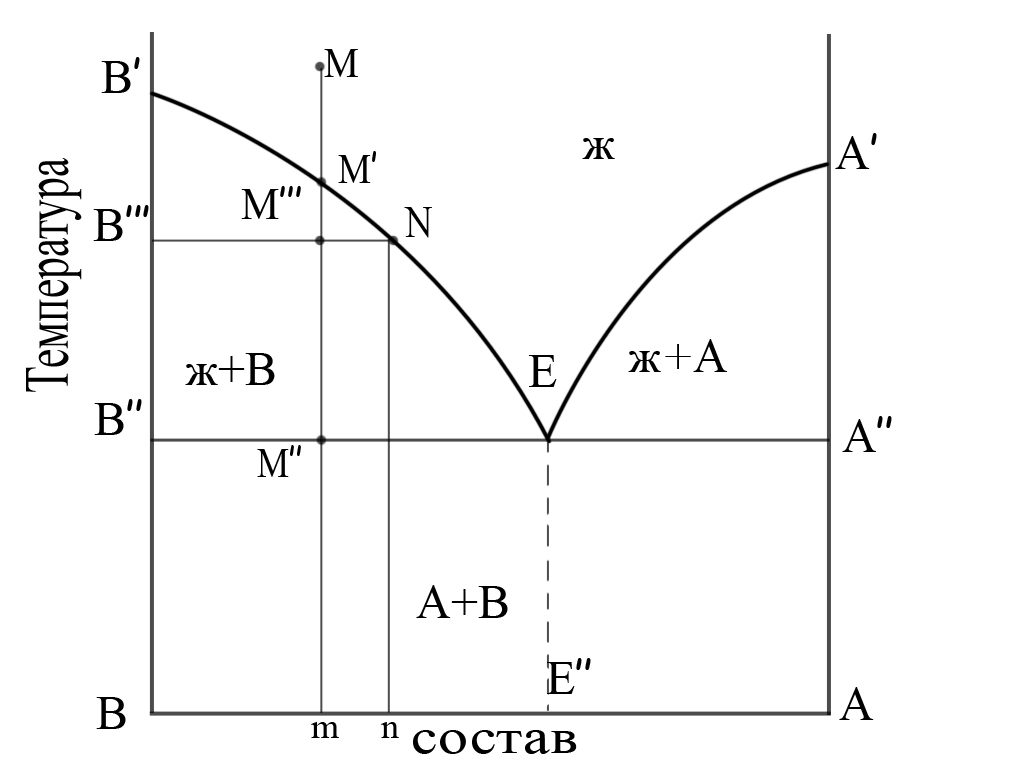
Диаграмма состояния эвтектического типа приведена на рис. 7. В качестве новой термодинамической переменной появился состав системы.
В′ и А′ суть температуры плавления компонентов В и А. Жидкость в точке М состава m при охлаждении не меняет состава и достигает точки М′ на кривой В′Е, ей по-прежнему соответствует состав m. Линия В′Е называется линией ликвидуса (ликвидусом), потому что выше неё существует только жидкость10, а ниже ней – смесь жидкости и кристаллической фазы. Линия ликвидуса соответствует геометрическому месту точек равновесия между жидкой фазой и кристаллами фазы В. С дальнейшим понижением температуры жидкость выбрасывает из своего состава кристаллы В и поэтому её состав обогащается компонентом А. Состав жидкости
|
Рис. 7. Диаграмма состояния эвтектического типа двойной системы. Пояснения см. в тексте. |
смещается вправо, в направлении М′N (состав n), температура равновесия жидкость - кристалл снижается.
Состав М′′′ при температуре В′′′ не может существовать как однородная жидкость. Она сразу распадается на жидкость состава n (соответствующую точке N), выбрасывая порцию кристаллов В (на графике показано сосуществование Ж+В).
Совершенно аналогичное происходит, если мы возьмем состав жидкости, обогащенной компонентом А. Здесь линия ликвидуса, соответствующая равновесию меняющейся по составу жидкости с фазой А, соответствует линии А′Е (на графике ниже неё показано сосуществование Ж+А).
В конце концов после выделения избыточных количеств кристаллов В или А, какой бы состав двухкомпонентной жидкости мы ни взяли, состав жидкости придёт к точке Е (состав Е′′). Она называется эвтектической (или эвтектикой). В этой точке кристаллизуются обе кристаллические фазы одновременно. Ниже этой точки в системе существуют только кристаллические фазы, жидкость исчезла полностью.
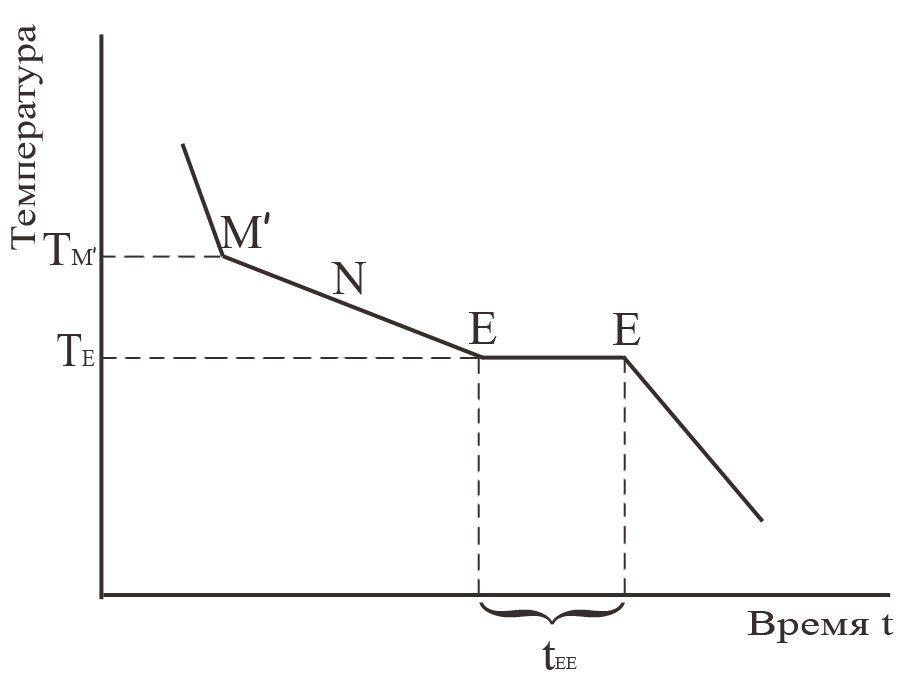
При изучении кристаллизации рассматривают непосредственно получаемые в эксперименте кривые «температура-время». На них проявляется как начало выделения фазы, так и её окончание. Например, для кристаллизации состава m на рис. 8 регистрируется появление кристаллической фазы в точке М′ (точка ТМ′ на рис. 8), затем наблюдают
|
Рис. 8. Изменение температуры при кристаллизации системы эвтектического типа (см. пояснения в тексте). |
непрерывное уменьшение температуры при изменении состава жидкой фазы в процессе выделения кристаллической фазы В по линии М′NE рис. 46 (на рис. 8 это линия М′NE). Затем на кривой охлаждения рис. 8
|
Рис. 9. Треугольник Таммана. Показаны экспериментальные точки. |
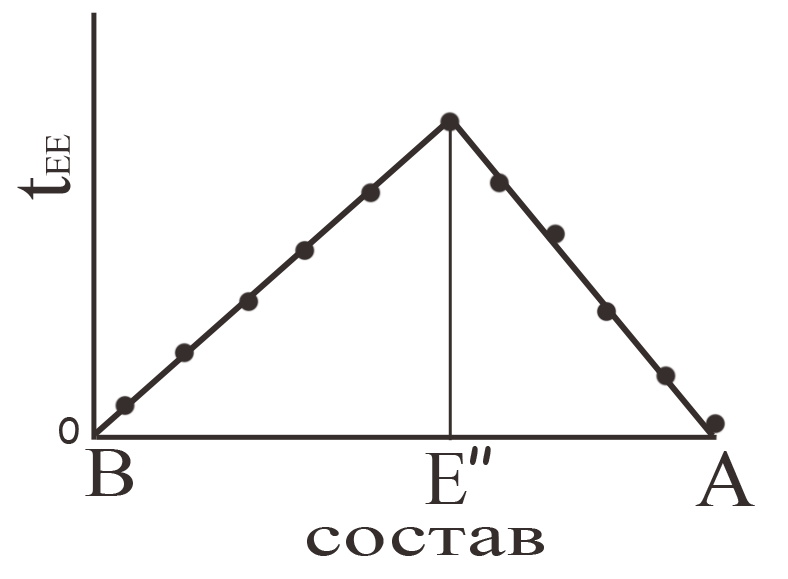
наблюдают продолжительность кристаллизации эвтектики tEE (параллельный оси абсцисс участок ЕЕ). Естественно, что чем ближе состав исходной жидкости к составу эвтектики, тем более продолжительной является линия, соответствующая постоянству температуры кристаллизации эвтектики. При точном соответствии состава жидкости составу эвтектики будет наблюдаться только эта линия. После завершения кристаллизации эвтектики температура снижается, поскольку все фазовые переходы, связанные с кристаллизацией жидкости, завершены, теперь могут наблюдаться только превращения, связанные с фазовыми переходами в кристаллическом состоянии. Продолжительность кристаллизации эвтектики tEE, отложенная как функция состава, образует так называемый «треугольник Таммана», вершина которого позволяет найти состав эвтектики (рис. 9).
Линия В′′А′′ называется линией солидуса (солидусом), потому что ниже неё в системе существуют только кристаллические фазы.
В областях, обозначенных «ж+В», «ж+А» и «В + А» могут сосуществовать только жидкость и соответствующие кристаллы В или А или только две кристаллические фазы.
Микроструктура эвтектических систем, наблюдаемая в микроскоп, всегда фазово неоднородна.
Студентам предоставляется возможность самим определить вариантность эвтектики. Паровая фаза не учитывается, так как на диаграмме её нет.
Эвтектические системы очень распространены среди всех видов соединений – солей, органических веществ, оксидов, и среди металлов (сплавов). В солевых системах с водой часто образуются эвтектики «со стороны воды», чем объясняется использование поваренной соли для очистки асфальта ото льда (Тпл. эвтектики, образованной H2O и соединением NaCl∙2H2O составляет –20ºС). Металлические сплавы эвтектического типа обладают особым сочетанием механических свойств (это важно для производства денежных знаков или литер для типографий). Для практики стеклообразных материалов эвтектики важны своими низкими температурами начала кристаллизации. Известно, что при изменении состава вязкость меняется по плавным кривым (если температура постоянна). Появление эвтектики резко увеличивает возможность стеклования, поскольку возможность выделения кристаллов резко снижается из-за низких температур ликвидуса (низких Твгк) и очень больших величин вязкости, которые им соответствуют.