
- •Гистология
- •Гистология
- •Раздел I Структура, функции и формирование тканевых систем
- •Часть I. Принципы тканевой организации …………………………….
- •Часть I I. Основные типы тканей (общая гистология)
- •Раздел II
- •Раздел III
- •Введение История гистологии
- •Предмет современной гистологии и её методы
- •Раздел I структура, функции и формирование тканевых систем
- •Часть I. Принципы тканевой организации
- •1.1. Определение понятия «ткань»
- •1.2. Происхождение и эволюция тканей
- •1.3. Тканевые элементы, их происхождение, классификация
- •Типы тканевых элементов
- •1.4. Дифференциация клеток Формирование тканей в онтогенезе
- •1.5. Поддержание тканей
- •1.6. «Альтруистическое поведение» клеток многоклеточного организма
- •1.7. Регенерация
- •1.8. Классификация тканей
- •Часть II основные типы тканей (общая гистология)
- •2.1. Эпителиальные (пограничные) ткани
- •2.1.1. Общая характеристика
- •2.1.1.1. Базальная мембрана (пластинка)
- •2.1.1.2. Происхождение и эволюция эпителиев
- •2.1.1.3. Классификация эпителиев
- •2.1.2. Основные типы эпителиев
- •2.1.2.1. Кожный эпителий (эпидермис)
- •2.1.2.1.1. Общая характеристика
- •2.1.2.1.2. Погружённые, однослойные, многорядные эпидермисы
- •2.1.2.1.3. Кутикулярные эпителии
- •2.1.2.1.4. Многослойные эпидермисы
- •Регенерация многослойного эпителия
- •2.1.2.2. Кишечный (всасывающий) эпителий
- •2.1.2.2.1. Общая характеристика
- •2.1.2.2.2. Эпителий тонкой кишки млекопитающих
- •2.1.2.3. Мерцательный эпителий
- •2.1.2.4. Осморегуляторные и выделительные эпителии
- •2.1.2.5. Железистые эпителии
- •2.1.2.5.1. Общая характеристика
- •2.1.2.5.2. Классификация желёз
- •Классификация одноклеточных желёз
- •Классификация многоклеточных желёз
- •2.1.2.5.3.Железистые клетки и их классификация
- •2.2. Ткани внутренней среды
- •2.2.1. Общая характеристика
- •2.2.2. Происхождение и основные направления эволюции тканей внутренней среды
- •2.2.3. Классификация тканей внутренней среды
- •2.2.4.1.1.2. Межклеточное вещество рыхлой волокнистой соединительной ткани
- •2.2.4.1.1.3. Клетки рыхлой волокнистой соединительной ткани
- •2.2.4.1.2. Ткани внутренней среды, выполняющие опорную функцию
- •2.2.4.1.2.1. Общая характеристика
- •Распространение минералов в различных живых организмах
- •2.2.4.1.2.2. Плотная соединительная ткань
- •2.2.4.1.2.3. Хрящевая ткань
- •2.2.1.2.4. Костная ткань
- •2.2.4.2.4.1. Межклеточное вещество костной ткани
- •2.2.4.1.2.4.2. Клетки костной ткани
- •2.2.4.1.2.4.3. Гистогенез и регенерация костной ткани
- •2.2.5. Циркулирующие трофические, транспортные тканевые системы
- •2.2.5.1. Общие понятия
- •2.2.5.2. Кровь позвоночных
- •2.2.5.2.1. Плазма крови
- •2.2.5.2.2. Клетки крови (форменные элементы)
- •Эритроциты.
- •Тромбоциты (кровяные пластинки)
- •Лейкоциты
- •2.2.5.2.3. Кроветворение (гемопоэз)
- •Классификация свободных элементов
- •Эмбриональное кроветворение.
- •2.2.5.3. Ткани внутренней среды, обеспечивающие транспортную функцию
- •2.2.5.3.1. Общая характеристика
- •2.2.5.3.2. Газообмен в многоклеточном организме
- •2.2.5.4. Ткани внутренней среды, выполняющие запасающую функцию
- •2.2.5.5. Защитные функции тканей внутренней среды
- •2.2.5.5.1. Общие представления
- •Эволюция иммунной системы
- •Клетки и ткани, относящиеся к иммунной системе, у беспозвоночных
- •2.2.5.5.2. Эндоцитоз
- •2.2.5.5.3. Инкапсуляция
- •2.2.5.5.4. Цитотоксичность
- •2.2.5.5.5. Воспаление
- •2.3. Мышечные ткани и локомоция в многоклеточном организме
- •2.3.1. Общая характеристика
- •2.3.1.1. Классификация мышечных тканей
- •2.3.1.2 Основные компоненты организации мышечных тканей
- •2.3.2. Гладкая мышечная ткань позвоночных
- •2.3.3. Поперечнополосатая и косоисчерченная мышечные ткани
- •2.3.3.1. Характеристика и классификация
- •2.3.3.2. Поперечнополосатая мышечная ткань позвоночных
- •2.3.3.2.1. Общая характеристика
- •2.3.3.2.2. Механизм сокращения
- •Сокращение
- •Расслабление
- •2.3.3.2.3. Гистогенез и регенерация поперечнополосатой мышечной ткани
- •Типы мышечных волокон и их свойства (по э. Г. Улумбекову, ю. А. Челышеву, 2002)
- •2.3.3.3. Косоисчерченные мышечные ткани
- •2.3.3.4. Целомические поперечнополосатые мышечные ткани
- •2.3.4. Немышечные сокращающиеся клетки
- •2.4. Ткани нервной системы (нервные ткани)
- •2.4.1. Общая характеристика
- •2.4.2. Нейроны
- •2.4.3. Нейроглия
- •2.4.4. Нервные волокна
- •2.4.5. Нервные окончания
- •2.4.5.1. Общая характеристика
- •2.4.5.2. Чувствительные нервные окончания – сенсорные рецепторы
- •2.4.5.2.1. Общая характеристика
- •2.4.5.2.2. Интерорецепторы
- •2.4.5.2.3. Экстерорецепторы
- •2.4.6. Синапсы
- •Основные группы нейромедиаторов (по э. Г. Улумбекову, ю. А. Челышеву, 2002)
- •2.4.7. Нейросекреторные клетки
- •Заключение
- •Раздел II практикум по гистологии
- •1. Изготовление гистологических препаратов
- •2. Работа с гистологическими препаратами
- •Порядок работы с препаратом
- •3. Руководство к практическим занятиям
- •3.1. Эпителиальные ткани
- •Однослойный призматический каёмчатый эпителий
- •Многорядный мерцательный эпителий
- •Многослойный эпителий кожи лягушки
- •3.2. Соединительные ткани
- •Мезенхима
- •Рыхлая волокнистая соединительная ткань
- •Жировая ткань
- •Механические соединительные ткани
- •Костная ткань (textus osseus) Костные клетки жаберной крышки селёдки
- •Развитие кости из мезенхимы
- •Развитие кости на месте хряща
- •3.3. Кровь (sanguis, haema) Мазок крови лягушки
- •Мазок крови человека
- •3.4. Мышечные ткани
- •Поперечно-полосатая мышечная ткань
- •Демонстрационные препараты:
- •3.5. Нервные ткани
- •Нейрофибриллы в двигательных клетках спинного мозга
- •Тигроид в двигательных клетках спинного мозга
- •Раздел III.
- •Справочные материалы
- •Словарь
- •Некоторых терминов и понятий
- •Литература
- •Основные типы тканей (иллюстрации)
2.3.3.2.2. Механизм сокращения
Способность мышечного волокна к сокращению обусловлена его ультраструктурой (рис. 17).
I-диск содержит только тонкие нити. Один конец такой нити прикреплён к Z–линии (рис. 16, 17), а другой – направлен к середине саркомера.
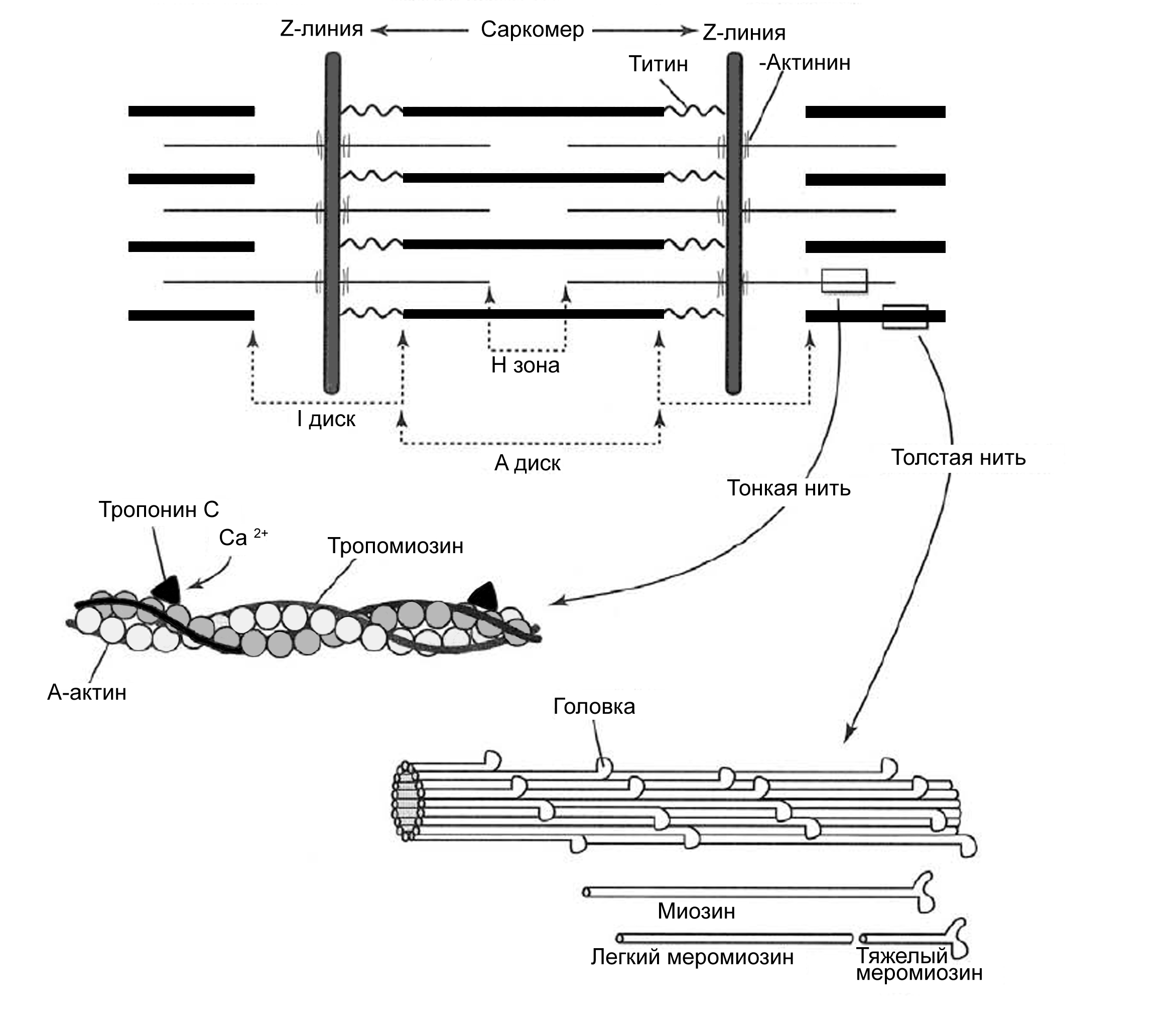
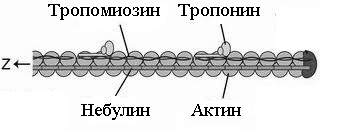
Рис. 17. Ультраструктура саркомера (по W. Ronald., 1990).
Толстые нити занимают центральную часть саркомера; их совокупность морфологически и обуславливает то, что называют А-диском. Тонкие нити лишь частично входят между толстыми. Следовательно, в саркомере имеется участок, содержащий только толстые нити – так называемая Н-зона. В середине Н-зоны проходит М-линия (мезофрагма) (рис. 16).
Таким образом, I-диск входит в состав двух саркомеров; то есть каждый саркомер содержит один А-диск (тёмный) и две половины I-дисков (светлых).
Толстая нить образована несколькими белками. Прежде всего, каждая миозиновая нить состоит из 300-400 молекул миозина, а также С-белка. Половина молекул миозина обращена головками (см. ниже) к одному концу нити, а вторая – к другому. Свободные концы толстых нитей с Z-линией связывает титин.
Миозин. В молекуле миозина различают тяжёлый и лёгкий меромиозин. Тяжёлый имеет два субфрагмента (S): S1 образован глобулярными головками миозина, S2 – эластичным компонентом. Лёгкий меромиозин образует концевую часть хвостовой нити миозина длиной 100 нм.
Молекула миозина имеет два шарнирных участка, позволяющих ей изменять конформацию («сгибаться»). Один шарнирный участок находится в области соединения тяжёлого и лёгкого меромиозинов, другой – в области шейки молекулы миозина (S1-S2 соединение); при этом лёгкий меромиозин лежит в толще толстой нити, тогда как тяжёлый меромиозин (благодаря шарнирным участкам) выступает на её поверхность.
Титин (Tn) – наибольших размеров полипептид, входящий в состав толстых нитей: его молекулярная масса около 300 кД. Он работает наподобие «молекулярной пружины», обеспечивая структурную целостность миофибрилл во время сокращения. Один конец молекулы проникает в Z-линию и через -актинин связывается с молекулой титина соседнего саркомера. Другой конец молекулы приближается к М-линии и при помощи миомезина прикрепляется к свободному концу молекулы титина второй половины саркомера. В I-диске титин ассоциирован с тонкими нитями, а в А-диске белок связывается с толстыми нитями. Таким образом, контактируя в области Z-линии, молекулы титина образуют непрерывную цепь.
С-белок стабилизирует структуру миозиновых нитей. Влияя на агрегацию молекул миозина, он обеспечивает одинаковый диаметр и стандартную длину толстых нитей.
Тонкая нить также образована рядом белков - актином, тропомиозином и тропонином.
Актин. Молекулы глобулярного актина (G-актин) полимеризуются и образуют фибриллярный актин (F-актин). Уложенные друг за другом молекулы F-актина в тонкой нити формируют две спирально закрученные цепочки.
Тропомиозин состоит из двух полипептидных цепей и имеет конфигурацию двойной спирали. Полярные молекулы тропомиозина длиной 40 нм укладываются «конец в конец» в желобке между описанными выше цепочками F-актина.
Тропонин – комплекс, образованный тремя глобулярными молекулами. Препятствует взаимодействию актина с миозином. Тропониновый комплекс прикреплён к молекулам тропомиозина, и потому он располагается с интервалами 40 нм.
Небулин – фибриллярный белок, ассоциированный с тонкими нитями.
