
- •Экзаменационные вопросы по физике
- •Механика основные положения
- •Кинематика(от греческого kinematicos – движение)
- •Механическое движение
- •Относительность движения(уч.10кл.Стр.25-27)
- •Системы отсчета (уч.10кл.Стр.25-27)
- •Материальная точка (уч.10кл.Стр.24-25)
- •Траектория (уч.10кл.Стр.24-25)
- •Путь и перемещение (уч.10кл.Стр.28-30)
- •Скорость (уч.10кл.Стр.32-38)
- •Ускорение (уч.10кл.Стр.41-43)
- •Равномерное и равноускоренное прямолинейное движение (уч.10кл.Стр.38-40, 44-50)
- •Уравнение прямолинейного равноускоренного движения (уч.10кл.Стр.44-50)
- •Свободное падение тел (уч.10кл.Стр.52-55)
- •Ускорение свободного падения (уч.10кл.Стр.52-53)
- •Баллистическое движение(уч.10кл.Стр.61-68)
- •Криволинейное движение точки на примере движения по окружности с постоянной по модулю скоростью (уч.10кл.Стр.70-73)
- •Центростремительное ускорение (уч.10кл.Стр.70-73)
- •Основы динамики основные положения(уч.10кл.Стр.119-120)
- •Инерция. Преобразования галилея (уч.10кл.Стр.83- )
- •Первый закон ньютона (уч.10кл.Стр.87-88,уч.9кл.Стр.39-41)
- •Инерциальные системы отсчета (уч.10кл.Стр.83-86)
- •Принцип относительности галилея
- •Взаимодействие тел (уч.10кл.Стр.89-92)
- •Масса (уч.10кл.Стр.90-91)
- •Импульс (уч.10кл.Стр.121-126)
- •Сила (уч.10кл.Стр.90-92)
- •Второй закон ньютона (уч.10кл.Стр.89-92)
- •Принцип суперпозиции сил (уч.10кл.Стр.92)
- •Силы в природе закон всемирного тяготения (уч.10кл.Стр.96-99)
- •Сила тяготения (уч.10кл.Стр.96-99)
- •Вес тела (уч.10кл. Стр.100,105, 113-115)
- •Невесомость (уч.10кл. Стр.100-101, 113-115)
- •Первая космическая скорость (уч.10кл. Стр.161-163)
- •Сила упругости (уч.10кл. Стр.102-104, 317-320)
- •Закон гука (уч.10кл. Стр.102-105)
- •Деформация тела (уч.10кл.Стр.317-320)
- •Сила трения (уч.10кл. Стр.107-111)
- •Коэффициент трения (уч.10кл. Стр.107-111)
- •Закон трения скольжения (уч.10кл. Стр.107-111, 115-117)
- •Третий закон ньютона (уч.10кл. Стр.93-95)
- •Момент силы
- •Условия равновесия тел
- •Законы сохранения в механике основные положения (уч.10кл. Стр.158)
- •Закон сохранения импульса (уч.10кл. Стр.121-128, 153-157)
- •Ракеты (уч.10кл. Стр.128-129)
- •Механическая работа (уч.10кл. Стр.134)
- •Мощность (уч.10кл. Стр.146-148)
- •Кинетическая энергия (уч.10кл. Стр.142-145)
- •Потенциальная энергия (уч.10кл. Стр.135-142, 153)
- •Закон сохранения энергии в механике (уч.10кл. Стр.148-152, 153-157)
- •Простые механизмы (уч.7кл.Стр.136-150)
- •Коэффициент полезного действия механизма (уч.7кл.Стр.150-151)
- •Механика жидкостей и газов давление (уч.7кл.Стр.77)
- •Атмосферное давление (уч.7кл.Стр.97-103,181-182)
- •Изменение атмосферного давления с высотой (уч.7кл.Стр.106)
- •Закон паскаля для жидкостей и газов (уч.7кл.Стр.85-,176-178)
- •Барометры и манометры (уч.7кл.Стр.105, 108)
- •Сообщающиеся сосуды(уч.7кл.Стр.90)
- •Принцип устройства гидравлического пресса (уч.7кл.Стр.111-113)
- •Архимедова сила для жидкостей и газов (уч.7кл.Стр.114-125)
- •Условия плавания тел на поверхности жидкости (уч.7кл.Стр.120-125)
- •Термодинамика
- •Основы молекулярно-кинетической теории (уч.10кл.Стр.211- )
- •Опытное обоснование основных положений молекулярно-кинетической теории
- •Броуновское движение
- •Диффузия (уч.7кл.Стр.20)
- •Масса и размер молекул
- •Измерение скорости молекул. Опыт штерна(уч.10кл.Стр.236)
- •Количество вещества(уч.10кл.Стр.216-217)
- •Моль(уч.10кл.Стр.216-217)
- •Постоянная авогадро (уч.10кл.Стр.216-217)
- •Взаимодействие молекул
- •Модели газа, жидкости и твердого тела(уч.10кл.Стр.218-224)
- •Основы термодинамики (уч.10кл.Стр.284-285)
- •Тепловое равновесие температура и ее измерение(уч.10кл.Стр.239-241)
- •Абсолютная температурная шкала(уч.10кл.Стр.239-241)
- •Внутренняя энергия (уч.10кл.Стр.239-243, 261-264, уч.8кл.Стр.5-9)
- •Количество теплоты (уч.10кл.Стр.263-264, уч.8кл.Стр.18-29)
- •Работа в термодинамике(уч.10кл.Стр.265-267)
- •Первый закон термодинамики(уч.10кл.Стр.269-273)
- •Изотермический, изохорный и изобарный процессы(уч.10кл.Стр.252-257, 265-267, 270-271)
- •Адиабатный процесс(уч.10кл.Стр.272-274)
- •Необратимость тепловых процессов второй закон термодинамики и его статистическое истолкование (уч.10кл.Стр.281-283)
- •Преобразование энергии в тепловых двигателях (уч.10кл.Стр.275-280,уч.8кл.Стр.52-56 )
- •Кпд теплового двигателя. Цикл карно(уч.10кл.Стр.275-280 )
- •Идеальный газ (уч.10кл.Стр.222,229- )
- •Связь между давлением и средней кинетической энергией молекул идеального газа(уч.10кл.Стр.243-248)
- •Связь температуры со средней кинетической энергией частиц газа(уч.10кл.Стр.239-243)
- •Уравнение клайперона-менделеева(уч.10кл.Стр.248-251)
- •Универсальная газовая постоянная(уч.10кл.Стр.251- )
- •Жидкости и твердые тела основные положения (уч.10кл.Стр.307-308, 321-322)
- •Испарение и конденсация(уч.10кл.Стр.286-289,290-291)
- •Насыщенные и ненасыщенные пары(уч.10кл.Стр.286-291,292-293)
- •Влажность воздуха(уч.10кл.Стр.294-295,уч.8кл.Стр.46-47)
- •Кипение жидкости(уч.10кл.Стр.296-299,уч.8кл.Стр.44-45)
- •Поверхностное натяжение (уч.10кл.Стр.299-302)
- •Смачивание и каппилярность (уч.10кл.Стр.303-306)
- •Кристаллические и аморфные тела (уч.10кл.Стр.312-317)
- •Преобразование энергии при изменениях агрегатного состояния вещества(уч.10кл.Стр.218-224, 309-312,уч.8кл.Стр.48-50)
- •Измерение давления газа, влажности воздуха, температуры, плотности вещества
- •Основы электродинамики (уч.10кл.Стр.347 )
- •Электростатика основные положения (уч.10кл.Стр.376-377, 406-407)
- •Электризация тел(уч.10кл.Стр.350-352)
- •Электрический заряд(уч.10кл.Стр.347-349,356)
- •Взаимодействие зарядов(уч.10кл.Стр.347-349,)
- •Элементарный электрический заряд(уч.10кл.Стр.347-349)
- •Закон сохранения электрического заряда(уч.10кл.Стр.352-353)
- •Закон кулона(уч.10кл.Стр.354-362)
- •Электрическое поле
- •Напряженность электрического поля(уч.10кл.Стр.363-368, 374)
- •Электрическое поле точечного заряда(уч.10кл.Стр.363-365, 366-368)
- •Потенциальность электростатического поля(уч.10кл.Стр.378-381)
- •Разность потенциалов(уч.10кл.Стр.381-385)
- •Принцип суперпозиции полей(уч.10кл.Стр.368-375)
- •Проводники в электрическом поле(уч.10кл.Стр.392-396)
- •Электрическая емкость(уч.10кл.Стр.397-398 )
- •Конденсатор(уч.10кл.Стр.399-402)
- •Емкость плоского конденсатора(уч.10кл.Стр.400-402)
- •Диэлектрики в электрическом поле(уч.10кл.Стр.386-390)
- •Диэлектрическая проницаемость(уч.10кл.390-391)
- •Энергия электрического поля плоского конденсатора(уч.10кл.Стр.400-402, 403-406)
- •Постоянный электрический ток основные положения
- •Электрический ток
- •Сила тока
- •Напряжение
- •Носители свободных электрических зарядов в металлах, жидкостях и газах
- •Ток в газах
- •Ток в вакууме. Термоэлектронная эмиссия
- •Сопротивление проводников
- •Закон ома для участка цепи
- •Последовательное и параллельное соединение проводников
- •Электродвижущая сила
- •Работа и мощность тока. Кпд источника тока
- •Закон джоуля-ленца
- •Полупроводники основные положения
- •Проводимость полупроводников
- •Свободная и примесная проводимость полупроводников
- •Магнитное поле. Электромагнитная индукция основные положения
- •Взаимодействие магнитов
- •Магнитные свойства вещества. Магнитная проницаемость. Магнетики
- •Взаимодействие проводников с током
- •Магнитное поле
- •Действие магнитного поля на электрические заряды
- •Индукция магнитного поля. Поток магнитной индукции
- •Сила ампера
- •Сила лоренца
- •Электродвигатель (уч.8кл.Стр.143-145)
- •Электромагнитная индукция
- •Закон электромагнитной индукции фарадея-максвелла
- •Правило ленца
- •Вихревое электрическое поле
- •Самоиндукция (уч.11кл.Стр.123-126)
- •Индуктивность
- •Энергия магнитного поля
- •Измерение силы тока, напряжения, сопротивления проводника
- •Колебания и волны основные положения (уч.10кл. Стр.184-,345-346)
- •Механические колебания и волны основные положения ( уч.10кл.Стр.345-346)
- •Гармонические колебания (уч.10кл. Стр.69-70, уч.11кл.Стр.137)
- •Амплитуда, период и частота колебаний (уч.10кл. Стр.69-70)
- •Свободные колебания (уч.10кл. Стр.167-170)
- •Математический маятник (уч.10кл. Стр.167-172)
- •Период колебаний математического маятника (уч.10кл. Стр.167-172)
- •Превращения энергии при гармонических колебаниях
- •Вынужденные колебания (уч.10кл. Стр.167, 173-179)
- •Резонанс (уч.10кл. 177-183)
- •Понятие об автоколебаниях
- •Механические волны(уч.10кл.Стр.323-324)
- •Скорость распространения волны
- •Длина волны(уч.10кл.Стр.329)
- •Поперечные и продольные волны(уч.10кл.Стр.324-328)
- •Уравнение гармонической волны(уч.10кл.Стр.328-337)
- •Поляризация волн (уч.10кл.Стр.330-331)
- •Стоячие волны (уч.10кл.Стр.332-337)
- •Звук(уч.10кл.Стр.338-344)
- •Электромагнитные колебания и волны основные положения
- •Колебательный контур
- •Переменный электрический ток генератор переменного тока (уч.11кл.Стр.131)
- •Действующие значения силы тока и напряжения
- •Активное, емкостное и индуктивное сопротивления
- •Закон ома для переменного тока. Полное сопротивление цепи
- •Резонанс в электрической цепи
- •Трансформатор
- •Производство, передача и потребление электрической энергии (уч.11кл.Стр.134)
- •Идеи теории максвелла
- •Электромагнитные волны
- •Шкала электромагнитных волн
- •Скорость распространения электромагнитных волн
- •Свойства электромагнитный волн
- •Энергия электромагнитной волны
- •Принципы радиосвязи
- •Оптика основные положения
- •Принцип гюйгенса
- •Свет - электромагнитная волна
- •Прямолинейное распространение, отражение и преломление света
- •Законы преломления и отражения света
- •Показатель преломления
- •Полное внутреннее отражение
- •Предельный угол полного внутреннего отражения
- •Ход лучей в призме
- •Построение изображений в плоском зеркале
- •Собирающая и рассеивающая линзы
- •Формула тонкой линзы
- •Построение изображений в линзах (уч.11кл.Стр.243-249,257-259,
- •Оптические приборы
- •Фотоаппарат
- •Интерференция света
- •Зоны френеля
- •Когерентность
- •Дифракция света
- •Дифракционная решетка
- •Поляризация света. Поперечность световых волн
- •Дисперсия света
- •Поглощение света
- •Измерение фокусного расстояния собирающей линзы, показателя преломления вещества, длины волны света фотометрия .Световой поток. Освещенность
- •Спектры и спектральный анализ
- •Основы специальной теории относительности основные положения (уч.10кл.Стр.209)
- •Инвариантность скорости света (уч.10кл.Стр.186-187)
- •Принцип относительности эйнштейна (уч.10кл.Стр.186-189)
- •Пространство и время в специальной теории относительности (уч.10кл.Стр.186-205)
- •Связь массы и энергии (уч.10кл.Стр.205-209)
- •Квантовая физика основные положение (уч.10кл.Стр.227-228, уч.11кл.Стр. 345-346)
- •Тепловое излучение(уч.11кл.Стр.308-312)
- •Постоянная планка( уч.11кл.Стр.310)
- •Фотоэффект (уч.11кл.Стр.314-317)
- •Опыты столетова(уч.11кл.Стр.314)
- •Уравнение эйнштейна для фотоэффекта
- •Гипотеза луи де бройля(уч.11кл.Стр.322)
- •Дифракция электронов(уч.11кл.Стр.322-323)
- •Корпускулярно-волновой дуализм(уч.11кл.Стр.318-321,323-325)
- •Спектры(уч.11кл.Стр.336-339)
- •Люминесценция(уч.11кл.Стр.337-338)
- •Лазеры(уч.11кл.Стр.340-344)
- •1. Поглощение света
- •2. Спонтанное излучение
- •3. Индуцированное излучение
- •Ядерная физика основные положение (уч.10кл.Стр.227-228, уч.11кл.Стр.387-389,406)
- •Радиоактивность (уч.11кл.Стр.357-362,363-367)
- •Альфа-, бета-, гамма- излучения
- •Закон радиоактивного распада(уч.11кл.Стр.363-367)
- •Методы наблюдения и регистрации частиц в ядерной физике(уч.9кл.Стр.189-192)
- •Опыт резерфорда по рассеиванию альфа-частиц(уч.11кл.Стр.328)
- •Планетарная модель атома(уч.10кл.Стр.211-215,уч.11кл.Стр.329)
- •Модель атома резерфорда-бора. Квантовые постулаты бора(уч.11кл.Стр.330-336)
- •Нуклонная модель ядра (уч.10кл.Стр.211,уч.11кл.Стр.347)
- •Заряд ядра
- •Массовое число ядра
- •Энергия частиц в ядре. Энергия связи атомных ядер(уч.11кл.Стр.354-357)
- •Деление ядер. Цепная реакция(уч.11кл.Стр.367-372)
- •Синтез ядер(уч.11кл.Стр.378-383)
- •Ядерные реакции
- •Сохранение заряда и массового числа при ядерных реакциях
- •Выделение энергии при делении и синтезе ядер
- •Использование ядерной энергии(уч.11кл.Стр.373-377)
- •Дозиметрия. Биологическое действие ионизирующих излучений(уч.11кл.Стр.383- )
- •Элементарные частицы(уч.11кл.Стр.390-405)
- •Фундаментальные взаимодействия (уч.10кл.Стр.9-16)
- •Методы научного познания и физическая картина мира эксперимент и теория в процессе познания мира(уч.10кл.Стр.4-7)
- •Моделирование явлений и объектов природы (уч.10кл.Стр.7-9)
- •Научные гипотезы физические законы и границы их применимости(уч.10кл.Стр.9-16)
Смачивание и каппилярность (уч.10кл.Стр.303-306)
Примеры и физика процесса смачивания.
Определение смачивания
Условия смачивания
Мениск
Угол смачивания
Капиллярность
Поведение жидкости в капилляре
Формула высоты подъема жидкости в каппиляре
Сферическая форма капли жидкости при соприкосновении с поверхностью твердого тела не сохраняется. Изменение формы зависит от свойств жидкости и твердого тела.
Если сила притяжения между молекулами жидкости и твердого тела Fж-т больше, чем силы притяжения между молекулами жидкости Fж, то жидкость смачивает поверхность.
Если сила притяжения между молекулами жидкости и твердого тела Fж-т меньше, чем силы притяжения между молекулами жидкости Fж, то жидкость не смачивает поверхность.
Примеры:
вода смачивает стекло Fжт > Fж
вода не смачивает парафин Fжт < Fж
Смачивание – искривление поверхности жидкости у поверхности твердого тела в результате взаимодействия молекул жидкости с молекулами твердого тела.
Смачивание твердых поверхностей жидкостью характеризуется мениском и углом смачивания.
Мениск – форма поверхности жидкости вблизи стенки сосуда.
Мениск зависит от того, смачивает или не смачивает жидкость стенки сосуда.
Угол смачивания θ – угол между плоскостью, касательной к поверхности жидкости, и стенкой.
Для смачивающей жидкости угол смачивания острый θ < 90o
Для несмачивающей жидкости угол смачивания тупой θ < 90o

В широких сосудах силы притяжения между молекулами твердого тела и жидкости удерживают в виде мениска лишь незначительную часть жидкости. Основная поверхность – горизонтальная. В узких сосудах (капиллярах) масса жидкости невелика и наблюдается явление капиллярности.
Капиллярность – явление подъема или опускания жидкости в капиллярах.
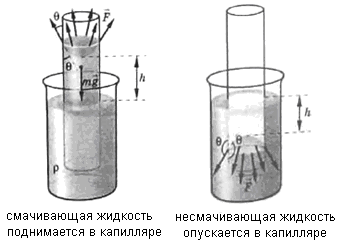
Смачивающая жидкость поднимается в каппиляре. Fжт > Fж
Несмачивающая жидкость опускается в капилляре. Fжт < Fж
Подъем жидкости в капилляре происходит пока результирующая сила, действующая на жидкость вверх, не уравновесится силой тяжести столба жидкости высотой h:
Fв = mg
Жидкость, не смачивающая стенки капилляра, опускается в нем на расстояние h.
Согласно третьему закону Ньютона сила Fв, действующая на жидкость, равна силе поверхностного натяжения Fпов, действующей на стенку по линии соприкосновения ее с жидкостью:
Fв = Fпов
Fв = mg (вес столба жидкости в капилляре)
Fпов = σ 2πr
2πr - длина контура окружности капилляра
σ – поверхностное натяжение жидкости (См.выше «Поверхностное натяжение»)
Масса жидкости m = ρV = ρ πr2h
ρ – плотность жидкости
Высота подъема жидкости в капилляре( учитывая что σ 2πr = ρ πr2h g) :
h =
Высота подъема жидкости в капилляре зависит от свойств жидкости (ее поверхностного натяжения σ и плотности ρ)
Чем меньше радиус капилляра, тем выше высота подъема жидкости в капилляре.
Кристаллические и аморфные тела (уч.10кл.Стр.312-317)
Деление тел по характеру относительного расположения частиц
Определение кристаллической решетки
Определение монокристалла и поликристалла. Примеры
Типы кристаллических решеток
Полиморфизм
Анизотропия
Изотропия
Физические свойства веществ различной кристаллической структуры
Определение аморфных тел. Примеры
Композиты
По характеру взаимного расположения частиц твердые тела делятся на три вида:
- кристаллические
- аморфные
- композиты
Принадлежность к тому или иному виду определяется химическим составом.
Кристаллы – это твердые тела, атомы или молекулы которых занимают определенные, упорядоченные положения в пространстве.
Кристаллическая решетка – пространственная структура с регулярным, периодически повторяющимся расположением частиц.
Положения равновесия, относительно которых происходят тепловые колебания частиц, являются узлами кристаллической решетки.
Различаются четыре типа кристаллической решетки:
1) Ионные кристаллы – большинство неорганических соединений, например соли, окиси металлов;
2) Атомные кристаллы – кристаллические решетки полупроводников, многие органические твердые тела;
3) Молекулярные кристаллы – бром, метан, нафталин, парафин, многие твердые органические соединения;
4) Металлические кристаллы – металлы.
Монокристалл – твердое тело, частицы которого образуют единую кристаллическую решетку.
Поликристалл – твердое тело, состоящее из беспорядочно ориентированных монокристаллов.
Полиморфизм – существование различных кристаллических структур у одного и того же вещества.
Пример – алмаз, графит, фурелен – три разновидности углерода.
Кристаллы по разному проводят теплоту и ток в различных направлениях. От направления зависят и оптические свойства кристаллов.
Физические свойства кристаллических тел неодинаковы в различных направлениях.
Это свойство кристаллов называется анизотропностью или анизотропией..
(греческое «анизос» – неравный, «тропос» – направление)
Анизотропия – зависимость физических свойств от направления внутри кристалла.
Изотропия – независимость физических свойств вещества от направления.
Анизотропия объясняется неодинаковой плотностью расположения частиц в кристаллической решетке в разных направлениях. Практически все кристаллические тела анизотропны.
Анизотропия механических, тепловых, электрических и оптических свойств кристаллов объясняется тем, что при упорядоченном расположении атомов, молекул или ионов силы взаимодействия между ними и межатомные расстояния оказываются неодинаковыми по различным направлениям.
Каждый маленький монокристалл поликристаллического тела анизотропен, но поликристаллическое тело изотропно.
Не все твердые тела – кристаллы.
Аморфные тела - твердые тела, для которых характерно неупорядоченное расположение частиц в пространстве.
Аморфные тела не имеют определенной формы в своей структуре строения атома или молекулы, не имеют кристаллической решетки, обладают свойством изотропии.
Все аморфные тела изотропны.
В отличие от жидкостей подвижность частиц в аморфных телах мала. Перескоки из одного положения в другое редки. С ростом температуры перескоки частиц учащаются.
В отличие от кристаллических тел определенной температуры плавления у аморфных тел нет.
Аморфные тела при низких температурах по своим свойствам напоминают твердые тела.
При кратковременных внешних воздействиях аморфные тела ведут себя как твердые, при продолжительном воздействии – текут.
Они занимают промежуточное положение между жидкостями и твердыми телами.
Атомы и молекулы аморфных тел, как и в жидкости, имеют определенное время «оседлой» жизни – время колебаний около положения равновесия, но по сравнению с жидкостью это время велико.
Аморфные тела являются изотропными – у них нет строгого порядка в расположении атомов. Их, физические свойства одинаковы по всем направлениям.
Примерами аморфных тел могут служить куски затвердевшей смолы, янтарь, стекло, резина, пластмассы.
Одно и тоже вещество может находится как в кристаллической, так и в аморфной формах. Например, SiO2 – кристаллическая форма – кварц, аморфная - кремнезем.
В композитах атомы располагаются трехмерно упорядоченно в определенной области пространства, но этот порядок не повторяется с регулярной периодичностью.
Композиты – (дерево, бетон, кость, фибергласс) состоят из различных, связанных друг с другом материалов.
