
- •Экзаменационные вопросы по физике
- •Механика основные положения
- •Кинематика(от греческого kinematicos – движение)
- •Механическое движение
- •Относительность движения(уч.10кл.Стр.25-27)
- •Системы отсчета (уч.10кл.Стр.25-27)
- •Материальная точка (уч.10кл.Стр.24-25)
- •Траектория (уч.10кл.Стр.24-25)
- •Путь и перемещение (уч.10кл.Стр.28-30)
- •Скорость (уч.10кл.Стр.32-38)
- •Ускорение (уч.10кл.Стр.41-43)
- •Равномерное и равноускоренное прямолинейное движение (уч.10кл.Стр.38-40, 44-50)
- •Уравнение прямолинейного равноускоренного движения (уч.10кл.Стр.44-50)
- •Свободное падение тел (уч.10кл.Стр.52-55)
- •Ускорение свободного падения (уч.10кл.Стр.52-53)
- •Баллистическое движение(уч.10кл.Стр.61-68)
- •Криволинейное движение точки на примере движения по окружности с постоянной по модулю скоростью (уч.10кл.Стр.70-73)
- •Центростремительное ускорение (уч.10кл.Стр.70-73)
- •Основы динамики основные положения(уч.10кл.Стр.119-120)
- •Инерция. Преобразования галилея (уч.10кл.Стр.83- )
- •Первый закон ньютона (уч.10кл.Стр.87-88,уч.9кл.Стр.39-41)
- •Инерциальные системы отсчета (уч.10кл.Стр.83-86)
- •Принцип относительности галилея
- •Взаимодействие тел (уч.10кл.Стр.89-92)
- •Масса (уч.10кл.Стр.90-91)
- •Импульс (уч.10кл.Стр.121-126)
- •Сила (уч.10кл.Стр.90-92)
- •Второй закон ньютона (уч.10кл.Стр.89-92)
- •Принцип суперпозиции сил (уч.10кл.Стр.92)
- •Силы в природе закон всемирного тяготения (уч.10кл.Стр.96-99)
- •Сила тяготения (уч.10кл.Стр.96-99)
- •Вес тела (уч.10кл. Стр.100,105, 113-115)
- •Невесомость (уч.10кл. Стр.100-101, 113-115)
- •Первая космическая скорость (уч.10кл. Стр.161-163)
- •Сила упругости (уч.10кл. Стр.102-104, 317-320)
- •Закон гука (уч.10кл. Стр.102-105)
- •Деформация тела (уч.10кл.Стр.317-320)
- •Сила трения (уч.10кл. Стр.107-111)
- •Коэффициент трения (уч.10кл. Стр.107-111)
- •Закон трения скольжения (уч.10кл. Стр.107-111, 115-117)
- •Третий закон ньютона (уч.10кл. Стр.93-95)
- •Момент силы
- •Условия равновесия тел
- •Законы сохранения в механике основные положения (уч.10кл. Стр.158)
- •Закон сохранения импульса (уч.10кл. Стр.121-128, 153-157)
- •Ракеты (уч.10кл. Стр.128-129)
- •Механическая работа (уч.10кл. Стр.134)
- •Мощность (уч.10кл. Стр.146-148)
- •Кинетическая энергия (уч.10кл. Стр.142-145)
- •Потенциальная энергия (уч.10кл. Стр.135-142, 153)
- •Закон сохранения энергии в механике (уч.10кл. Стр.148-152, 153-157)
- •Простые механизмы (уч.7кл.Стр.136-150)
- •Коэффициент полезного действия механизма (уч.7кл.Стр.150-151)
- •Механика жидкостей и газов давление (уч.7кл.Стр.77)
- •Атмосферное давление (уч.7кл.Стр.97-103,181-182)
- •Изменение атмосферного давления с высотой (уч.7кл.Стр.106)
- •Закон паскаля для жидкостей и газов (уч.7кл.Стр.85-,176-178)
- •Барометры и манометры (уч.7кл.Стр.105, 108)
- •Сообщающиеся сосуды(уч.7кл.Стр.90)
- •Принцип устройства гидравлического пресса (уч.7кл.Стр.111-113)
- •Архимедова сила для жидкостей и газов (уч.7кл.Стр.114-125)
- •Условия плавания тел на поверхности жидкости (уч.7кл.Стр.120-125)
- •Термодинамика
- •Основы молекулярно-кинетической теории (уч.10кл.Стр.211- )
- •Опытное обоснование основных положений молекулярно-кинетической теории
- •Броуновское движение
- •Диффузия (уч.7кл.Стр.20)
- •Масса и размер молекул
- •Измерение скорости молекул. Опыт штерна(уч.10кл.Стр.236)
- •Количество вещества(уч.10кл.Стр.216-217)
- •Моль(уч.10кл.Стр.216-217)
- •Постоянная авогадро (уч.10кл.Стр.216-217)
- •Взаимодействие молекул
- •Модели газа, жидкости и твердого тела(уч.10кл.Стр.218-224)
- •Основы термодинамики (уч.10кл.Стр.284-285)
- •Тепловое равновесие температура и ее измерение(уч.10кл.Стр.239-241)
- •Абсолютная температурная шкала(уч.10кл.Стр.239-241)
- •Внутренняя энергия (уч.10кл.Стр.239-243, 261-264, уч.8кл.Стр.5-9)
- •Количество теплоты (уч.10кл.Стр.263-264, уч.8кл.Стр.18-29)
- •Работа в термодинамике(уч.10кл.Стр.265-267)
- •Первый закон термодинамики(уч.10кл.Стр.269-273)
- •Изотермический, изохорный и изобарный процессы(уч.10кл.Стр.252-257, 265-267, 270-271)
- •Адиабатный процесс(уч.10кл.Стр.272-274)
- •Необратимость тепловых процессов второй закон термодинамики и его статистическое истолкование (уч.10кл.Стр.281-283)
- •Преобразование энергии в тепловых двигателях (уч.10кл.Стр.275-280,уч.8кл.Стр.52-56 )
- •Кпд теплового двигателя. Цикл карно(уч.10кл.Стр.275-280 )
- •Идеальный газ (уч.10кл.Стр.222,229- )
- •Связь между давлением и средней кинетической энергией молекул идеального газа(уч.10кл.Стр.243-248)
- •Связь температуры со средней кинетической энергией частиц газа(уч.10кл.Стр.239-243)
- •Уравнение клайперона-менделеева(уч.10кл.Стр.248-251)
- •Универсальная газовая постоянная(уч.10кл.Стр.251- )
- •Жидкости и твердые тела основные положения (уч.10кл.Стр.307-308, 321-322)
- •Испарение и конденсация(уч.10кл.Стр.286-289,290-291)
- •Насыщенные и ненасыщенные пары(уч.10кл.Стр.286-291,292-293)
- •Влажность воздуха(уч.10кл.Стр.294-295,уч.8кл.Стр.46-47)
- •Кипение жидкости(уч.10кл.Стр.296-299,уч.8кл.Стр.44-45)
- •Поверхностное натяжение (уч.10кл.Стр.299-302)
- •Смачивание и каппилярность (уч.10кл.Стр.303-306)
- •Кристаллические и аморфные тела (уч.10кл.Стр.312-317)
- •Преобразование энергии при изменениях агрегатного состояния вещества(уч.10кл.Стр.218-224, 309-312,уч.8кл.Стр.48-50)
- •Измерение давления газа, влажности воздуха, температуры, плотности вещества
- •Основы электродинамики (уч.10кл.Стр.347 )
- •Электростатика основные положения (уч.10кл.Стр.376-377, 406-407)
- •Электризация тел(уч.10кл.Стр.350-352)
- •Электрический заряд(уч.10кл.Стр.347-349,356)
- •Взаимодействие зарядов(уч.10кл.Стр.347-349,)
- •Элементарный электрический заряд(уч.10кл.Стр.347-349)
- •Закон сохранения электрического заряда(уч.10кл.Стр.352-353)
- •Закон кулона(уч.10кл.Стр.354-362)
- •Электрическое поле
- •Напряженность электрического поля(уч.10кл.Стр.363-368, 374)
- •Электрическое поле точечного заряда(уч.10кл.Стр.363-365, 366-368)
- •Потенциальность электростатического поля(уч.10кл.Стр.378-381)
- •Разность потенциалов(уч.10кл.Стр.381-385)
- •Принцип суперпозиции полей(уч.10кл.Стр.368-375)
- •Проводники в электрическом поле(уч.10кл.Стр.392-396)
- •Электрическая емкость(уч.10кл.Стр.397-398 )
- •Конденсатор(уч.10кл.Стр.399-402)
- •Емкость плоского конденсатора(уч.10кл.Стр.400-402)
- •Диэлектрики в электрическом поле(уч.10кл.Стр.386-390)
- •Диэлектрическая проницаемость(уч.10кл.390-391)
- •Энергия электрического поля плоского конденсатора(уч.10кл.Стр.400-402, 403-406)
- •Постоянный электрический ток основные положения
- •Электрический ток
- •Сила тока
- •Напряжение
- •Носители свободных электрических зарядов в металлах, жидкостях и газах
- •Ток в газах
- •Ток в вакууме. Термоэлектронная эмиссия
- •Сопротивление проводников
- •Закон ома для участка цепи
- •Последовательное и параллельное соединение проводников
- •Электродвижущая сила
- •Работа и мощность тока. Кпд источника тока
- •Закон джоуля-ленца
- •Полупроводники основные положения
- •Проводимость полупроводников
- •Свободная и примесная проводимость полупроводников
- •Магнитное поле. Электромагнитная индукция основные положения
- •Взаимодействие магнитов
- •Магнитные свойства вещества. Магнитная проницаемость. Магнетики
- •Взаимодействие проводников с током
- •Магнитное поле
- •Действие магнитного поля на электрические заряды
- •Индукция магнитного поля. Поток магнитной индукции
- •Сила ампера
- •Сила лоренца
- •Электродвигатель (уч.8кл.Стр.143-145)
- •Электромагнитная индукция
- •Закон электромагнитной индукции фарадея-максвелла
- •Правило ленца
- •Вихревое электрическое поле
- •Самоиндукция (уч.11кл.Стр.123-126)
- •Индуктивность
- •Энергия магнитного поля
- •Измерение силы тока, напряжения, сопротивления проводника
- •Колебания и волны основные положения (уч.10кл. Стр.184-,345-346)
- •Механические колебания и волны основные положения ( уч.10кл.Стр.345-346)
- •Гармонические колебания (уч.10кл. Стр.69-70, уч.11кл.Стр.137)
- •Амплитуда, период и частота колебаний (уч.10кл. Стр.69-70)
- •Свободные колебания (уч.10кл. Стр.167-170)
- •Математический маятник (уч.10кл. Стр.167-172)
- •Период колебаний математического маятника (уч.10кл. Стр.167-172)
- •Превращения энергии при гармонических колебаниях
- •Вынужденные колебания (уч.10кл. Стр.167, 173-179)
- •Резонанс (уч.10кл. 177-183)
- •Понятие об автоколебаниях
- •Механические волны(уч.10кл.Стр.323-324)
- •Скорость распространения волны
- •Длина волны(уч.10кл.Стр.329)
- •Поперечные и продольные волны(уч.10кл.Стр.324-328)
- •Уравнение гармонической волны(уч.10кл.Стр.328-337)
- •Поляризация волн (уч.10кл.Стр.330-331)
- •Стоячие волны (уч.10кл.Стр.332-337)
- •Звук(уч.10кл.Стр.338-344)
- •Электромагнитные колебания и волны основные положения
- •Колебательный контур
- •Переменный электрический ток генератор переменного тока (уч.11кл.Стр.131)
- •Действующие значения силы тока и напряжения
- •Активное, емкостное и индуктивное сопротивления
- •Закон ома для переменного тока. Полное сопротивление цепи
- •Резонанс в электрической цепи
- •Трансформатор
- •Производство, передача и потребление электрической энергии (уч.11кл.Стр.134)
- •Идеи теории максвелла
- •Электромагнитные волны
- •Шкала электромагнитных волн
- •Скорость распространения электромагнитных волн
- •Свойства электромагнитный волн
- •Энергия электромагнитной волны
- •Принципы радиосвязи
- •Оптика основные положения
- •Принцип гюйгенса
- •Свет - электромагнитная волна
- •Прямолинейное распространение, отражение и преломление света
- •Законы преломления и отражения света
- •Показатель преломления
- •Полное внутреннее отражение
- •Предельный угол полного внутреннего отражения
- •Ход лучей в призме
- •Построение изображений в плоском зеркале
- •Собирающая и рассеивающая линзы
- •Формула тонкой линзы
- •Построение изображений в линзах (уч.11кл.Стр.243-249,257-259,
- •Оптические приборы
- •Фотоаппарат
- •Интерференция света
- •Зоны френеля
- •Когерентность
- •Дифракция света
- •Дифракционная решетка
- •Поляризация света. Поперечность световых волн
- •Дисперсия света
- •Поглощение света
- •Измерение фокусного расстояния собирающей линзы, показателя преломления вещества, длины волны света фотометрия .Световой поток. Освещенность
- •Спектры и спектральный анализ
- •Основы специальной теории относительности основные положения (уч.10кл.Стр.209)
- •Инвариантность скорости света (уч.10кл.Стр.186-187)
- •Принцип относительности эйнштейна (уч.10кл.Стр.186-189)
- •Пространство и время в специальной теории относительности (уч.10кл.Стр.186-205)
- •Связь массы и энергии (уч.10кл.Стр.205-209)
- •Квантовая физика основные положение (уч.10кл.Стр.227-228, уч.11кл.Стр. 345-346)
- •Тепловое излучение(уч.11кл.Стр.308-312)
- •Постоянная планка( уч.11кл.Стр.310)
- •Фотоэффект (уч.11кл.Стр.314-317)
- •Опыты столетова(уч.11кл.Стр.314)
- •Уравнение эйнштейна для фотоэффекта
- •Гипотеза луи де бройля(уч.11кл.Стр.322)
- •Дифракция электронов(уч.11кл.Стр.322-323)
- •Корпускулярно-волновой дуализм(уч.11кл.Стр.318-321,323-325)
- •Спектры(уч.11кл.Стр.336-339)
- •Люминесценция(уч.11кл.Стр.337-338)
- •Лазеры(уч.11кл.Стр.340-344)
- •1. Поглощение света
- •2. Спонтанное излучение
- •3. Индуцированное излучение
- •Ядерная физика основные положение (уч.10кл.Стр.227-228, уч.11кл.Стр.387-389,406)
- •Радиоактивность (уч.11кл.Стр.357-362,363-367)
- •Альфа-, бета-, гамма- излучения
- •Закон радиоактивного распада(уч.11кл.Стр.363-367)
- •Методы наблюдения и регистрации частиц в ядерной физике(уч.9кл.Стр.189-192)
- •Опыт резерфорда по рассеиванию альфа-частиц(уч.11кл.Стр.328)
- •Планетарная модель атома(уч.10кл.Стр.211-215,уч.11кл.Стр.329)
- •Модель атома резерфорда-бора. Квантовые постулаты бора(уч.11кл.Стр.330-336)
- •Нуклонная модель ядра (уч.10кл.Стр.211,уч.11кл.Стр.347)
- •Заряд ядра
- •Массовое число ядра
- •Энергия частиц в ядре. Энергия связи атомных ядер(уч.11кл.Стр.354-357)
- •Деление ядер. Цепная реакция(уч.11кл.Стр.367-372)
- •Синтез ядер(уч.11кл.Стр.378-383)
- •Ядерные реакции
- •Сохранение заряда и массового числа при ядерных реакциях
- •Выделение энергии при делении и синтезе ядер
- •Использование ядерной энергии(уч.11кл.Стр.373-377)
- •Дозиметрия. Биологическое действие ионизирующих излучений(уч.11кл.Стр.383- )
- •Элементарные частицы(уч.11кл.Стр.390-405)
- •Фундаментальные взаимодействия (уч.10кл.Стр.9-16)
- •Методы научного познания и физическая картина мира эксперимент и теория в процессе познания мира(уч.10кл.Стр.4-7)
- •Моделирование явлений и объектов природы (уч.10кл.Стр.7-9)
- •Научные гипотезы физические законы и границы их применимости(уч.10кл.Стр.9-16)
Измерение скорости молекул. Опыт штерна(уч.10кл.Стр.236)
См. определение идеального газа (уч.10кл.стр.222,229- )
Статистические методы исследования идеального газа.
Распределение молекул идеального газа по скоростям
Опыт Штерна
Распределение молекул по скоростям в опыте Штерна (график и его объяснение)
Наиболее вероятная скорость молекул
Наиболее простой моделью является идеальный газ, состоящий из материальных точек, между которыми отсутствуют силы, действующие на расстоянии, и которые сталкиваются между собой как упругие шары.
Подобная модель одинакова для всех разряженных газов.
Свойства различных разряженных газов не зависят от взаимодействия между отдельными молекулами.
Информация об отдельной частице не представляет практического интереса для описания поведения газа как целого.
Статистическая закономерность в теории идеального газа – закон поведения совокупности большого числа частиц.
Микроскопические параметры – параметры малых масштабов (масса молекулы, ее скорость, импульс, кинетическая энергия), характеризуют движение отдельной молекулы.
Макроскопические параметры – параметры больших масштабов (масса газа, давление, объем, температура), характеризуют свойства газа как целого.
Молекулы идеального газа в отсутствии внешних сил равномерно распределены в пространстве.
Равномерное распределение в пространстве молекул идеального газа является его наиболее вероятным состоянием.
В результате хаотических столкновений молекулы идеального газа изменяют не только направление своего движения, но и скорость. Ответить сколько частиц обладают определенной скоростью невозможно.
Интерес представляет распределение молекул по скоростям.
В 1920 г. О.Штерн поставил опыт по определению скорости молекул газа или пара.
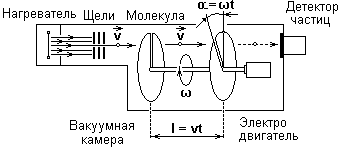
В нагревателе с поверхности серебряной проволоки, раскаленной электрическим током, испаряются атомы вещества. Попадая из нагревателя через отверстие в вакуумную камеру, молекулы пара с помощью системы щелей формируются в узкий пучок, направленный в сторону двух дисков, вращающихся с угловой скоростью ω. Диски используются для сортировки молекул по скоростям. Угол между прорезями в дисках α. Расстояние между дисками l в процессе эксперимента не изменяется.
Для того чтобы молекула пара (газа) попала на приемник детектора частиц, она должна пройти через прорези в дисках. Для этого время прохождения молекулы между дисками должно быть равно времени поворота прорези второго диска на угол α.
t = t = v = ω
Угол прорезей ∆α в дисках конечен, поэтому через них будут проходить молекулы, скорость которых лежит в интервале от v до v + ∆v, где ∆v = v
Анализ данных опыта Штерна позволяет найти распределение молекул по скоростям.
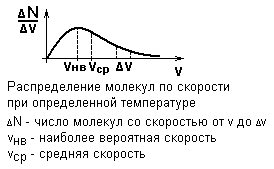
На графике изображена зависимость числа молекул, приходящихся на единичный интервал скоростей, от скорости, которой они обладают.
Максимум ∆N/∆v означает, что большинство молекул обладают такой скоростью.
Наиболее вероятная скорость – скорость, которой обладает максимальное число молекул.
Полученное распределение характерно для многих массовых процессов, характеризующихся внутренней неупорядоченностью, хаотичностью.
Выбирая определенный интервал скоростей ∆v, можно найти среднюю скорость молекул.
= =
Вычисления показывают, что средняя скорость молекул превышает наиболее вероятную.
> vн.в.
Скорость молекул газа:
Зная абсолютную температуру, можно найти среднюю кинетическую энергию молекул газа, а , следовательно, и средний квадрат их скорости.
![]()
Квадратный корень из этой величины называется средней квадратичной скоростью:
=
Опыты по определению скоростей молекул доказали справедливость этой формулы.
