
- •Часть 2
- •Оглавление
- •Предисловие
- •Занятие №10
- •Содержание занятия
- •Вопросы и упражнения для подготовки к занятию
- •Образец билета входного тест-контроля
- •Информационная часть
- •Разбор типовых задач
- •Практическая работа
- •Образец билета выходного контроля
- •Домашнее задание
- •Занятие №11
- •Содержание занятия
- •Вопросы и упражнения для подготовки к занятию
- •Образец билета входного тест-контроля
- •Информационная часть
- •Разбор типовых задач
- •Лабораторная работа
- •Ситуационные задачи для контроля усвоения темы
- •Образец билета выходного контроля
- •Домашнее задание
- •Занятие №12
- •Содержание занятия
- •Вопросы и упражнения для подготовки к занятию
- •Образец билета входного тест-контроля
- •Информационная часть
- •Разбор типовых задач
- •Лабораторная работа
- •Ситуационные задачи для контроля усвоения темы
- •Домашнее задание
- •Занятие №13
- •Содержание занятия
- •Вопросы для подготовки к занятию
- •Образец билета входного тест-контроля
- •Информационная часть
- •Разбор типовых задач
- •Лабораторная работа
- •Ситуационные задачи для контроля усвоения темы
- •Типовые задачи к рубежной контрольной работе по III блоку
- •Образец I части билета рубежного контроля по III блоку
- •Образец II части билета рубежного контроля по III блоку
- •Домашнее задание
- •Занятие №15
- •Содержание занятия
- •Вопросы и задачи для подготовки к занятию
- •Образец билета входного тест-контроля
- •Информационная часть
- •Разбор типовых задач
- •Лабораторная работа
- •Ситуационные задачи для контроля усвоения темы
- •Домашнее задание
- •Занятие №16
- •Содержание занятия
- •Вопросы и задачи для подготовки к занятию
- •Образец билета входного тест-контроля
- •Информационная часть
- •Разбор типовых задач
- •Лабораторная работа
- •Ситуационные задачи для контроля усвоения темы
- •Домашнее задание
- •Занятие №17
- •Содержание занятия
- •Вопросы и задачи для подготовки к занятию
- •Образец билета входного тест-контроля
- •Информационная часть
- •Разбор типовых задач
- •Лабораторная работа
- •Общий вид рН-метра 150ми
- •Ситуационные задачи для контроля усвоения темы
- •Домашнее задание
- •Занятие №18
- •Содержание занятия
- •Вопросы к рубежной контрольной работе по IV блоку
- •Типовые задачи к рубежной контрольной работе по IV блоку
Разбор типовых задач
1. Вычислите температуру замерзания водного раствора рибозы с массовой долей 2%
Решение. Рибоза – неэлектролит, поэтому согласно уравнению Тзам=Ккр∙Сm, где Ккр(Н2О)=1,86 Ккг/моль, найдем моляльную концентрацию 2% раствора рибозы
Сm=
Для 2%-ного раствора а=2, b=98, М(С5Н10О5)=150 г/моль.
Тогда Сm=0,136 моль/кг.
Депрессия будет Тзам=1,86 Ккг/моль 0,136 моль/кг = 0,253о К.
Откуда Тзамерзания раствора=Тзамерзания воды - Тзам=0о С – 0,253о С = -0,253о С
Ответ: Тзамерзания раствора = -0,253о С
2. В качестве плазмозамещающего раствора применяется раствор Рингера-Локка, имеющий пропись:
Натрия хлорид 0,9 г
Калия хлорид 0,02 г
Кальция хлорид 0,02 г
Натрия гидрокарбонат 0,02 г
Глюкоза 0,1 г
Вода для инъекций до 100 мл.
Вычислите осмотическое давление, создаваемое этим раствором при 25о С.
Решение: Считая, что осмотическое давление этого раствора аддитивно складывается из осмотических давлений создаваемых каждый компонентом раствора, имеем:
Росм=Р1+Р2+Р3+Р4+Р5
Для глюкозы осмотическое давление рассчитывается по формуле:
Р=RCT
Для электролитов – по формуле:
Р=iRCT
Найдем молярные концентрации компонентов раствора:
С![]() =
=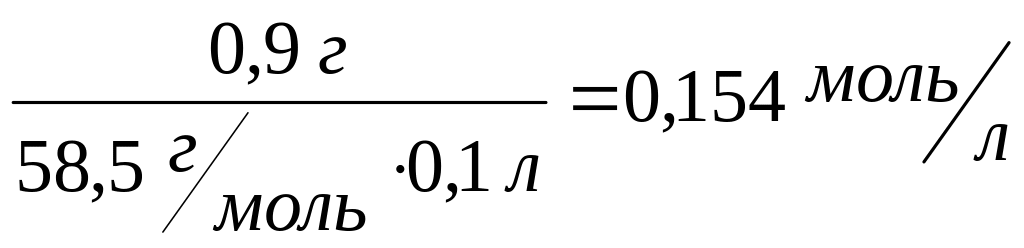
С![]() =
=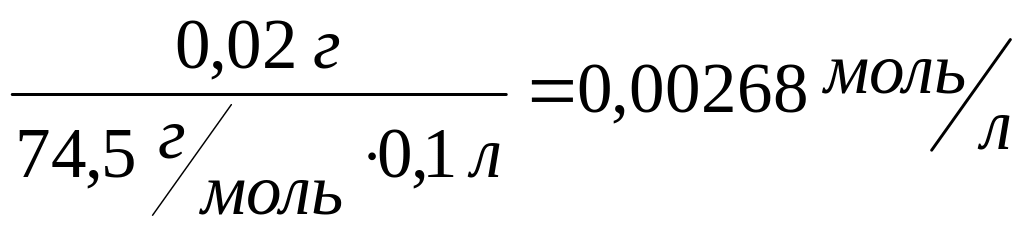
С![]() =
=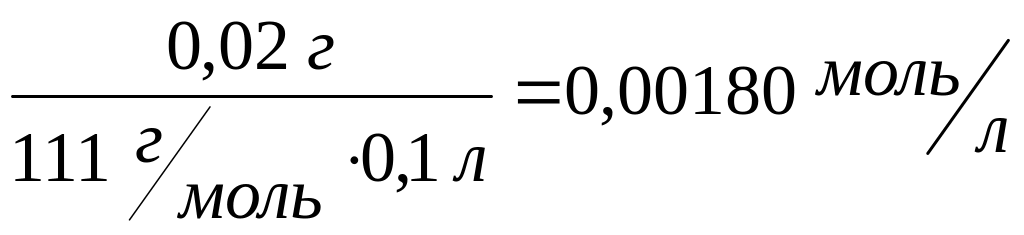
С![]() =
=
С![]() =
=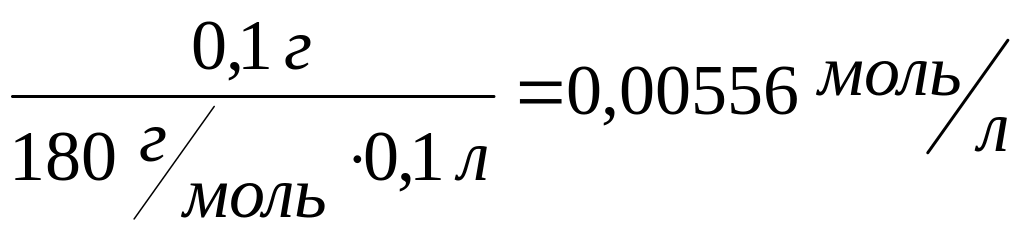
Т= 273о + 25о С = 298о К
R = 8,31 Дж/мольК.
В первом приближении учтем, что =1, т.е., все молекулы электролитов полностью диссоциированы и ионы не взаимодействуют друг с другом. Тогда из соотношения i = 1 + (n – 1) для NaCl, KCl и NaHCO3 имеем i=2, для СаС12: i = 1 + 1(3 - 1) = 3.
Подставляем это значение в первое уравнение:
Росм = Р + Р + Р + Р + Р =
= 28,310,154298 + 28,310,00268298 + 38,310,00180298 +
+ 28,310,00238298 + 8,310,00556298 =
= 8,31298(0,308 + 0,00536 + 0,00540 + 0,00476 + 0,00556) =
= 2476,380,32908 = 814,93 кПа
Ответ: 814,93 кПа.
3. Водный раствор магния хлорида с концентрацией 0,1 моль/л имеет при 298о К осмотическое давление 691 кПа. Вычислите изотонический коэффициент магния хлорида и степень его диссоциации в этом растворе.
Решение: Согласно уравнению закона Вант-Гоффа для электролитов имеем
Росм=iRCT,
откуда
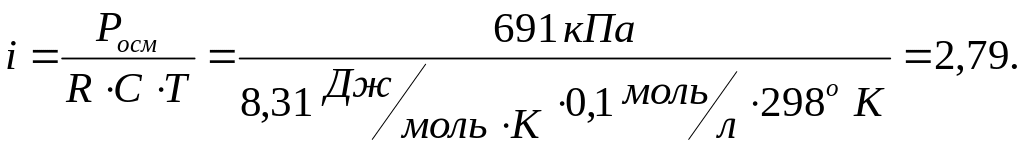
Учитывая, что
![]() ,
,
где для MgCl2 n=3, найдем .
![]()
Ответ: i=2,79; =0,895.
4. Вычислите молярную массу неэлектролита, если известно, что температура кипения раствора, содержащего 1 г этого вещества в 20 г диоксана, равна 101,9о С, а температура кипения чистого диоксана равна 100,8о С.
Решение: Для неэлектролита согласно следствию из закона Рауля имеем:
Ткип=Еэб∙Сm,
где Еэб для диоксана равна 3,2
Ткип = Траствора – Тдиоксана = 101,9 – 100,8 = 1,1о К,
тогда
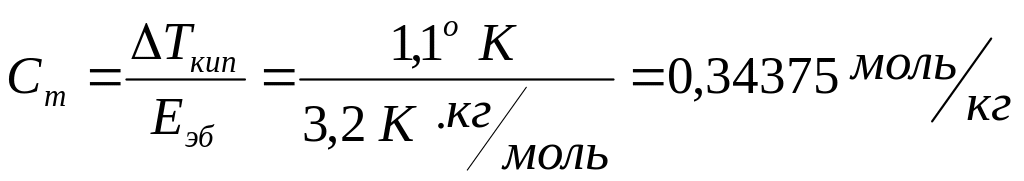
Согласно соотношению
![]()
имеем:
![]()
Ответ: Мнеэлектролита
= 145,5
![]()
Практическая работа
Ответьте на поставленные вопросы и решите следующие задачи исходя из законов Рауля и Вант-Гоффа:
1) Разбавленные растворы сахарозы и глюкозы имеют равные массовые доли воды. Какой из этих растворов будет кипеть при более высокой температуре? Ответ обосновать.
2) Как будет меняться во времени осмотическое давление раствора, в котором происходит ферментативный гидролиз дипептида? Ответ обосновать.
3) Водные растворы мочевины и сахарозы разделены полупроницаемой мембраной. Направленного переноса растворителя через мембрану не происходит. Какой их растворов имеет большее значение массовой доли растворенного вещества? Ответ обосновать.
4) Объясните, почему водный раствор мочевины кипит при температуре выше 100о С, а водный раствор этанола – при температуре ниже 100о С при равных массовых долях растворенных веществ?
5) Молярная концентрация мочевины в ее бензольном растворе равна молярной концентрации мочевины в ее водном растворе. Какой раствор – водный или бензольный – имеет большее значение величины депрессии? Ответ обосновать.
6) Выведите молекулярную формулу эритрозы, имеющей состав Сn(Н2О)n, если известно, что водный раствор, содержащий 10 г эритрозы в 1 кг воды, замерзает при -0,155о С.
7) Опишите поведение эритроцитов при 310о К в растворе мочевины с молярной концентрацией 0,3 моль/л.
8) У человека осмолярность интерстициальной жидкости повышается с 0,3 осмоль/л в корковом веществе до 1,2 осмоль/л в сосочке нефрона. Вычислите, как изменяется при этом осмотическое давление.
9) Плазме крови изотоничен раствор хлорида натрия с массовой долей 0,9%. Плотность этого раствора равна 1,005 г/мл. Вычислите изотонический коэффициент и степень диссоциации хлорида натрия в таком растворе.
10) Рассчитайте осмотическое давление, которое создает «Квартасоль» (плазмозамещающий раствор), при температуре 37о С, если принять степени диссоциации солей 0,8; 0,85; 0,75 и 0,9 в порядка их перечисления. Состав «Квартасоль»:
Натрия хлорид 0,475 г
Калия хлорид 0,15 г
Натрия ацетат 0,26 г
Натрия гидрокарбонат 0,1
Вода для инъекций до 100 мл
