
- •Часть 2
- •Оглавление
- •Предисловие
- •Занятие №10
- •Содержание занятия
- •Вопросы и упражнения для подготовки к занятию
- •Образец билета входного тест-контроля
- •Информационная часть
- •Разбор типовых задач
- •Практическая работа
- •Образец билета выходного контроля
- •Домашнее задание
- •Занятие №11
- •Содержание занятия
- •Вопросы и упражнения для подготовки к занятию
- •Образец билета входного тест-контроля
- •Информационная часть
- •Разбор типовых задач
- •Лабораторная работа
- •Ситуационные задачи для контроля усвоения темы
- •Образец билета выходного контроля
- •Домашнее задание
- •Занятие №12
- •Содержание занятия
- •Вопросы и упражнения для подготовки к занятию
- •Образец билета входного тест-контроля
- •Информационная часть
- •Разбор типовых задач
- •Лабораторная работа
- •Ситуационные задачи для контроля усвоения темы
- •Домашнее задание
- •Занятие №13
- •Содержание занятия
- •Вопросы для подготовки к занятию
- •Образец билета входного тест-контроля
- •Информационная часть
- •Разбор типовых задач
- •Лабораторная работа
- •Ситуационные задачи для контроля усвоения темы
- •Типовые задачи к рубежной контрольной работе по III блоку
- •Образец I части билета рубежного контроля по III блоку
- •Образец II части билета рубежного контроля по III блоку
- •Домашнее задание
- •Занятие №15
- •Содержание занятия
- •Вопросы и задачи для подготовки к занятию
- •Образец билета входного тест-контроля
- •Информационная часть
- •Разбор типовых задач
- •Лабораторная работа
- •Ситуационные задачи для контроля усвоения темы
- •Домашнее задание
- •Занятие №16
- •Содержание занятия
- •Вопросы и задачи для подготовки к занятию
- •Образец билета входного тест-контроля
- •Информационная часть
- •Разбор типовых задач
- •Лабораторная работа
- •Ситуационные задачи для контроля усвоения темы
- •Домашнее задание
- •Занятие №17
- •Содержание занятия
- •Вопросы и задачи для подготовки к занятию
- •Образец билета входного тест-контроля
- •Информационная часть
- •Разбор типовых задач
- •Лабораторная работа
- •Общий вид рН-метра 150ми
- •Ситуационные задачи для контроля усвоения темы
- •Домашнее задание
- •Занятие №18
- •Содержание занятия
- •Вопросы к рубежной контрольной работе по IV блоку
- •Типовые задачи к рубежной контрольной работе по IV блоку
Разбор типовых задач
1. Вычислить рН раствора уксусной кислоты с концентрацией 0,04 моль/л, если степень диссоциации равна 0,9.
Решение:
СН3СООН СН3СОО- + Н+
[H+] = C = 0,04 0,9 = 0,036 моль/л.
рН = -lg[Н+] = -lg3,610-2 = 2 – 0,56 = 1,44
2. Смешали два раствора: НС1 объемом 50 мл с концентрацией 0,2 моль/л и NaOH объемом 75 мл с концентрацией 0,15 моль/л. Вычислите рН полученного раствора.
Решение: При смешивании кислоты и щелочи идет реакция нейтрализации:
HCl + NaOH = NaCl + H2O
Рассчитаем моли каждого вещества: nHCl = 0,2 50 = 10 ммоль,
nNaOH = 0,15 75 = 11,25 ммоль.
NaOH находится в избытке, следовательно, среда будет щелочной.
nNaOH = 11,25 – 10 = 1,25 ммоль.
Концентрация NaOH в полученном растворе будет:
![]() .
.
рН = 14 + lgCNaOH = 14 + lg0,01 = 14 – 2 = 12.
3. Как изменится рН, если в 1 л дистиллированной воды внести 0,01 моль NH4Cl?
Решение: рН дистиллированной воды равен 7. При растворении NH4Cl происходит обратимый гидролиз соли по катиону:
NH4Cl + H2O NH4OH + HCl или
NH + H2O NH4OH + H+
Среда становится более кислой.
При гидролизе по катиону расчет рН ведем по формуле:
рН = 7 – 0,5рК![]() -
0,5lgC
-
0,5lgC![]()
Из таблицы находим рК = 4,75.
рН = 7 – 0,5 4,75 – 0,5lg0,01 = 7 – 2,375 + 1 5,6.
Итак, рН измениться от 7 до 5,6, т.е. на рН = 7 – 5,6 = 1,4 единиц.
4. Оцените рН раствора, полученного растворением 0,53 г Na2CO3 в 10 л воды.
Решение: Найдем концентрацию Na2CO3 в полученном растворе:
, где
М![]() =106
г/моль
=106
г/моль
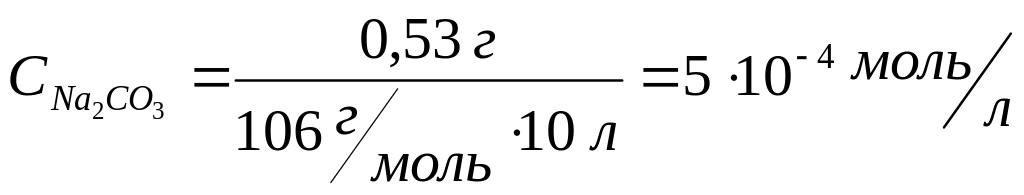
Гидролиз Na2CО3 протекает в 2 стадии:
Na2CО3 + H2O NaHCO3 + NaOH
NaHCO3 + H2O NaOH + H2CO3
Т.к., рК1 рК2 , учтем только первую стадию гидролиза.
рН = 7 + 0,5рК2 + 0,5lgС
Из таблицы найдем рК2 =10,33.
рН = 7 + 0,5 10,33 + 0,5lg510-4 = 7 + 5,165 – 0,5 3,3 = 10,5.
5. Вычислите константу и степень гидролиза СН3СООNH4 и рН этого раствора.
Решение: Гидролиз СН3СООNH4 идет одновременно по катиону и по аниону.
CH3COONH4 + H2O CH3COOH + NH4OH
Константа гидролиза рассчитывается по формуле:
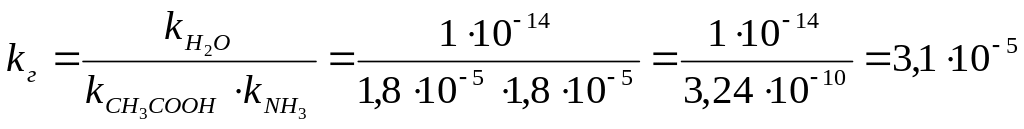
Степень гидролиза в этом случае рассчитывается по формуле:
![]()
рН рассчитываем по формуле:
рН = 7 + 0,5рК![]() - 0,5рК
=
7 + 0,5
4,75 – 0,5
4,75 = 7.
- 0,5рК
=
7 + 0,5
4,75 – 0,5
4,75 = 7.
Лабораторная работа
Задание 1. Определение рН водных растворов слабых и сильных кислот и оснований колориметрическим способом (при помощи универсальной индикаторной бумаги).
В 5 пробирок внесите по 5 мл растворов HCl, NaOH, KNO3, CH3COOH и NH3. В каждую из них опустите полоску универсальной индикаторной бумаги и сравнивая окраску бумаги со шкалой запишите значение рН каждого раствора. Пользуясь соответствующими расчетными формулами рассчитайте рН этих растворов и сравните экспериментально определенные значения с расчетными.
Задание 2. Определение рН в водных растворах солей.
В шесть пробирок внесите по 5 мл растворов Na2CO3, NH4Cl, Na2SO4, KNO3, CH3COONa и дистиллированный воды. В каждую пробирку опустите по полоске универсальной индикаторной бумаги и сравнивая со шкалой запишите значения рН всех растворов. Для растворов Na2CO3 и CH3COONa добавьте по 2 капли раствора фенолфталеина, а в раствор NH4Cl еще опустите синюю лакмусовую бумагу. Свои наблюдения занесите в протокол лабораторной работы. В каких случаях происходил гидролиз солей? Напишите молекулярные и ионные уравнения гидролиза соответствующих солей, в случае Na2CO3 покажите ступенчатый гидролиз этой соли. Для солей NH4Cl, CH3COONa и Na2CO3 (по первой ступени) рассчитайте рН гидролиза этих солей в воде, и сравнивая значения рассчитанных величин с экспериментально определенными, сделайте выводы.
Задание 3. Изучение влияния температуры на степень гидролиза солей.
В пробирку налейте 5 мл раствора CH3COONa и добавьте 2 капли раствора фенолфталеина. Пользуясь держалкой нагрейте содержимое пробирки на пламени спиртовки. Наблюдайте за изменением интенсивности окраски индикатора. Затем содержимое пробирки охладите под струей холодной воды. Что происходит? Сделайте вывод о влиянии температуры на степень гидролиза этой соли. Рассчитайте степень и константу гидролиза СН3СООNa, пользуясь табличными значениями k и k .
Задание 4. Изучение совместного гидролиза солей.
В одну пробирку налейте 3 мл раствора Al2(SO4)3, в другую – 3 мл раствора Na2CO3. Соедините содержимое двух пробирок и внимательно следите за изменениями в пробирке. Какой газ, и какой осадок выделяются в ходе реакции? Напишите молекулярное и ионное уравнения реакций совместного гидролиза этих солей. Почему в этом случае гидролиз приобретает необратимый характер? Полученный осадок разделите на 2 части: в одну добавьте раствор NaOH, в другую раствор НС1. Почему в обоих случаях осадок растворяется? Напишите молекулярные и ионные уравнения растворения Al(OH)3 в NaOH и HCl.
