
- •Часть 2
- •Оглавление
- •Предисловие
- •Занятие №10
- •Содержание занятия
- •Вопросы и упражнения для подготовки к занятию
- •Образец билета входного тест-контроля
- •Информационная часть
- •Разбор типовых задач
- •Практическая работа
- •Образец билета выходного контроля
- •Домашнее задание
- •Занятие №11
- •Содержание занятия
- •Вопросы и упражнения для подготовки к занятию
- •Образец билета входного тест-контроля
- •Информационная часть
- •Разбор типовых задач
- •Лабораторная работа
- •Ситуационные задачи для контроля усвоения темы
- •Образец билета выходного контроля
- •Домашнее задание
- •Занятие №12
- •Содержание занятия
- •Вопросы и упражнения для подготовки к занятию
- •Образец билета входного тест-контроля
- •Информационная часть
- •Разбор типовых задач
- •Лабораторная работа
- •Ситуационные задачи для контроля усвоения темы
- •Домашнее задание
- •Занятие №13
- •Содержание занятия
- •Вопросы для подготовки к занятию
- •Образец билета входного тест-контроля
- •Информационная часть
- •Разбор типовых задач
- •Лабораторная работа
- •Ситуационные задачи для контроля усвоения темы
- •Типовые задачи к рубежной контрольной работе по III блоку
- •Образец I части билета рубежного контроля по III блоку
- •Образец II части билета рубежного контроля по III блоку
- •Домашнее задание
- •Занятие №15
- •Содержание занятия
- •Вопросы и задачи для подготовки к занятию
- •Образец билета входного тест-контроля
- •Информационная часть
- •Разбор типовых задач
- •Лабораторная работа
- •Ситуационные задачи для контроля усвоения темы
- •Домашнее задание
- •Занятие №16
- •Содержание занятия
- •Вопросы и задачи для подготовки к занятию
- •Образец билета входного тест-контроля
- •Информационная часть
- •Разбор типовых задач
- •Лабораторная работа
- •Ситуационные задачи для контроля усвоения темы
- •Домашнее задание
- •Занятие №17
- •Содержание занятия
- •Вопросы и задачи для подготовки к занятию
- •Образец билета входного тест-контроля
- •Информационная часть
- •Разбор типовых задач
- •Лабораторная работа
- •Общий вид рН-метра 150ми
- •Ситуационные задачи для контроля усвоения темы
- •Домашнее задание
- •Занятие №18
- •Содержание занятия
- •Вопросы к рубежной контрольной работе по IV блоку
- •Типовые задачи к рубежной контрольной работе по IV блоку
Разбор типовых задач
1. Из раствора комплексной соли PtCl46NH3 нитрат серебра осаждает весь хлор в виде AgCl, а из раствора соли PtCl43NH3 – только ¼ часть входящего в ее состав хлора. Написать координационные формулы этих солей, определить координационное число платины в каждой из них.
Решение: Ионы серебра могут осаждать только те ионы хлора, которые связаны ионогенно с комплексным соединением, т.е. находятся во внешней сфере комплекса. В первом случае все 4 иона хлора находятся во внешней сфере:
[Pt(NH3)6]Cl4 + 4AgNO3 = 4AgCl + [Pt(NH3)6](NO3)4
Во втором случае из четырех ионов хлора только один находится во внешней сфере, остальные три координарованы вокруг комплексообразователя Pt4+ и связаны ковалентной связью. Тогда состав комплекса будет иметь вид: [Pt(NH3)3Cl3]Cl. Реакция с AgNO3 протекает по схеме:
[Pt(NH3)Cl3]Cl + AgNO3 = AgCl + [Pt(NH3)Cl3]NO3
В обоих комплексах Pt4+ имеет координационное число равное 6.
2. Константа нестойкости иона [Ag(NH3)2]+ составляет 9,310-8. Вычислите концентрацию ионов серебра в 0,05 молярном растворе [Ag(NH3)2]NO3, содержащем 0,5 моль/л NH3.
Решение: Вторичная диссоциация комплексного иона протекает по уравнению:
[Ag(NH3)2]+ Ag+ + 2 NH3
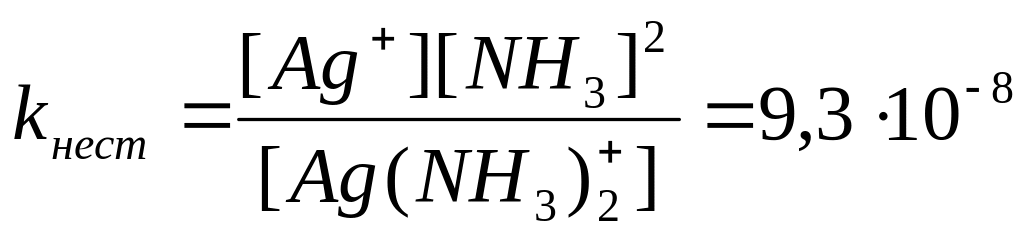
В присутствии
избытка NH3
равновесие диссоциации сильно смещено
влево. В таком случае можно принять, что
[NH3]
0,5 моль/л и [Ag(NH3)![]() ]
0,05 моль/л.
]
0,05 моль/л.
Из выражения константы нестойкости имеем:

3. Установить, в каких случаях произойдет взаимодействие между растворами указанных электролитов. Написать уравнение реакций в молекулярной и ионно-молекулярной форме.
а) K2[HgJ4] + KBr
б) K2[HgCl4] + KCN
в) K[Ag(NO2)2] + NH3
Решение:
а) Взаимодействие между комплексом и простым электролитом происходит, если при этом образуется более прочное комплексное соединение.
kнест = [HgJ4]2- = 1,510-30; kнест = [HgBr4]2- = 110-21.
Сравнивая эти величины видим, что йодидный комплекс более прочный, чем бромидный. Поэтому первая реакция не идет.
б) kнест = [Hg(CN)4]2- = 4,910-42; kнест = [HgCl4]2- = 8,510-16.
Как видно цианидный комплекс ртути (II) более прочный, чем хлоридный. Поэтому реакция идет слева направо.
K2[HgCl4] + 4KCN = K2[Hg(CN)4] + 4KCl
или [HgCl4]2- + 4CN- = [Hg(CN)4]2- + 4Cl-
в) kнест = [Ag(NO2)2] - = 1,810-3; kнест = [Ag(NH3)2]+ = 9,310-8.
Аммиачный комплекс более прочный, чем нитритный, поэтому реакция идет слева направо.
K[Ag(NO2)2] + 2NH3 = [Ag(NH3)2]NO2 + KNO2
или [Ag(NO2)2]- + 2NH3 = [Ag(NH3)2]+ + 2NO
Лабораторная работа
Задание 1. Получение комплексных соединений.
В пробирку налейте 1 мл раствора сульфата меди (II) и по каплям добавьте 10%-ный раствор аммиака. Наблюдайте выпадение осадка, а затем его растворение и изменение цвета раствора при образовании комплексного сульфата тетраамминмеди (II). Напишите уравнения реакции в молекулярном и ионно-молекулярном видах и выражение константы нестойкости.
В пробирку с 0,5 мл раствора нитрата висмута прибавьте по каплям йодид калия до выпадения темно-бурого осадка йодида висмута. Добавляя избыток калия йодида растворите полученный осадок. Напишите уравнение реакции и выражение константы нестойкости полученного комплекса и назовите его.
В две пробирки внесите по 0,5 мл раствора FeCl3. Одну оставьте для контроля, в другую по каплям прибавьте раствор щелочи до выпадения осадка Fe(OH)3. К образовавшемуся осадку добавьте 1 мл раствора щавелевой кислоты. Наблюдайте растворение осадка и цвет раствора. Затем в контрольную пробирку и в пробирку, где находится оксалатный комплекс Fe(III) добавьте 1-2 капли 0,01 М раствора роданида калия. В обеих ли пробирках наблюдается окрашивание? Напишите уравнения протекающих реакций и покажите строение внутрикомплексного соединения. Почему такие соединения называют хелатами? Какой комплекс Fe(III) прочнее: оксалатный или роданидный? Из справочника возьмите величины констант нестойкости и объясните, почему при добавлении KCNS к оксалатному комплексу раствор не окрасился?
Задание 2. Диссоциация и разрушение комплексных соединений.
В пробирку налейте 5 капель 0,1%-ного раствора AgNO3, добавьте равное количество раствора NaCl. Наблюдайте образование белого творожистого осадка. К образовавшемуся осадку добавьте 0,5 мл 10%-ного раствора аммиака. Наблюдайте растворение осадка. Напишите уравнение реакции образования комплекса и его диссоциацию. Выразите константу нестойкости и назовите комплексное соединение.
В пробирку с полученным комплексом по каплям добавьте HNO3 до выпадения осадка. Почему разрушилось комплексное соединение? Для объяснения этого явления пользуйтесь величинами констант нестойкости: kнест[Ag(NH3)2]+ = 9,310-8 и kнест[NH ] = 5,610-10.
Задание 3. Изучение окислительно-восстановительных свойств комплексных ионов.
В пробирку налейте 1 мл раствора K4[Fe(CN)6], добавьте равный объем серной кислоты. К полученному раствору по каплям добавляйте раствор KMnO4. Наблюдайте обесцвечивание KMnO4. Реакцией с FeSO4 докажите образование комплекса K3[Fe(CN)6]. Напишите молекулярное уравнение реакции и уравняйте методом электронного баланса.
Получите комплексное соединение [Ag(NH3)2]Cl как было указано в задании 2. К этому раствору опустите кусочек металлического цинка. Через 3 минуты достаньте кусочек и обратите внимание на его цвет. Какая реакция протекала между металлическим цинком и комплексом? Напишите уравнение реакции и объясните протекание этой реакции исходя из стандартных потенциалов систем:
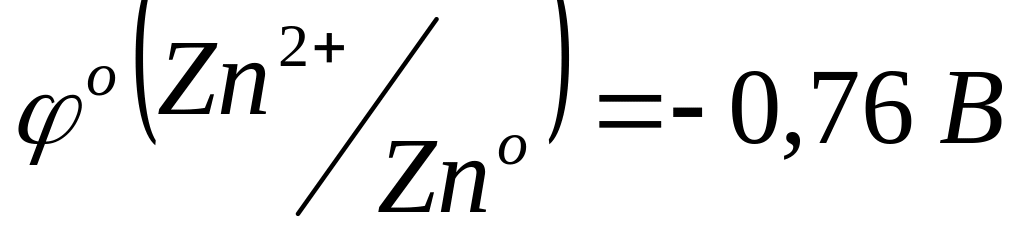 ;
;
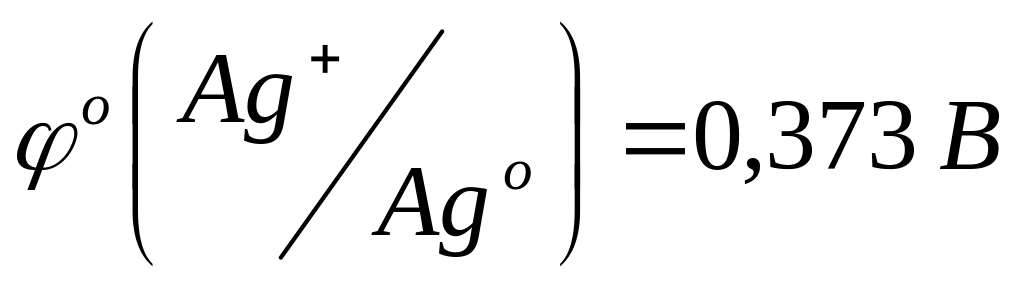 (для аммиачного комплекса).
(для аммиачного комплекса).
