
- •Часть 2
- •Оглавление
- •Предисловие
- •Занятие №10
- •Содержание занятия
- •Вопросы и упражнения для подготовки к занятию
- •Образец билета входного тест-контроля
- •Информационная часть
- •Разбор типовых задач
- •Практическая работа
- •Образец билета выходного контроля
- •Домашнее задание
- •Занятие №11
- •Содержание занятия
- •Вопросы и упражнения для подготовки к занятию
- •Образец билета входного тест-контроля
- •Информационная часть
- •Разбор типовых задач
- •Лабораторная работа
- •Ситуационные задачи для контроля усвоения темы
- •Образец билета выходного контроля
- •Домашнее задание
- •Занятие №12
- •Содержание занятия
- •Вопросы и упражнения для подготовки к занятию
- •Образец билета входного тест-контроля
- •Информационная часть
- •Разбор типовых задач
- •Лабораторная работа
- •Ситуационные задачи для контроля усвоения темы
- •Домашнее задание
- •Занятие №13
- •Содержание занятия
- •Вопросы для подготовки к занятию
- •Образец билета входного тест-контроля
- •Информационная часть
- •Разбор типовых задач
- •Лабораторная работа
- •Ситуационные задачи для контроля усвоения темы
- •Типовые задачи к рубежной контрольной работе по III блоку
- •Образец I части билета рубежного контроля по III блоку
- •Образец II части билета рубежного контроля по III блоку
- •Домашнее задание
- •Занятие №15
- •Содержание занятия
- •Вопросы и задачи для подготовки к занятию
- •Образец билета входного тест-контроля
- •Информационная часть
- •Разбор типовых задач
- •Лабораторная работа
- •Ситуационные задачи для контроля усвоения темы
- •Домашнее задание
- •Занятие №16
- •Содержание занятия
- •Вопросы и задачи для подготовки к занятию
- •Образец билета входного тест-контроля
- •Информационная часть
- •Разбор типовых задач
- •Лабораторная работа
- •Ситуационные задачи для контроля усвоения темы
- •Домашнее задание
- •Занятие №17
- •Содержание занятия
- •Вопросы и задачи для подготовки к занятию
- •Образец билета входного тест-контроля
- •Информационная часть
- •Разбор типовых задач
- •Лабораторная работа
- •Общий вид рН-метра 150ми
- •Ситуационные задачи для контроля усвоения темы
- •Домашнее задание
- •Занятие №18
- •Содержание занятия
- •Вопросы к рубежной контрольной работе по IV блоку
- •Типовые задачи к рубежной контрольной работе по IV блоку
Образец билета входного тест-контроля
1. Кислотами по Бренстенду-Лоури являются:
А) NaHSO4 Б) H2S В) Zn(OH)2
Г) KOH Д) Fe(OH)SO4 Е) NH4Cl
Ответ: А,Б,В,Е.
2. Наиболее сильным основанием является:
А) NH3H2O Б) Zn(OH)2 В) Ca(OH)2
Г) Mg(OH)2 Д) NH2CH2COOH Е) H2O
Ответ: В.
3. Степень гидролиза Na2SO3 по первой ступени рассчитывается по формуле:
А)
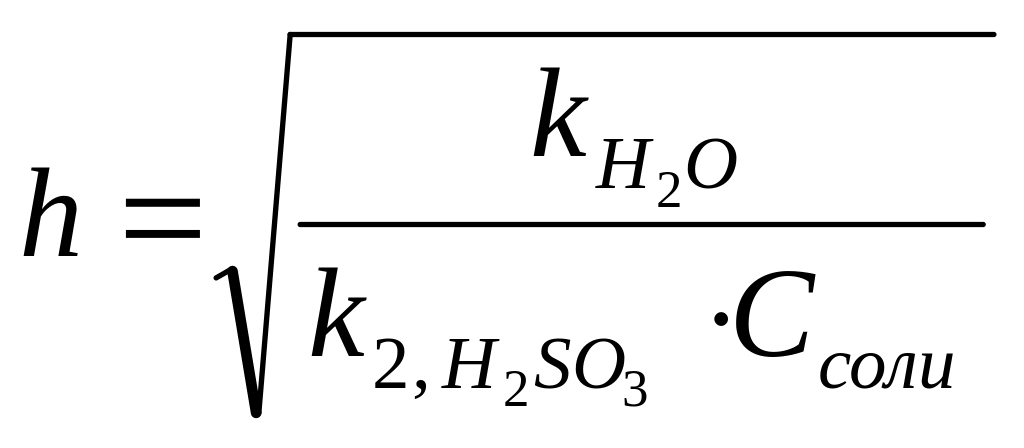 Б)
Б)
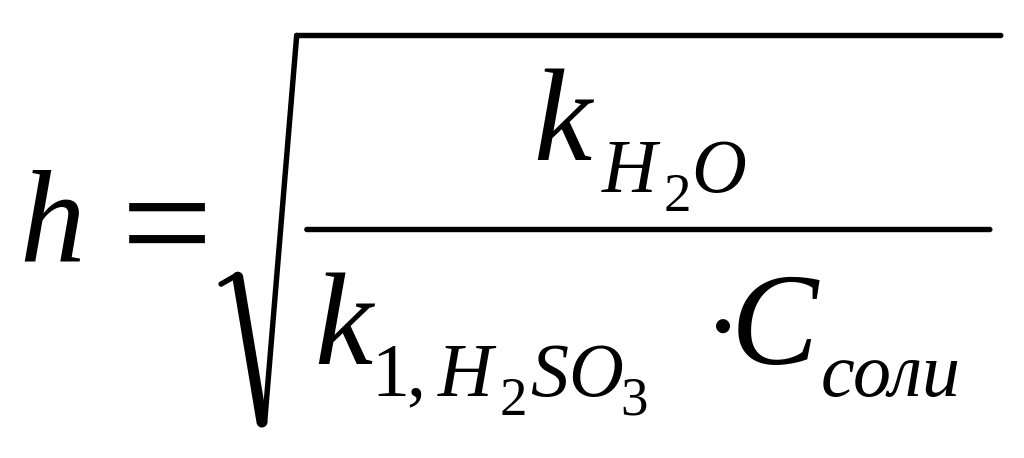 В)
В)
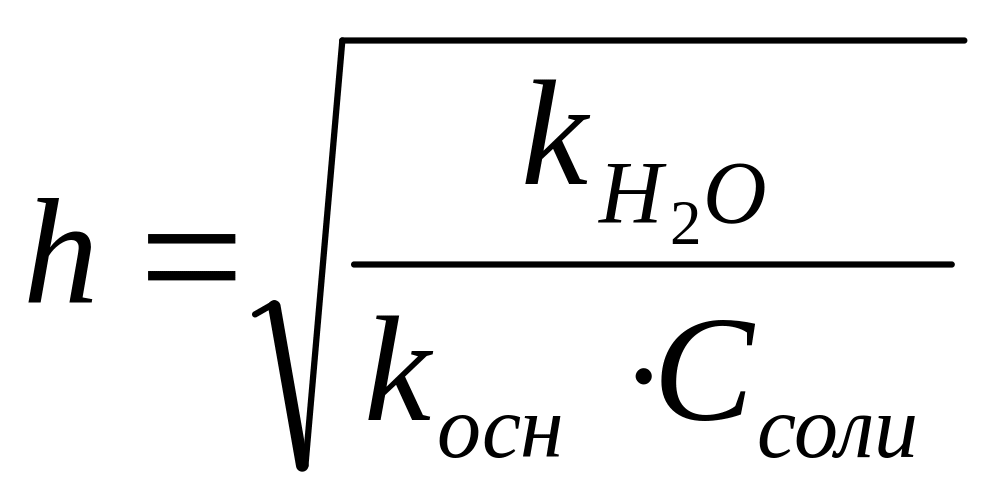
Г)
 Д)
Д)
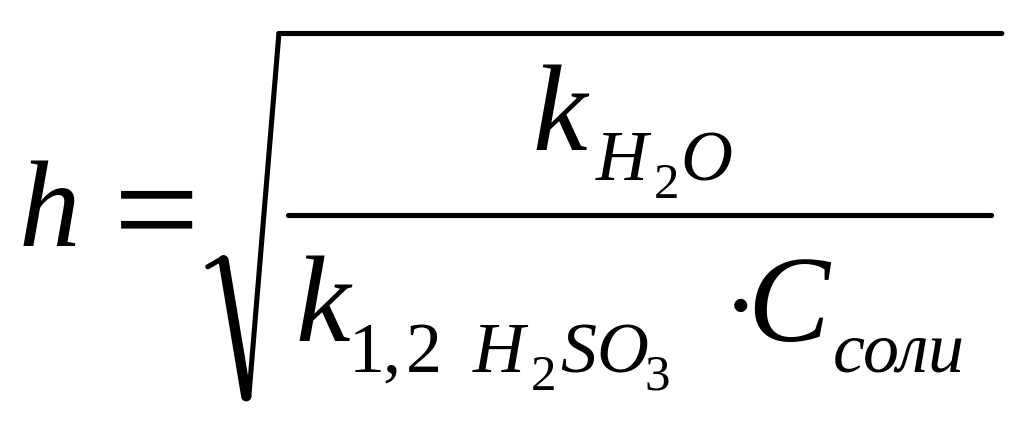 Е)
Е)

Ответ: А.
4. 0,01 м раствор LiOH создает рН:
А) 2 Б) 7 В) 12 Г) 0 Д) 14
Ответ: В.
5. Наиболее сильно подвергается гидролизу:
А) CH3COONa Б) KCN В) HCOOLi
Г) BaF2 Д) RbJ
Ответ: Б.
6. При гидролизе данной соли практически не меняется рН:
А) NaCl Б) Na2CO3 В) NH4Cl
Г) CH3COONH4 Д) K3PO4 Е) Al(NO3)3
Ответ: Г.
7. При взаимодействии водных растворов хлорида алюминия и карбоната натрия образуются в качестве продуктов реакции:
А) NaCl Б) Al2(CO3)3 В) CO2
Г) Al(OH)3 Д) Al(OH)CO3 Е) NaHCO3
Ответ: А,В,Г.
8. При помощи каких индикаторов можно оценить, что произошел гидролиз карбоната калия:
А) метилоранж Б) фенолфталеин В) крахмал
Г) лакмус Д) метилкрасный
Ответ: Б,Г.
Информационная часть
В современной химии для описания реакций, сопровождающихся изменением кислотно-основных свойств реагирующих веществ, пользуются протолитической теорией Дж. Бренстеда, Т. Лоури и Н. Бьеррума.
В соответствии с положениями этой теории кислота – донор протонов (НВ), основание – акцептор протонов (В). Молекула и ион (или два иона), отличающиеся по составу на передаваемый протон, называется сопряженной кислотно-основной парой. В водных растворах кислот и оснований можно выделить две сопряженные пары, одну из которых образует растворитель. Равновесия, устанавливающиеся в растворах между кислотами и сопряженными основаниями, называются протолитическими (кислотно-основными), а перенос протона от одной частицы к другой – протолизом. Понятия «кислота» и «основание» являются относительными, т.к. одни и те же вещества могут проявлять как кислотные, так и основные свойства – в зависимости от партнера по равновесию.
Реакцию ионизации или диссоциации кислоты в водном растворе можно показать:
-
СH3COOH
+
H2O
CH3COO-
+
H3O+
кислота 1
основание 2
основание 1
кислота 2
Одну сопряженную пара образуют CH3COOH / CH3COO-, другую H2O / H3O+.
Аналогично реакцию диссоциации основания можно показать:
-
NH3
+
H2O
NH
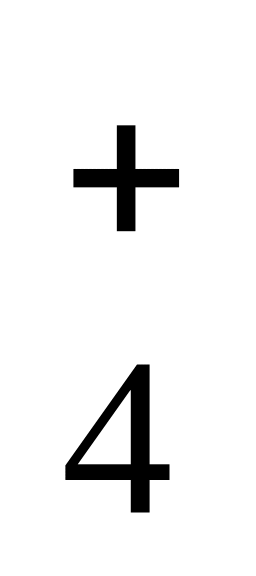
+
OH-
основание 1
кислота 2
кислота 1
основание 2
Реакция самоионизации (автопротолиза) воды имеет вид:
-
H2O
+
H2O
H3O+
+
OH-
кислота 1
основание 2
кислота 2
основание 1
Частицы, способные к взаимодействию как с кислотами, так и с основаниями, называются амфолитами. К амфолитам относятся вода, аминокислоты, белки и некоторые другие вещества.
Кислотами могут быть нейтральные молекулы, катионы и анионы. Основаниями также могут быть нейтральные молекулы, анионы и катионы.
Сила кислот определяется их способностью отдавать протон, а оснований – принимать протон. Мерой этой способности служат, соответственно, константа кислотности (ka) и константа основности (kb).
В водном растворе для произвольной кислоты НВ имеем:
НВ + Н2О В- + Н3О+
Константа равновесия этого процесса:
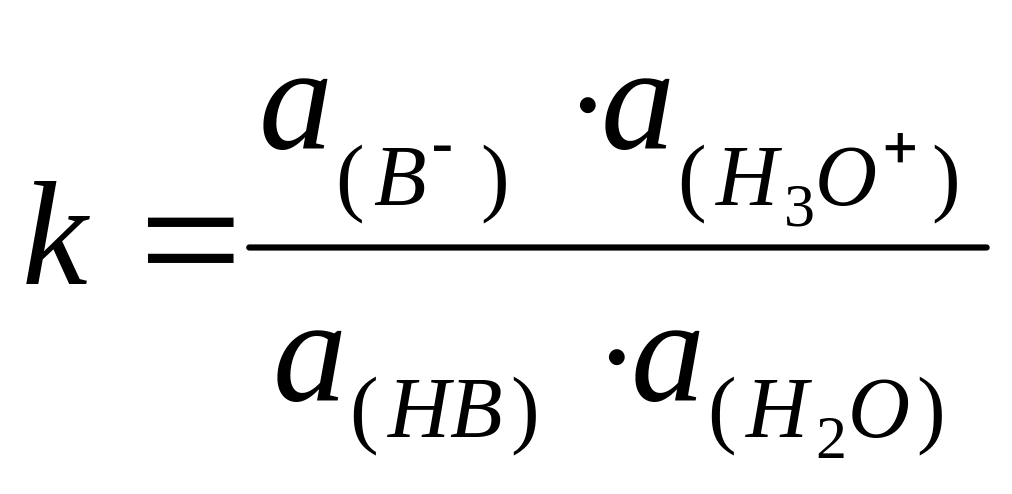
Так как
![]() =
const,
для разбавленных растворов, приняв а
с, имеем:
=
const,
для разбавленных растворов, приняв а
с, имеем:
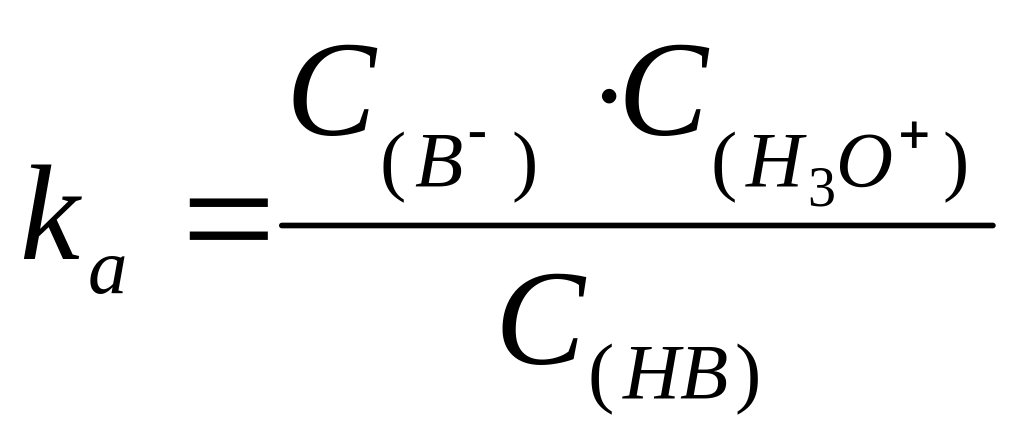
Для полипротонных кислот константы кислотности определяются по каждой ступени. Например, для Н3РО4:
Н3РО4
+ Н2О
Н3О+
+ Н2РО

Н2РО
+ Н2О
Н3О+
+ НРО
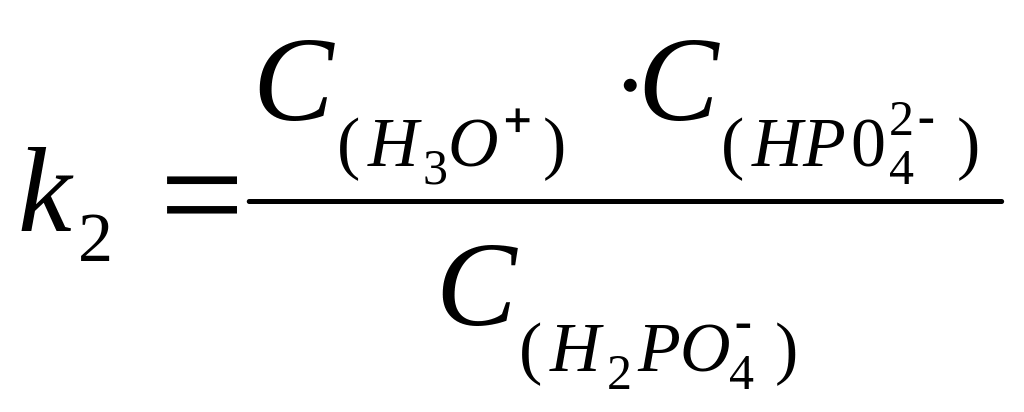
НРО
+ Н2О
Н3О+
+ РО![]()
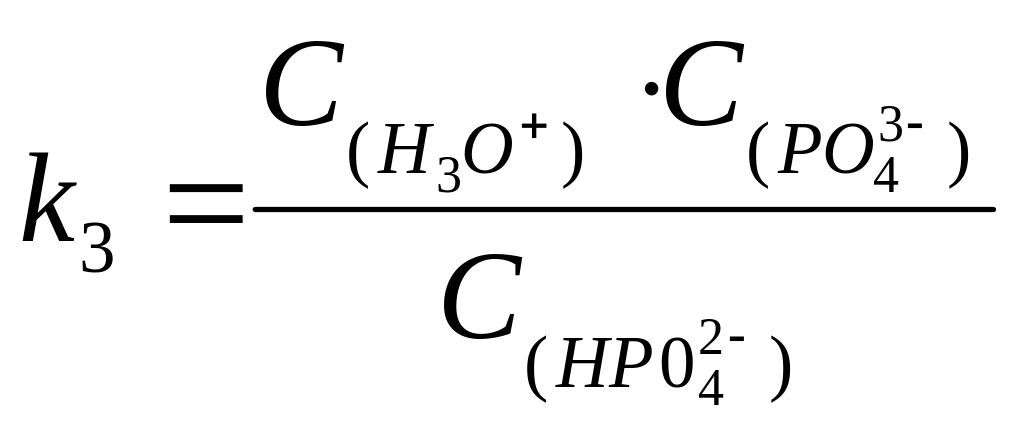
Аналогично, для произвольного основания В имеем:
В + Н2О
ВН+
+ ОН- ![]()
Константы кислотности и основности в сопряженной паре для водного раствора связаны между собой:
kа
kb
= k![]() =
С
=
С![]()
С
С![]()
Чем сильнее кислота, тем слабее сопряженное ей основание и наоборот.
Для удобства расчетов пользуются не самими константами, а их показателями, т.е. десятичными логарифмами, взятыми со знаком «минус»:
рKа = -lgKa и рKb = -lgKb
Для водных растворов рKа + рKb = 14 при Т=298о К.
Самой сильной кислотой в водном растворе является ион гидроксония Н3О+, а самым сильным основанием – гидроксид ион ОН-.
Ниже приведена протолитическая шкала – диапазон значений, в котором могут меняться величины рКа протолитов в водном растворе.
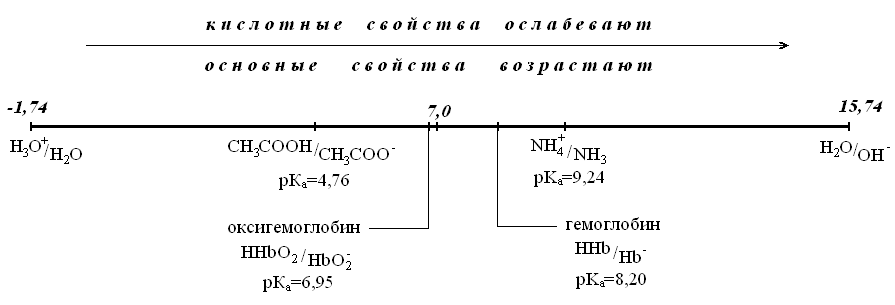
Если в растворе имеются две кислоты или два основания различной силы, то можно показать, что более сильная кислота подавляет ионизацию более слабой кислоты и более сильное основание подавляет ионизацию более слабого основания. Исходя из этого, для сильных кислот в водном растворе можно вывести формулу расчета рН. Если для разбавленных растворов сильных кислот принять степень ионизации равной 1, то:
рН = -lgC(НВ), где
С(НВ) – молярная концентрация одноосновной сильной кислоты.
Аналогично можно показать, для сильных однокислотных оснований:
рН = 14 + lgC(В), где
С(В) – молярная концентрация сильного основания.
Для слабых кислот и оснований необходимо учитывать их степень ионизации. Так, для слабой одноосновной кислоты:
рН = 0,5 (рКа - lgC(НВ)),
а для слабого однокислотного основания:
рН = 14 - 0,5 (рКb - lgC(В)).
В случае ионизации двух- и более основных кислот или двух- и более кислотных оснований, в первом приближении берут первую константу ионизации. Так, для Н2СО3:
рН = 0,5 (рК1
– lgC![]() ).
).
Гидролиз – реакция взаимодействия растворенного вещества с водой. Если растворить в воде соли, образованные либо слабой кислотой, либо слабым основанием, значение рН воды будет изменяться за счет протекания реакции между солью и водой. Только растворимые соли, образованные сильными кислотами и сильными основаниями, гидролизу не подвергаются, ибо реакция между сильной кислотой и сильным основанием протекает необратимо.
Различают три случая гидролиза солей:
1. Гидролизу по катиону подвергаются соли, образованные слабым основанием и сильной кислотой, например, NH4Cl.
NH4Cl + HOH NH3H2O + HCl или
NH + HOH NH3H2O + H+.
При этом рН смещается в кислую сторону, т.е. рН7. Количественный расчет рН проводится по формуле:
рН = 7 – 0,5рКb – 0,5lgCсоли, где
Ссоли – молярная концентрация соли.
Константа и степень гидролиза (h) солей такого типа связаны с k и kb следующим образом:
![]() ,
,

2. Гидролизу по аниону подвергаются соли, образованные слабой кислотой и сильным основанием, например, CH3COONa.
CH3COONa + HOH CH3COOH + NaOH или
CH3COO- + HOH CH3COOH + OH-.
При этом рН смещается в щелочную сторону, т.е. рН7. Количественный рН рассчитывается по формуле:
рН = 7 + 0,5рКа + 0,5lgCсоли
Константа и степень гидролиза солей такого типа связаны с силовыми показателями воды и слабой кислоты следующим образом:
![]() ,
,
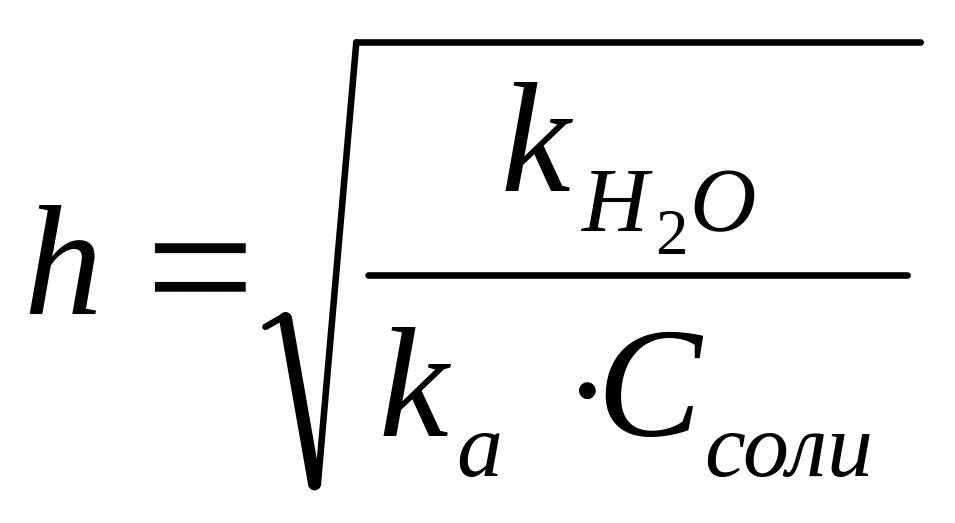
3. Гидролизу по катиону и аниону одновременно подвергаются соли, образованные слабыми кислотами и слабыми основаниями, например, CH3COONН4.
CH3COONН4 + HOH CH3COOH + NH3H2O или
CH3COO- + NH + HOH CH3COOH + NH3H2O.
В этом случае реакция среды определяется тем, какой из этих электролитов сильнее. Если кислота более сильная, чем основание, то создается слабокислая среда, если основание более сильное, чем кислота, то – слабощелочная среда.
Расчет рН для таких солей проводится по формуле:
рН = 7 + 0,5рКа - 0,5рКb
Константа и степень гидролиза рассчитываются по формулам:
![]() ,
,
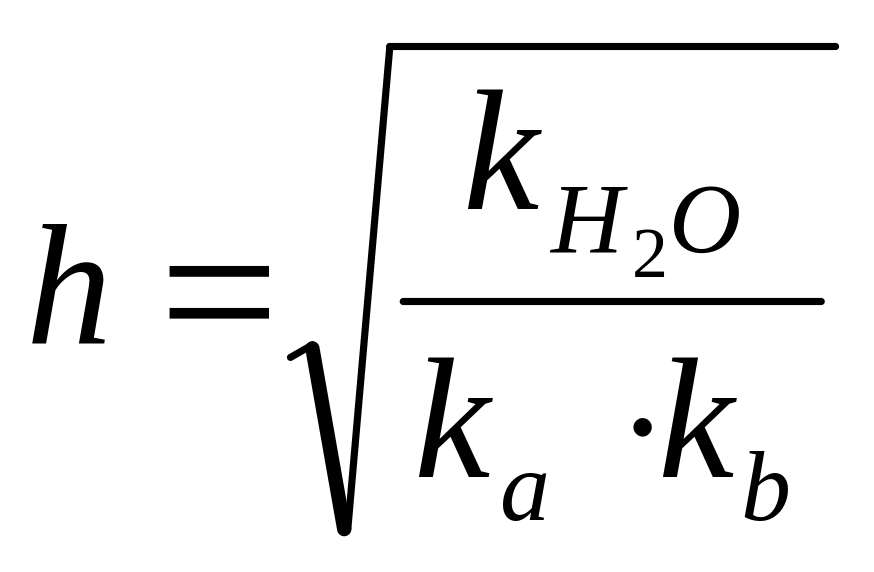 .
.
В последнем случае гидролиз идет глубже, чем в первых двух случаях. Если же соли образованы очень слабыми кислотами, например, H2S, H2CO3 и т.д., и очень слабыми основаниями, например, Fe(OH)3, Al(OH)3, Cr(OH)3 и т.д., то такие соли подвергаются полному необратимому гидролизу и в обменных реакциях в водной среде они не могут образоваться.
Одним из важнейших протолитических показателей в биохимических процессах является рН среды. Известны два способа определения рН.
1. Колориметрический способ основан на использовании кислотно-основных индикаторов, которые представляют собой слабые кислоты или основания, изменяющие свою окраску в обратимых реакциях обмена протонов.
У одноцветных индикаторов молекулярная форма бесцветна, а ионная окрашена. Если взять индикатор – кислоту, то:
Hind |
+ |
H2O |
|
H3O+ |
+ |
Ind- |
бесцветная форма |
|
окрашенная форма |
||||
К одноцветным индикаторам относятся n-нитрофенол, фенолфталеин, тимолфталеин. Если обе формы индикатора окрашены, то он называется двухцветным. Например, метиловый оранжевый, метиловый красный, бромтимоловый синий.
При добавлении кислоты или щелочи протолитическое равновесие диссоциации индикатора смещается в сторону образования ионной или молекулярной форм, что приводит к перемене окраски всего раствора. Обычно окраска индикаторов меняется в интервале рКа1, который называется зоной перехода окраски индикатора. Точность измерения рН этим методом составляет 0,5 единиц рН. На практике чаще используют смесь индикаторов (универсальный индикатор). Например, смесь Кольтгофа состоит из диметиламиноазобензола, метилового красного, бромтимолового синего, фенолфталеина и тимолфталеина и может изменять окраску в диапазоне от рН 2 до 10:
рН = 2 окраска красная
рН = 3 окраска красно-оранжевая
рН = 4 окраска оранжевая
рН = 5 окраска желто-оранжевая
рН = 6 окраска лимонно-желтая
рН = 7 окраска желто-зеленая
рН = 8 окраска зеленая
рН = 9 окраска сине-зеленая
рН = 10 окраска фиолетовая
2. Электрометрический способ основан на измерении электродвижущей силы в гальваническом элементе, составленном из водородселективного электрода (обычно стеклянного) и электрода сравнения (обычно хлорсеребряного). Этот способ будет подробно рассмотрен в теме «Электрохимические методы исследования. Потенциометрия». Погрешность измерения рН этим способом составляет 0,05 единиц рН.
