
- •Содержание
- •Введение
- •Порядок выполнения лабораторной работы
- •По технике безопасности
- •Некоторые свойства вероятностей
- •Введение в математическую статистку
- •Эмпирическая функция распределения
- •Гистограмма распределения
- •Числовые характеристики
- •Нормальное распределение
- •Свойства нормального распределения:
- •Правило 3 сигма
- •Задание
- •Контрольные вопросы
- •Свободные электроны в металлах
- •В ычисление анодного тока при задерживающем напряжении
- •Измерения и их обработка Приборы и принадлежности
- •Выполнение работы
- •Контрольные вопросы
- •Потенциал межмолекулярного взаимодействия
- •Соотношения между кинетической и потенциальной энергиями в агрегатных состояниях
- •Поверхностное натяжение
- •Механизм возникновения поверхностного натяжения
- •Капиллярные явления
- •Приборы и принадлежности
- •Вывод рабочей формулы
- •Порядок выполнения работы
- •Приборы и принадлежности
- •Вывод рабочей формулы
- •Порядок выполнения работы
- •Приборы и принадлежности
- •Описание установки
- •Вывод рабочей формулы
- •Порядок выполнения работы
- •Приборы и принадлежности
- •Описание установки и вывод рабочей формулы метода
- •Порядок выполнения работы
- •Контрольные вопросы
- •Объяснение эффекта Зеебека Объемная термоЭдс или различная зависимость средней энергии электронов от температуры в различных веществах
- •Контактная термоЭдс или различная зависимость от температуры контактной разности потенциалов в различных веществах
- •Объяснение эффекта Пельтье
- •Термоэлектрический модуль (элемент) Пельтье
- •Описание экспериментальной установки
- •Порядок выполнения работы Задача 1 - изучение эффекта Пельтье
- •Задача 2 - изучение эффекта Зеебека
- •Контрольные вопросы
- •Вывод формулы Пуазелля, коэффициент вязкости
- •Описание экспериментальной установки
- •Порядок выполнения работы
- •Контрольные вопросы
- •Постановка задачи
- •I. Метод вискозиметрии
- •Обоснование метода
- •Приборы и принадлежности
- •Описание вискозиметра
- •Порядок выполнения работы
- •II. Метод Стокса Обоснование метода
- •Приборы и принадлежности
- •Описание прибора
- •Порядок проведения работы
- •Контрольные вопросы
- •Оборудование
- •Вывод рабочей формулы
- •Порядок выполнения работы:
- •Порядок выполнения работы:
- •Контрольные вопросы
- •Постановка задачи
- •Описание установки
- •Вывод рабочей формулы
- •Порядок выполнения работы
- •Обработка результатов
- •Контрольные вопросы
- •Описание установки
- •Вывод рабочей формулы
- •Порядок выполнения работы
- •Контрольные вопросы
- •Классическая теория теплоемкости твердых тел (кристаллов)
- •Несовершенство классической теории теплоемкости
- •Квантовая теория теплоемкости Эйнштейна
- •Понятие о квантовой теории Дебая для теплоемкости твердых тел
- •Экспериментальная задача Приборы и принадлежности
- •Измерение теплоемкости методом охлаждения
- •Описание установки
- •Порядок выполнения работы
- •Контрольные вопросы
- •Постановка задачи
- •Описание установки
- •Величина χ при различных температурах
- •Контрольные вопросы
- •Основные понятия комбинаторики
- •1. Размещения с повторениями
- •2. Размещения без повторений
- •3. Перестановки без повторений
- •4. Перестановки с повторениями
- •5. Сочетания без повторений
- •Задача о картах и вероятности
- •Обработка результатов по методу наименьших квадратов
- •Обработка результатов измерений.
- •Очень нужно всем студентам знать!!!
- •При обработке результатов прямых измерений предлагается следующий порядок операций:
- •Ошибки величин являющихся функциями нескольких измеряемых величин
- •Изменение концентрации частиц при прохождении через потенциальный барьер
- •Вычисление относительной скорости
- •Условия применимости классической статистики
- •Границы применимости закона Максвелла распределения молекул газа по скоростям
- •Понятие о квантовой статистике Бозе — Эйнштейна и Ферми — Дирака. Переход к статистике Максвелла-Больцмана.
- •Литература
Оборудование
Тигельная печь, тигли с металлом (оловом или индием), термопара, цифровой вольтметр (Рис.4).
Тигель представляет собой кварцевый сосуд, между стенками которого помещен исследуемый металл.
В канал тигля помещена термопараw, концы которой присоединены к цифровому вольтметру с пределом измерения около 15 мВ, с помощью которого производится запись термоЭДС в зависимости от времени ε=f(t).
Вывод рабочей формулы
Теплоту плавления металла вычисляют по графику зависимости температуры остывающего (или нагревающегося) металла от времени, получаемого экспериментально. Аналогичный график представлен на рис.5.
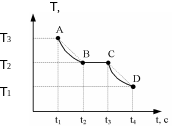
Рис. 5. График
зависимости температуры в тигле
от
времени
участок АВ – остывание жидкого металла,
участок ВС – процесс кристаллизации металла,
участок CD – охлаждение твердого металла.
Пусть М - масса тигля, в котором плавится металл, C – удельная теплоёмкость материала тигля (кварца), С1 — удельная теплоёмкость жидкого металла, С2 — удельная теплоёмкость затвердевшего металла, m - масса металла. Величины Т1, Т2, Т3, t1, t2, t3 соответствуют температуре и времени точек А, В, С, D на рис. 5.
Теплота плавления металла определяется методом наблюдений средних скоростей охлаждения металла до и после кристаллизации (чтобы уменьшить ошибку при вычислении).
Скорость
охлаждения металла до затвердевания
равна:
![]() ,
где
,
где
![]()
Скорость
охлаждения после затвердевания:
![]() ,
где
,
где
![]()
Тогда
скорость процесса кристаллизации
можно представить в виде:
![]() ,
где
,
где
![]() ,
где λ - удельная теплота плавления
(кристаллизации) данного металла.
,
где λ - удельная теплота плавления
(кристаллизации) данного металла.
Учитывая,
что
![]() ,
получим, что количество тепла затраченного
на процесс кристаллизации равно среднему
количеству тепла, отведенному при
охлаждении металла до и после процесса
кристаллизации:
,
получим, что количество тепла затраченного
на процесс кристаллизации равно среднему
количеству тепла, отведенному при
охлаждении металла до и после процесса
кристаллизации:
![]()
Подставляя
выражения для
![]() ,
,
![]() ,
,
![]() ,
получим формулу
для расчёта теплоты плавления:
,
получим формулу
для расчёта теплоты плавления:
![]() (1)
(1)
Порядок выполнения работы:
Поместить тигель с исследуемым материалом в печь, закрыть крышку, присоединить термопару, включить печь в сеть.
Нагреть образец немного выше температуры плавления, что соответствует 13 мВ по вольтметру для олова и 12 мВ - для индия. Отключить печь, осторожно вынуть из неё тигель с металлом на теплоизолированную подставку.
Снять зависимость термоЭДС как функцию времени ε=f(t) в процессе охлаждения и кристаллизации выбранного образца. Показания вольтметра регистрировать через 15 секунд (до 4 mВ для олова и 2 mВ для индия). Опыт проделать трижды.
Перевести значения термоЭДС в температуру (градусы шкалы Цельсия) по градуировочному графику термопары.
Построить график зависимости Т =f(t). Для нахождения точек А и D на оси абсцисс влево и вправо откладывать отрезки Δt, равные времени кристаллизации металла, Δt = t3 – t2 (участок ВС на кривой).
По формуле (1) рассчитать удельную теплоту плавления металла λ (для каждого из трёх опытов отдельно).
Оценить погрешность определения λ по методу Стьюдента.
Задача 2. Энтропия. Оценка приращения энтропии при плавлении металла
Энтропия интересная и необычная функция состояния термодинамической системы, это понятие непосредственно связано со вторым началом термодинамики. Энтропией называется функция состояния "S", дифференциал которой в элементарном обратимом процессе равен отношению бесконечно малого количества теплоты δQ, сообщённого системе, к температуре, при которой этот переход произошел:
![]()
Однако все реальные процессы в природе необратимы. Для необратимых процессов изменение энтропии:
![]()
т. е. при переходе системы из одного состояния в другое энтропия всегда возрастает. Каких-либо исключений из этого правила не обнаружено. Поэтому обобщённая формулировка второго начала термодинамики читается так: "полная энтропия произвольной системы вместе с её окружением в любых естественных процессах увеличивается, т. е. ΔS>0".
Рассмотрим процесс плавления металла. Процесс передачи тепла является необратимым, поэтому выражение второго начала термодинамики следует использовать в форме . Как же тогда вычислить величину приращения энтропии ΔS = S2 — S1 для реального необратимого процесса - плавления металла? Энтропия является функцией состояния, поэтому для оценки ΔS можно использовать выражение для какого-либо обратимого процесса, т. к. когда тела вошли в тепловой контакт, то начальное и конечное состояния каждого тела одинаковы.
Пусть тигель с металлом приведён в контакт с нагревателем (тепло передаётся от более нагретого тела при температуре Т1 к менее нагретому телу - металлу с температурой Т2 , причём Т1 >Т2 ). Тогда количество теплоты |ΔQ|, взятое у более нагретого тела - тигля, приведёт к уменьшению его энтропии на
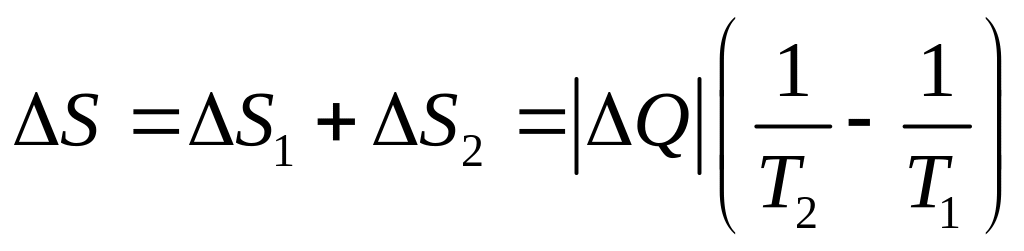 ;
;
т.к. Т1 >Т2 , то ΔS>0. Таким образом, энтропия одного тела уменьшается, а другого увеличивается, но полное изменение энтропии является положительным. Оценим это приращение количественно,
, (2)
где
![]()
![]()
с, m - теплоёмкость и масса металла,
Тпл - температура плавления металла,
Т1 - комнатная температура,
λ - удельная теплота плавления металла.
Тогда
![]() (3)
(3)
Физический смысл понятия "энтропия" был раскрыт Больцманом в выражении S=klnW, где k- постоянная Больцмана, W - количество микросостояний, соответствующих данному макросостоянию системы (стат. вес). Согласно этой интерпретации понятие энтропии связывается с более привычными понятиями "порядок" и "беспорядок". Энтропию системы можно рассматривать как количественную меру беспорядка в системе. При этом второе начало термодинамики звучит так: "естественные процессы стремятся перевести систему в состояние с большим беспорядком". Когда металл при плавлении превращается в жидкость, энтропия жидкого металла увеличивается. В твёрдом состоянии его структура более упорядочена, чем в жидком, где он может растекаться, т. е. упорядоченное расположение металла в кристаллической решётке сменилось неупорядоченным, в известной мере, случайным движением молекул в жидком состоянии. Таким образом, процессы плавления металла сопровождаются приращением энтропии.
