
- •Содержание
- •Введение
- •Порядок выполнения лабораторной работы
- •По технике безопасности
- •Некоторые свойства вероятностей
- •Введение в математическую статистку
- •Эмпирическая функция распределения
- •Гистограмма распределения
- •Числовые характеристики
- •Нормальное распределение
- •Свойства нормального распределения:
- •Правило 3 сигма
- •Задание
- •Контрольные вопросы
- •Свободные электроны в металлах
- •В ычисление анодного тока при задерживающем напряжении
- •Измерения и их обработка Приборы и принадлежности
- •Выполнение работы
- •Контрольные вопросы
- •Потенциал межмолекулярного взаимодействия
- •Соотношения между кинетической и потенциальной энергиями в агрегатных состояниях
- •Поверхностное натяжение
- •Механизм возникновения поверхностного натяжения
- •Капиллярные явления
- •Приборы и принадлежности
- •Вывод рабочей формулы
- •Порядок выполнения работы
- •Приборы и принадлежности
- •Вывод рабочей формулы
- •Порядок выполнения работы
- •Приборы и принадлежности
- •Описание установки
- •Вывод рабочей формулы
- •Порядок выполнения работы
- •Приборы и принадлежности
- •Описание установки и вывод рабочей формулы метода
- •Порядок выполнения работы
- •Контрольные вопросы
- •Объяснение эффекта Зеебека Объемная термоЭдс или различная зависимость средней энергии электронов от температуры в различных веществах
- •Контактная термоЭдс или различная зависимость от температуры контактной разности потенциалов в различных веществах
- •Объяснение эффекта Пельтье
- •Термоэлектрический модуль (элемент) Пельтье
- •Описание экспериментальной установки
- •Порядок выполнения работы Задача 1 - изучение эффекта Пельтье
- •Задача 2 - изучение эффекта Зеебека
- •Контрольные вопросы
- •Вывод формулы Пуазелля, коэффициент вязкости
- •Описание экспериментальной установки
- •Порядок выполнения работы
- •Контрольные вопросы
- •Постановка задачи
- •I. Метод вискозиметрии
- •Обоснование метода
- •Приборы и принадлежности
- •Описание вискозиметра
- •Порядок выполнения работы
- •II. Метод Стокса Обоснование метода
- •Приборы и принадлежности
- •Описание прибора
- •Порядок проведения работы
- •Контрольные вопросы
- •Оборудование
- •Вывод рабочей формулы
- •Порядок выполнения работы:
- •Порядок выполнения работы:
- •Контрольные вопросы
- •Постановка задачи
- •Описание установки
- •Вывод рабочей формулы
- •Порядок выполнения работы
- •Обработка результатов
- •Контрольные вопросы
- •Описание установки
- •Вывод рабочей формулы
- •Порядок выполнения работы
- •Контрольные вопросы
- •Классическая теория теплоемкости твердых тел (кристаллов)
- •Несовершенство классической теории теплоемкости
- •Квантовая теория теплоемкости Эйнштейна
- •Понятие о квантовой теории Дебая для теплоемкости твердых тел
- •Экспериментальная задача Приборы и принадлежности
- •Измерение теплоемкости методом охлаждения
- •Описание установки
- •Порядок выполнения работы
- •Контрольные вопросы
- •Постановка задачи
- •Описание установки
- •Величина χ при различных температурах
- •Контрольные вопросы
- •Основные понятия комбинаторики
- •1. Размещения с повторениями
- •2. Размещения без повторений
- •3. Перестановки без повторений
- •4. Перестановки с повторениями
- •5. Сочетания без повторений
- •Задача о картах и вероятности
- •Обработка результатов по методу наименьших квадратов
- •Обработка результатов измерений.
- •Очень нужно всем студентам знать!!!
- •При обработке результатов прямых измерений предлагается следующий порядок операций:
- •Ошибки величин являющихся функциями нескольких измеряемых величин
- •Изменение концентрации частиц при прохождении через потенциальный барьер
- •Вычисление относительной скорости
- •Условия применимости классической статистики
- •Границы применимости закона Максвелла распределения молекул газа по скоростям
- •Понятие о квантовой статистике Бозе — Эйнштейна и Ферми — Дирака. Переход к статистике Максвелла-Больцмана.
- •Литература
Описание экспериментальной установки
Для изучения работы термоэлектрического элемента Пельтье собирается схема, показанная на рисунке 8. Все элементы в электрической схеме включены последовательно, а по тепловому потоку параллельно. Сверху на термоэлементе установлен Охладитель (проточный), снизу Нагреватель. Ток с источника питания может подаваться либо на Элемент, либо на Нагреватель в зависимости от положения ключа (нажатая или отжатая красная кнопка). Протекающий ток контролируется с помощью амперметра. Величина термо-ЭДС контролируется с помощью вольтметра. Измерения температуры проводят с помощью электронного цифрового термометра, датчик которого расположены на границе спаев Элемент-Нагреватель (нижнее показание на термометре-out). Можно также изменять направление тока с помощью тумблера на панели, где размещен элемент Пельтье.
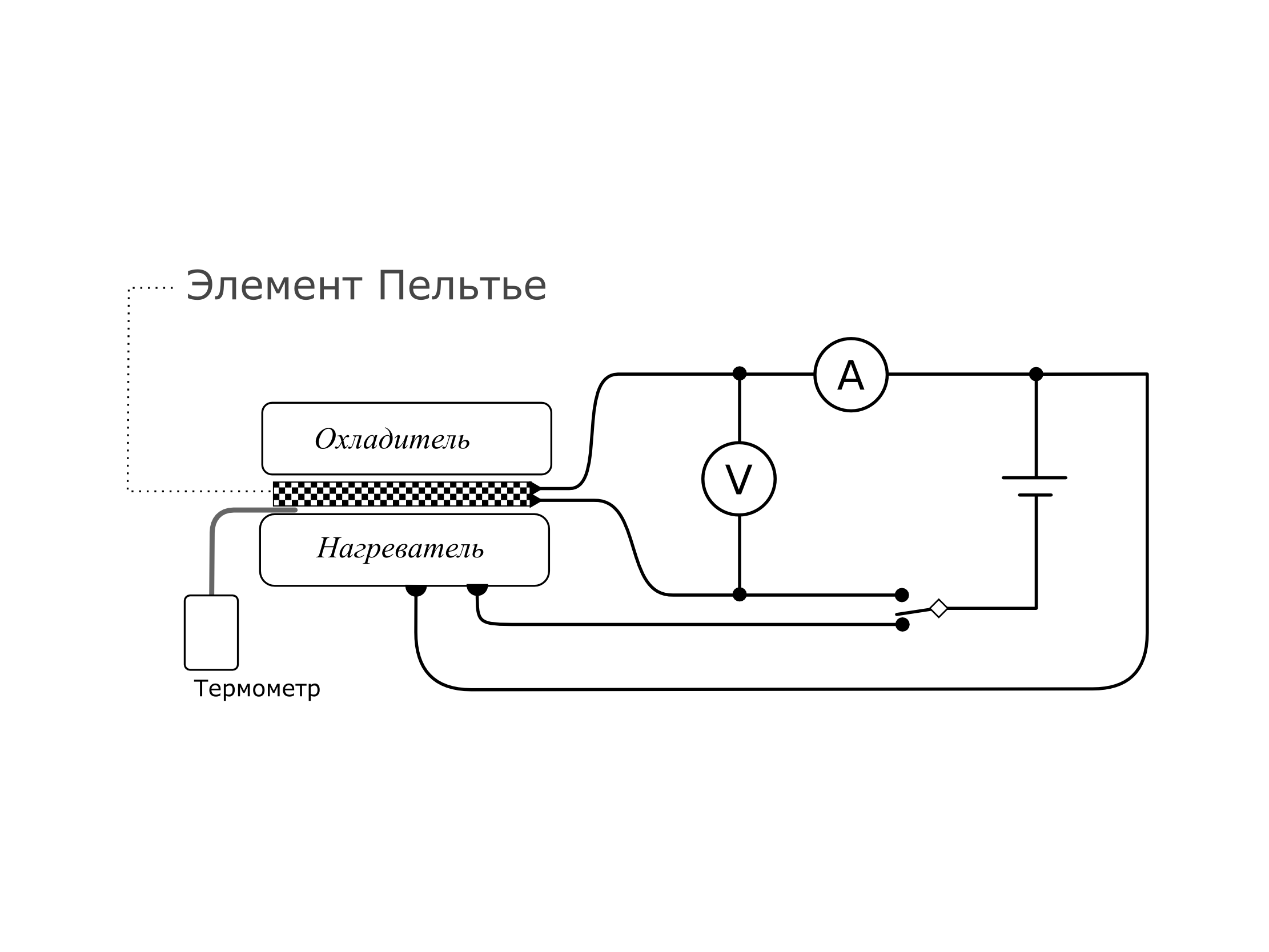
Рис. 8. Экспериментальная установка
Порядок выполнения работы Задача 1 - изучение эффекта Пельтье
Включить схему так чтобы ток от источника питания (ИП) подавался на Элемент (т.е. на установке отжать красную кнопку)
Задать на ИП напряжение и силу тока.
Замерить температуры на контактах Элемент-Нагреватель и Элемент-Охладитель (T1 и T2)
Через каждые (две-три) минуты фиксировать изменение температур до тех пор пока температура не перестанет изменяться.
Данные занести в таблицу
T1
I
t
T2
∆T= T2- T1
Выбрать другое значение силы тока и изменить направление тока. Повторить пункты 2-5
Построить зависимости Т2=f(t) для разных сил тока и проанализировать зависимости.
Задача 2 - изучение эффекта Зеебека
Включить схему так чтобы ток от источника питания (ИП) подавался на Нагреватель (т.е. на установке нажать красную кнопку)
Задать на ИП напряжение и силу тока.
Включить охлаждение (пустить циркуляцию воды на Охладителе)
Нагрейте Нагреватель до T2=350C.
Температуру на контакте Элемент-Охладитель (Т1) принять за температуру проточной воды (измерьте ее с помощью градусника).
Отключив ИП, сделать две вещи
Замерить Термо-ЭДС вольтметром.
Засечь время релаксации процесса, за которое термоЭДС станет равной нулю (заметьте, чему при этом равна температура у горячего спая)
Проделать пункты 2- 6 еще для трех температур Нагревателя (max-500C) (пункт 5 не надо каждый раз делать)
Данные занести в таблицу
T1
T2
∆T= T2 -T1
ε
∆t
Построить зависимость ε=f(∆Т)
Построить зависимость α12=f(∆T), используя для расчета коэффициентов термо-ЭДС формулу (1).
Контрольные вопросы
В чем отличие металлов от полупроводников.
Что происходит при р-n переходах при различном направлении тока.
В чем заключаются эффекты Зеебека, Пельтье, Томсона?
Объясните причины их возникновения?
Как вы понимаете коротко механизмы эффектов Зеебека и Пельтье?
Что такое тепловое равновесие, почему система стремиться вернуться в него?
Что такое время релаксации процесса?
Проанализировать полученные зависимости термоЭДС.
При каких условиях элемент Пельтье более производителен?
Лабораторная работа 2-5
определение средней длины свободного пробега и эффективного диаметра молекул газа
Цель работы
Познакомиться с явлением внутреннего трения в газах и основными газокинетическими характеристиками молекул.
Задача работы
Экспериментальное определение длины свободного пробега и эффективного диаметра молекул воздуха по явлению внутреннего трения при движении по капилляру.
Явления переноса в газах
Явления переноса — это необратимые процессы, возникающие при нарушении равновесия в физической системе и стремящиеся привести систему в новое равновесное состояние. Каждое из явлений переноса связано с неоднородностями плотности, температуры или скорости упорядоченного перемещения отдельных слоев вещества. Выравнивание неоднородностей приводит к возникновению явлений переноса. Явления переноса в газах и жидкостях состоят в том, что в этих веществах возникает упорядоченный направленный перенос массы (диффузия), импульса (внутреннее трение) и внутренней энергии (теплопроводность). В химически однородном газе диффузия есть перенос массы газа из области с большей плотностью в область с меньшей плотностью. Теплопроводность осуществляется в макроскопически неподвижной неравномерно нагретой среде и представляет собой перенос энергии в форме теплоты. Внутренним трением, или вязкостью, называется появление сил трения между слоями жидкости или газа, движущимися параллельно друг другу с разными скоростями, что приводит к переносу импульсов упорядоченного движения молекул.
Все эти явления молекулярно-кинетическая теория объясняет хаотическим тепловым движением частиц системы и неодинаковыми значениями какой-либо величины в разных частях системы (пространственная неоднородность ее состава вызывает диффузию, разность температур - теплопроводность, разность скоростей ее слоев — вязкость).
Вязкость газов возникает в результате суперпозиции упорядоченного направленного движения параллельных слоев газа, перемещающихся с различными скоростями, и хаотического движения молекул. В результате хаотического теплового движения молекулы переходят из слоя в слой, частично теряя или увеличивая свой «упорядоченный» импульс. Это означает, что на более медленно движущийся слой действует ускоряющая сила, а на быстро движущийся слой - тормозящая сила.
В случае медленного движения газа в прямой цилиндрической трубе малого диаметра (капилляре) течение можно считать ламинарным, т. е. упорядоченным. Газ перемещается соосными с капилляром цилиндрическими слоями.
Известно, что средняя скорость молекул газа при комнатной температуре сравнима со скоростью оружейной пули. Это означает, что запах пахучего вещества должен распространяться мгновенно. Однако на практике это не наблюдается. Медленность диффузии немецкий физик теоретик Рудольф Клаузис объяснил столкновением молекул. Молекула не все время движется по прямой. Сталкиваясь с другими молекулами, она меняет направление движения, перемещаясь в результате по зигзагообразной траектории, как показано на рис.1.
З
Рис.1.Траектория
молекулы
Рис.2. Эффективный
диаметр молекул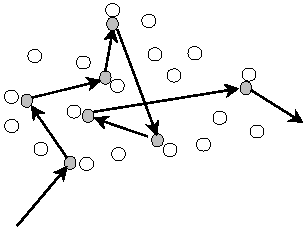
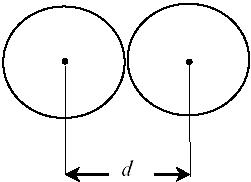
Выясним теперь, почему так происходит на примере идеального газа. Если бы частицы газа представляли материальные точки, они никогда бы не сталкивались друг с другом. Поэтому при рассмотрении столкновений молекул в газе, их представляют в виде твердых шаров некоторого радиуса r. Минимальное расстояние, на которое сближаются при столкновении центры двух молекул, называется эффективным диаметром молекулы d (рис.2.).
Величина
![]() также является важной характеристикой
при изучении кинематического движения
частиц и называется эффективным
сечением молекулы.
также является важной характеристикой
при изучении кинематического движения
частиц и называется эффективным
сечением молекулы.
На
рис.3 изображен цилиндр радиусом d.
Штриховая прямая представляет собой
путь, по которому следовала бы одна из
молекул, если бы она не испытывала
столкновений. Столкновение произойдет,
если центр другой молекулы окажется
внутри этого цилиндра. Безусловно, как
только произойдет столкновение,
направление движения частицы изменится
и вместе с ним изменится наш воображаемый
цилиндр, но для упрощения вычислений
мы не будем менять вид цилиндра.
Предположим, что данная молекула - одна
из многих, движущихся в газе со скоростью
![]() .
Представим себе на мгновение, что другие
молекулы не движутся и, что концентрация
молекул равна n.
.
Представим себе на мгновение, что другие
молекулы не движутся и, что концентрация
молекул равна n.
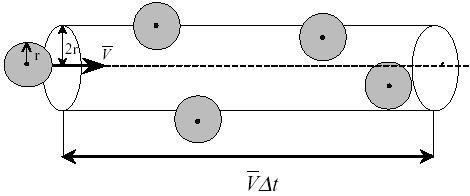
Рис.3. Столкновения
частиц
Тогда
число молекул, центры которых лежат
внутри цилиндра, определится как
концентрация n умноженная на объем этого
цилиндра. Это число будет равно также
и числу произошедших столкновений,
обозначим его K. За промежуток времени
∆t
молекула пройдет расстояние
![]() ,
в этом случае, объем цилиндра равен
,
в этом случае, объем цилиндра равен
![]() .
Таким образом, число столкновений K
за время ∆t
равно
.
Таким образом, число столкновений K
за время ∆t
равно
![]() .
Мы определили среднюю длину свободного
пробега λ, как среднее
расстояние между столкновениями; это
расстояние равно расстоянию, пройденному
за время ∆t,
деленному на число столкновений,
произошедших за время ∆t:
.
Мы определили среднюю длину свободного
пробега λ, как среднее
расстояние между столкновениями; это
расстояние равно расстоянию, пройденному
за время ∆t,
деленному на число столкновений,
произошедших за время ∆t:
![]() (1)
(1)
Однако
выражение (1) является не совсем точным,
поскольку мы предположили, что остальные
молекулы неподвижны. В действительности
они движутся, и число столкновений за
время ∆t
должно зависеть от относительной
скорости
сталкивающихся молекул, а не от
.
Следовательно, число столкновений за
время ∆t
равно
![]() ,
где
,
где
![]() –
средняя относительная скорость
сталкивающихся молекул. Максвелл,
используя функцию распределения молекул
по скоростям, показал, что
–
средняя относительная скорость
сталкивающихся молекул. Максвелл,
используя функцию распределения молекул
по скоростям, показал, что
![]() n.
n.
Следовательно, средняя длина свободного пробега в уравнении (1) принимает вид:
![]() (2)
(2)
Как видно, из последнего выражения средняя длина свободного пробега зависит от концентрации молекул газа. Если воспользоваться основным уравнением молекулярно кинетической теории идеального газа и записать n=P/kT и тем что , то из выражения (2) получим
![]() (3)
(3)
Это соотношение позволяет очень просто оценивать порядки величин свободного пробега для различных давлений. Так, при T=3000K при давлении воздуха 133 Па, она имеет порядок 10-2см, а при 1,33Па она имеет порядок 1см.
Из него также следует формула нужная вам для дальнейших расчетов:
![]() (4)
(4)
При нормальных условияхo n~1025, средняя длина свободного пробега молекул воздуха равна 10–6м, в то время как диаметр молекул N2 и O2 имеет порядок приблизительно 10-10м. Везде здесь рассматриваются только парные столкновения. Случаи, когда в реальных газах сближаются и начинают взаимодействовать три и больше молекулы приводят к фазовым переходам или структурным изменениям, которые для описания намного более сложны.
При очень низких плотностях газа (когда состояние газа можно рассматривать как вакуум) определение средней длины свободного пробега по формулам (1-3) теряют смысл, поскольку молекулы чаще сталкиваются со стенками сосуда, чем между собою. Например, в кубическом сосуде с ребром 20 см, наполненном воздухом под давлением 133*10-7 Па, средняя длина свободного пробега молекул приблизительно 700м.
Заметим, что число молекул в сосуде при этом составляет 1012 частиц.
О
r
l
R
 дним
из способов определения длины свободного
пробега и эффективного диаметра молекул
газа является определение этих
характеристик с использованием явления
внутреннего трения. Представим себе,
что газ протекает по капилляру
цилиндрического сечения. Скорости
отдельных слоев в потоке различны: с
наибольшей скоростью движется слой
газа в средней части капилляра, а по
мере приближения к стенкам скорость
убывает, у самой стенки имеется слой
газа с нулевой скоростью, так как молекулы
газа адсорбируются поверхностьюp
(рис.4).
дним
из способов определения длины свободного
пробега и эффективного диаметра молекул
газа является определение этих
характеристик с использованием явления
внутреннего трения. Представим себе,
что газ протекает по капилляру
цилиндрического сечения. Скорости
отдельных слоев в потоке различны: с
наибольшей скоростью движется слой
газа в средней части капилляра, а по
мере приближения к стенкам скорость
убывает, у самой стенки имеется слой
газа с нулевой скоростью, так как молекулы
газа адсорбируются поверхностьюp
(рис.4).
Т
Рис. 4.
Механизм
возникновения вязкости
r
l
R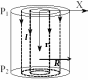 аким
образом, поперек направления движения
наблюдается градиент скорости движущихся
слоев газа. Для возникновения и поддержания
движения потока газа по капилляру
необходимо создать разность давлений
на ее концах. Однако в результате
теплового движения молекулы перемещаясь
из более быстрого слоя в более медленный
и обратно, переносят при этом импульс
и при столкновениях друг с другом
обмениваются импульсами. В результате
скорость направленного движения быстро
движущегося слоя уменьшается, а медленно
движущегося слоя – увеличивается.
На границе раздела
слоев возникают силы внутреннего трения.
Необходимо помнить, что силы
вязкости являются тангенциальными
силами, т.е. направлены вдоль поверхности
соприкасающихся слоев.
аким
образом, поперек направления движения
наблюдается градиент скорости движущихся
слоев газа. Для возникновения и поддержания
движения потока газа по капилляру
необходимо создать разность давлений
на ее концах. Однако в результате
теплового движения молекулы перемещаясь
из более быстрого слоя в более медленный
и обратно, переносят при этом импульс
и при столкновениях друг с другом
обмениваются импульсами. В результате
скорость направленного движения быстро
движущегося слоя уменьшается, а медленно
движущегося слоя – увеличивается.
На границе раздела
слоев возникают силы внутреннего трения.
Необходимо помнить, что силы
вязкости являются тангенциальными
силами, т.е. направлены вдоль поверхности
соприкасающихся слоев.
