
Komyak_A_I_Molekulyarnaya_spektroskopia
.pdfУДК 512.54 + 535.3 + 543.42
ББК К63
Рецензенты:
доктор физико-математических наук, профессор Д.С. Умрейко; членкорреспондент НАН Беларуси доктор физико-математических наук,
профессорК.Н. Соловьѐв
Комяк А.И. Молекулярная спектроскопия. Вращательные, колебательные и электронные спетры многоатомных молекул. Мн.: БГУ, 2004.
В пособии представлены основы спекроскопии молекул. Оно содержит результаты исследований вращательных, колебательных и элек- тронно-колебательных спектров молекул как в свободном, так и в конденсированном состоянии, условия формирования спектра, получения линейчатых спектров двухатомных молекул. Рассмотрены изменения в спектрах при переходе к конденсированному состоянию.
Данное пособие предназначено для студентов физического факультета Белгосуниверситета.
УДК 512.54 + 535.3 + 543.42
ББК К63
А.И. Комяк
3
МОЛЕКУЛЯРНАЯ СПЕКТРОСКОПИЯ. ВРАЩАТЕЛЬНЫЕ, КОЛЕБАТЕЛЬНЫЕ
И ЭЛЕКТРОННЫЕ СПЕКТРЫ МНОГОАТОМНЫХ МОЛЕКУЛ
УЧЕБНОЕ ПОСОБИЕ
Для студентов физического факультета Белгосуниверситета
Минск
БГУ
2003
4
ПРЕДИСЛОВИЕ
Молекулы в отличие от атомов характеризуются многообразием форм движения, поэтому их спектры, соответствующие этим формам движения, весьма разнообразны. Например, кроме движения электронов
вмолекуле мы имеем дело с движением ядер: колебаниями, вращениями и всевозможными поступательными перемещениями. Это приводит к различным спектрам, наблюдаемым для молекулы: электронным, колебательным и вращательным, а с учетом взаимодействия всех форм движения будут присутствовать и спектры электронно-колебательно- вращательного, колебательно-вращательного типов. В предлагаемом пособии рассматрим наряду с общими вопросами спектроскопии вращательные, колебательные и электронно-колебательнные спектры молекул по мере увеличения квантов поглощаемой энергии.
Число электронов в многоатомной молекуле значительно больше, чем
ватоме, поэтому электронная спектроскопия молекул гораздо богаче и разнообразнее спектроскопии атомов. Однако для простоты мы будем рассматривать электронную спектроскопию только внешних (валентных) электронов, ограничившись нижними возбужденными электронными состояниями, частоты переходов в которые регистрируются в видимой и ультрафиолетовой областях спектра.
Вторая половина ХХ столетия – время необычайно бурного и успешного развития молекулярной спектроскопии, создания надежных автоматизированных спектрометров инфракрасного, видимого и ультрафиолетового диапазонов, лазеров как мощных источников монохроматического возбуждения спектров, а также развития теоретических основ молекулярной спектроскопии. Использование вычислительных машин и новых методов расчета колебательных и электронных состояний молекул позволило оценить устойчивые состояния молекул и предсказать ее электронный и колебательный спектры. Применение лазеров как источников возбуждения молекулярных спектров позволило разобраться и изучить многие закономерности и объяснить структуру узколинейчатых спектров молекул, а также наблюдать многофотонные переходы в молекуле и влияние изотопного замещения в молекулах на положение, ширину и интенсивность линий, наблюдаемых в спектрах. Появилась возможность зарегистрировать тонкоструктурный спектр одной молекулы, находящейся в конденсированной среде.
Методы электронной спектроскопии успешно используются также при изучении неупорядоченных конденсированных систем: жидких и стеклообразных, полимеров, пористых стекол, жидких кристаллов и био-
5
логических систем. Существенный успех молекулярной спектроскопии в изучении указанных объектов был связан с развитием техники временной спектроскопии, что позволило изучить динамику молекул в неупорядоченных средах в широком временном диапазоне (от нескольких секунд до фемтосекунд).
Обнаружены новые закономерности в формировании мгновенных спектров поглощения и флуоресценции. Вместе с этим значительно возросли возможности компьютерного моделирования процессов молекулярной динамики сложных образований, включающих поглощающую молекулу и молекулы (несколько сотен) окружения. Это стимулировало дальнейшее изучение влияния динамики молекул среды в формировании спектров поглощения и флуоресценции. Влияние межмолекулярных взаимодействий на спектральные, кинетические, фотохимические и другие физико-химические свойства молекул представляет проблему большой научной и практической важности для молекулярной спектроскопии, физики конденсированного состояния вещества, лазерной физики и радиационной физики и других отраслей науки. И сегодня спектроскопическая информация является необходимой основой как для фундаментальных исследований, так и для решения задач прикладного характера.
Глава 1.
ОБЩИЕ ВОПРОСЫ СПЕКТРОСКОПИИ МОЛЕКУЛ
6
1.1. ЕДИНИЦЫ ИЗМЕРЕНИЯ ЭНЕРГИИ И ДЛИНЫ ВОЛНЫ РАЗЛИЧНЫХ ВИДОВ ИЗЛУЧЕНИЯ
В физике мы встречаемся с разнообразными видами излучения, простирающегося от длинных радиоволн до самых коротких, которые относятся к -излучению. Все излучения, согласно волновой теории, можно описать с помощью изменяющихся векторов напряжeнности электрических и магнитных полей, перпендикулярных друг другу и направлению распространения. Эти представления правильно объясняют многие явления оптического диапазона, однако свет нельзя рассматривать только как непрерывную волну, распространяющуюся в пространстве от излучателя к приемнику. С точки зрения корпускулярных представлений излучение в пространстве распространяется отдельными порциями – (квантами или фотонами) с энергией hν или hc/λ , где h – постоянная Планка, равная 6,63 10–34 Дж с;– частота излучения в с–1 [Гц], – длина волны света, которая связана с частотой излучения следующим соотношением: = с/ или = с. Здесь с – скорость света в вакууме, равная 299792458 м/с или приблизительно 3 108 м/с.
Согласно законам квантовой механики величина испущенного или поглощѐнного кванта света связана с величинами энергии двух стационарных состояний (Еi и Еk), между которыми произошел переход, т. е.
Еk – Еi = h ki. |
(1.1) |
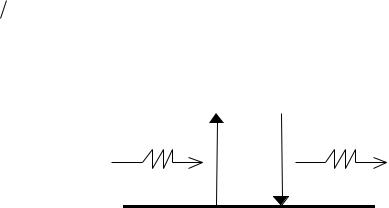
На рис. 1.1 эти переходы указаны вертикальными стрелками: стрелка, проведенная снизу вверх, означает, что поглощается квант света h ik, а стрелка, направленная вниз, означает, что испускается квант света h ki.
Энергию кванта света можно вычислить, если измерить опытным путем длину волны поглощенного или испущенного света. Для измерения длин волн или частот в разных спектральных областях
используют различные единицы. Наиболее распространенной единицей в
~
спектроскопии является волновое число , связанное с длиной волны м соотношением:
~ |
. |
(1.2) |
1 |
Согласно равенству (1.2) волновое число обратно пропорционально длине волны света и указывает, какое число длин волн укладывается в единице длины. Если длину волны измерять в сантиметрах, то волновое число будет измеряться в обратных сантиметрах [см–1].
7
Например, длина волны зеленого света = 500 нм, то волновое число
~ |
1 |
. Для расчета волнового числа полезно знать |
1 |
20000 см |
соотношения между размерами обычно наблюдаемого мира и микромира
|
|
o |
o |
|
(1 нм = 10–9 |
м, 1 нм = 10 A , 1 A = 10–8 см = 10–10 м, 1 см = 107нм). |
|||
|
|
|
|
Ek |
|
|
|
|
|
|
|
h ik |
h ki |
|
Ei
Рис. 1.1. Схема переходов с поглощением и испусканием квантов света частоты ik
Согласно (1.1) разность энергий комбинирующих уровней пропорциональна частоте испускаемого или поглощаемого излучения в с–1 [Гц]. Эту разность можно выразить через волновое число, если
учесть, что
~
= = 1/ λ = ν/с,
~ |
(1.3) |
Еki =Еk – Еi = h ki = hс ki. |
Из (1.1) и (1.3) видно, что разность энергий пропорциональна частоте излучаемого кванта или волновому числу. Если для зеленого света =
~ |
–1 |
, а частота излучения = |
500 нм, то волновое число = 1/ = 20000 см |
|
с/λ = 3 108 м/с / 500 10–9 м = 6 1014 с–1[Гц], т. е. шкалы энергий в волновых числах и в частотах пропорциональны. В спектроскопии применяется любая из этих шкал. Иногда приходится пользоваться пропорциональной им шкалой абсолютных температур Т согласно соотношению
h = kT, |
(1.4) |
где k – постоянная Больцмана, равная 1,38 10–23 |
Дж К–1, Т – абсолютная |
температура по Кельвину. |
|
Вравенстве (1.4) температура Т принимается такой, при которой энергия фотона h равна величине kT, являющейся мерой средней тепловой энергии молекулы.
Вфизике полупроводников чаще используют шкалу энергий, измерямых в электрон-вольтах. Один электрон-вольт – это энергия, которую приобретает электрон, проходя разность потенциалов в один вольт. Для перевода единиц измерения энергии из одной шкалы в другую
8
будем пользоваться переводными множителями, приведенными в таблице 1.1.
Таблица 1.1
Переводные множители единиц измерения энергии
Единицы |
|
|
|
|
|
|
измерения |
см–1 |
с–1 = Гц |
Дж |
эВ |
К |
|
энергии |
|
|
|
|
|
|
1 |
см–1 |
1 |
3 1010 |
1,99 10–23 |
1,24 10–4 |
1,44 |
1 |
с–1= 1 Гц |
3,34 10–11 |
1 |
6,62 10–34 |
4,14 10–15 |
4,8 10–11 |
1 |
Дж |
5,03 1022 |
1,51 1033 |
1 |
6,24 1018 |
7,24 1022 |
1 |
эВ |
8065 |
2,42 1014 |
1,6 10–19 |
1 |
11605,4 |
1 |
К |
0,69 |
2,08 1010 |
1,38 10–23 |
0,86 10–4 |
1 |
Расчеты значений переводных множителей проводили до второго знака после запятой, что является достаточным. Длины волн или частоты переходов с излучением или поглощением могут относиться к любому диапазону шкалы электромагнитных волн, начиная от самых длинных радиоволн и заканчивая самыми короткими волнами (наибольшими частотами), соответствующими гамма-излучению. В табл. 1.2 приведены различные диапазоны спектра электромагнитного излучения.
|
|
|
|
Таблица 1.2 |
|
|
Длины волн, частоты и энергии различных диапазонов |
||||
|
|
электромагнитного излучения |
|
|
|
|
|
|
|
|
|
Диапазон |
|
Длины волн |
Частоты, Гц[с– |
Энергия, см–1 |
|
|
1] |
|
|||
|
|
|
|
|
|
Радиоволны |
|
1000 – 10 м |
3 105 – 3 107 |
10–5 – 10–3 |
|
Короткие |
|
10 – 10–2 м |
3 107 – 3 1010 |
10–3 – 1 |
|
радиоволны |
|
|
|
|
|
Микроволны |
|
10–2 – 10–4 м |
3 1010 –3 1012 |
1 – 102 |
|
|
1 см – 0,1 мм |
|
|
|
|
|
|
|
|
|
|
Дальний ИК |
|
10–4 – 2,5 10–5 м |
3 1012 – 1,2 1013 |
102 – 4 102 |
|
|
100 – 25 мкм |
|
|
|
|
|
|
|
|
|
|
Средний ИК |
|
2,5 10–5–2,5 10–6 м |
1,2 1013 – 1,2 1014 |
4 102 – 4 103 |
|
|
2,5 – 25 мкм |
|
|
|
|
|
|
|
|
|
|
Ближний ИК |
|
2,5 10–6 – 7 10–7 м |
1,2 1014 – 4,3 1014 |
4 103 – 1,43 104 |
|
|
2,5 – 0,7 мкм |
|
|
|
|
|
|
|
|
|
|
Видимый |
|
7 10–7 – 3,6 10–7 м |
4,3 1014 – 8,4 1014 |
1,43 104 – 2,8 104 |
|
|
0,7 – 0,36 мкм |
|
|
|
|
|
|
|
|
|
|
Ближний УФ |
|
360 – 200 нм |
8,4 1014 – 1,5 1015 |
2,8 104 – 5 104 |
|
Дальний УФ |
|
200 – 150 нм |
1,5 1015 – 2 1015 |
5 104 – 6,6 104 |
|
|
9 |
|
|
|
|
Рентгеновский |
150 – 0,1 нм |
2 1015 – 3 1018 |
6.6 104 – 108 |
Гамма-излучение |
< 0,1 нм |
> 3 1018 |
> 108 |
Существует гамма-спектроскопия, рентгеновская спектроскопия, оптическая спектроскопия и радиоспектроскопия. Оптическая спектроскопия включает ультрафиолетовую (УФ) спектроскопию, спектроскопию видимого диапазона и инфракрасную (ИК) спектроскопию. Границы диапазонов являются условными, равно как и соответствующие разделения диапазонов (дальняя, средняя, ближняя области), поскольку свойства излучения постепенно изменяются с длиной волны, и провести резкое разграничение различных областей спектра невозможно.
С точки зрения строения вещества спектроскопию подразделяют в соответствии со свойствами, строением и составом физических объектов. Например, ядерная спектроскопия изучает переходы между уровнями энергии ядер и относится к ядерной физике. Атомная спектроскопия изучает электронные уровни энергии атомов и переходы между ними. Выяснение природы уровней энергии атома водорода сыграло огромную роль, указав путь к расшифровке спектров атомов более сложных элементов.
Молекулярная спектроскопия изучает электронные, колебательные и вращательные уровни энергии и переходы между ними, поэтому спектроскопия молекул отличается разнообразием и большой сложностью спектров по сравнению с атомной спектроскопией, если учесть взаимодействие всех видов движения в молекуле.
Спектроскопия конденсированных сред – кристаллов, аморфных тел и жидкостей – изучает уровни энергии этих систем и переходы между этими уровнями, приводящие иногда к сложным, перекрывающимся и уширенным спектральным полосам, в которых закодирована богатая информация о молекулярных взаимодействиях. Число нерешенных проблем в спектроскопии конденсированного состояния довольно значительно, заметно превосходит число проблем в спектроскопии свободных молекул.
Рассмотрим более детально молекулярную спектроскопию и спектроскопию конденсированных систем (жидкостей и кристаллов). Спектроскопия конденсированного состояния тесно связана с атомной и молекулярной спектроскопией и в значительной степени опирается на результаты этих разделов спектроскопии.
1.2. ШИРИНА УРОВНЕЙ ЭНЕРГИИ И
10

СПЕКТРАЛЬНЫХ ЛИНИЙ
Согласно квантовой механике молекулярная система, которая не подвержена внешним воздействиям (отсутствуют электрические или магнитные поля), находится в некотором стационарном состоянии, характеризующимся определенным значением энергии. Последовательная совокупность возможных значений энергии (уровней энергии) молекулярной системы составляет ее энергетический спектр. Переходы между уровнями будут приводить к спектрам поглощения или испускания, а соответствующие частоты будут удовлетворять боровским условиям (1.1).
Энергетические уровни, а значит, и совокупность уровней – энергетические спектры, разделяются на две основные группы: дискретные и сплошные. На рис. 1.2 приведены уровни энергии различной ширины:
а – строго дискретные, отвечающие определѐнным значениям энергии
Ei и Ek ;
б – дискретные, но уширенные под влиянием различных причин; в – зонные уровни, которые встречаются в твердых телах;
г – сплошные, соответствующие неограниченному движению электрона или в целом молекулы.
a |
|
|
б |
|
в |
|
г |
|
|
|
Ek |
|
|
|
|
|
Ek |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
||||
|
|
|
|
|
|
|
|
Ek |
|
Ei |
|
Ei |
|
|
|
|
Рис.1.2 Уровни энергии молекулярной системы:
а – дискретные; б – дискретно-уширенные; в – зонные; г –
сплошные
Квантовые переходы между строго дискретными уровнями будут приводить к излучению и поглощению света одной частоты, т. е. монохроматическим. Но так как в действительности строго монохроматических линий не существует, то и уровни энергии будут характеризоваться некоторым интервалом ∆Ei энергий – шириной уровня (см. рис.1.2, б). В соответствии с этим каждый квантовый переход, скажем в испускании, характеризуется некоторым интервалом ∆Eкi разностей энергии – шириной линии. Она будет определяться суммой ширин комбинирующих уровней, т. е.
∆Eкi = ∆Eк + ∆Ei. |
(1.5) |
11 |
|
Ширину линии для свободной изолированной молекулярной системы называют естественной, которая следует из соотношения неопределѐнностей между энергией и временем. Если продолжительность существования системы равна t, то неопределенность энергии этой системы Е и связь между ними выражается через соотношение неопределенности:
t Е ~ ħ, |
(1.6) |
где Е – ширина уровня, для которого время жизни τ = |
t. Это |
соотношение характеризует одно из основных свойств микромира. Энергия Е в микромире не может быть определена сколь угодно точно при конечном времени измерения t.
Так как время измерения всегда конечно, а частота ν связана с энергией Е соотношением (1.1), то в измерение частоты всегда входит некоторая неопределенность Δν (погрешность частоты в герцах), а t –
длительность измерения в секундах: |
|
Δν ~ 1/ t/ |
(1.7) |
Например, измеряя частоту при длительности в 1 с нельзя получить точность выше 1 Гц. Наименьшую погрешность можно иметь только при бесконечно большом времени измерения. Уровень энергии будет бесконечно узким, если τ будет равно бесконечности, что имеет место для нормального состояния системы (самого низкого по энергии), для которого τ = ∞. Оценим ширину возбужденного уровня энергии дипольного излучения, для которого τ 10–8 с (см. 1.1.). Из (1.6) следует, что
Е ћ/τ = 6,63·10–34·5,03·1022/6,28 10–8 5,3·10–4 см–1.
Эта величина является малой. Практически наблюдаемые спектральные линии всегда значительно шире (порядка 1 см–1) естественной. так как в реальных условиях действует ряд механизмов, приводящих к уширению спектральных линий. Основная часть этих механизмов относится к взаимодействию молекул. Совместное действие многих причин уширения приводит к определенному контуру спектральных линий, который характеризует распределение интенсивности в линии как непрерывную функцию частоты (I = f(ν), см.
рис. 1.3).
12
