
Komyak_A_I_Molekulyarnaya_spektroskopia
.pdf
E , 1
~e ~0
|
|
|
|
+1/2 |
|
|
|
|
+1 |
|
|
|
|
|
Рис. 3.13. График зависимости , 1 для молекулы |
||||
водорода от |
1/ 2 (для нахождения |
энергии |
||
диссоциации D0) |
|
|||
Разница значений De |
и D0 выражается площадью, |
заштрихованной на |
||
рис. 3.13. Оси абсцисс на рис. 3.13 совпадают. Действительно, при + 1, |
||||||||||||||||||||||
согласно |
(3.35) |
|
|
~ |
|
|
|
а |
при 1 2 0 |
согласно (3.50) |
||||||||||||
1, е , |
|
|||||||||||||||||||||
|
|
|
~ |
. Заштрихованная площадь равна |
|
|
|
|||||||||||||||
E 1, 0 |
|
|
|
|||||||||||||||||||
|
|
~ |
~ |
|
|
|
|
~ |
|
~ |
|
|
|
|
|
|
|
|
|
|
|
|
S |
|
е 0 |
|
1 |
|
2 e e xe |
E |
0 |
(нулевая энергия). |
|
|
|||||||||||
|
|
|
|
|||||||||||||||||||
|
2 |
|
2 |
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
~ |
|
|
~ |
|
~ |
|
|
|
|
|
||||||
|
|
Здесь |
учтено, |
|
|
|
|
|
|
Следовательно, |
площадь |
|||||||||||
|
|
что 0 |
e хe e . |
|
|
|||||||||||||||||
треугольника S |
|
в |
координатах E |
1, |
и |
1 |
меньше |
площади |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|||
другого треугольника на величину E0. Итак, D0 = De – E0 или же |
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
~ |
~2 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
D |
0 |
|
0 |
. |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
4х0 |
~ |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4х 0 |
|
|
|
|||
Получаемые значения энергии диссоциации De и D0, рассчитываемые
описанными выше методами, отличаются от истинных примерно на 15 %, что указывает на то, что формула Морзе, аппроксимирующая реальную кривую потенциальной энергии, является лишь грубым приближением. Экспериментальные точки ложатся не на прямую, а на кривую, которая загибается раньше, т. е. пересекает ось абсцисс при меньших значениях , чем это следует из анализа двучленной формулы
(3.30). На рис. 3.12 и 3.14 показаны кривые зависимости E +1, от квантового числа для молекул H2 и Li2.
113

E , 1
400
300
200
100
0 |
10 |
20 |
30 + 1/2 |
Рис. 3.14. Зависимость E , +1 от колебательного квантового числа для Li2. Заштрихованная площадь дает энергию диссоциации молекулы D0, близкую к экспериментальному ее значению.
Энергия диссоциации определяется как площадь, ограниченная осями координат и реальной кривой, измеренная в соответствующем масштабе.
Энергию диссоциации можно измерить не только спектроскопическими, но и другими методами, которые мы здесь не рассматриваем (например, методом электронного удара, термическим или термохимическим. Знание энергий диссоциации молекул необходимо для термодинамических расчетов в химических реакциях.
Следует отметить, что задача определения энергии диссоциации по спектрам не проста, как может показаться из приведенного изложения. Требуется полная и точная расшифровка колебательного спектра, что не всегда можно довольно полно провести. Например, молекулы Н2, N2 и О2 при обычных условиях не поглощают ИК-радиации (у них отсутствует дипольный момент). Колебательные частоты у аналогичных молекул получают из спектров КР или из ИК-спектров при высоких давлениях, когда при соударениях симметрия (D h) молекулы нарушается и могут наблюдаться оптически неактивные полосы.
3.5. КОЛЕБАТЕЛЬНЫЕ СПЕКТРЫ ДВУХАТОМНЫХ МОЛЕКУЛ С ИЗОТОПНЫМ ЗАМЕЩЕНИЕМ
114

Как мы видели в 2.2, положение колебательных полос в ИК-спектрах молекул зависит от приведенной массы молекулы. Если один из атомов в молекуле заменить ее изотопом, то это почти не повлияет на ее электронную оболочку и, следовательно, на межатомные расстояния и квазиупругую постоянную k, но существенно изменит приведенную
массу |
m1m2 |
|
. |
m m |
|||
1 |
2 |
|
|
Так как положение колебательных полос обратно пропорционально приведенной массе , то при более тяжелой изотопной молекуле положение полос будет сдвигаться влево в частотной шкале, а величина сдвига будет определяться различием в приведенных массах. Например, для водорода Н2 и D2 это различие максимально, так как приведенные массы различаются в 2 раза. Для других более тяжелых молекул это различие невелико.
Рассмотрим изменение колебательных частот для молекул, содержащих атом водорода Н, который может быть заменен атомом дейтерия D, имеющим вдвое большую массу. Указанная процедура в химии называется дейтерированием, которое приводит к довольно значительному изменению частот колебаний. Например, возьмем отношение частот колебаний Н2 и D2
~H 2 |
|
|
|
|
|
|
|
|
|
|
D2 |
|
|
|
|
||
e |
|
|
|
2 1,41, |
( 3.55) |
|||
~D2 |
|
H 2 |
||||||
|
|
|
|
|
||||
e |
|
|
|
|
|
|
||
т. е. частота колебаний молекулы водорода в 
 2 раз больше частоты колебаний молекулы дейтерия. Действительно, сравнение частот колебаний этих молекул, приведенных в табл. 3.1 показывает, что их отношение равно 1,41, что совпадает с (3.55). Если сравнить различие
2 раз больше частоты колебаний молекулы дейтерия. Действительно, сравнение частот колебаний этих молекул, приведенных в табл. 3.1 показывает, что их отношение равно 1,41, что совпадает с (3.55). Если сравнить различие
частот колебаний в молекуле Cl352 и Cl372 , то оно будет небольшим, так как отношение частот колебаний близко к единице:
|
|
35 |
37 |
|
|
18,5 |
|
|
|
|
|
|
|
|
~Cl2 |
~Cl2 |
|
|
|
|
|
|
|||
|
|
e |
e |
|
|
|
|
|
|
1,028 . |
|
(3.56) |
|
|
17,5 |
|
|
||||||||
|
|
|
|
|
|
|
|
|
||||
При частоте колебаний Cl352 , равной 560 см–1, это различие составит |
||||||||||||
–1 |
|
|
|
|
|
|
~ 2 |
4401 см |
–1 |
) и дейтерия |
||
16 см |
, а разница в частотах для водорода ( e |
|
||||||||||
~ D 2 |
–1 |
) составляет 1283 см |
–1 |
. |
|
|
|
|
|
|
|
|
( e |
3118 см |
|
|
|
|
|
|
|
|
|||
Рассмотрим |
в общем случае более подробно отношение |
изотопических |
частот . Обозначим массы атомов в изотопически |
|
115 |

незамещенной молекуле через m1 и m2 , а в изотопически замещенной – |
||||||||||||||||||
через |
|
|
. Тогда выражение |
|
|
|
|
|
|
|||||||||
m1 |
и m2 |
|
|
|
|
|
|
|||||||||||
|
|
|
|
~ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m1 |
m2 |
|
|
|
|
|||
|
|
|
|
e |
|
|
|
m1 |
m2 |
. |
(3.57) |
|||||||
|
|
|
~ |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
m1 |
m2 |
|
||||||||
|
|
|
|
e |
|
|
|
|
|
|
m1 |
m2 |
|
|||||
В случае изотопического замещения лишь одного из атомов (например, m2 = m'2) сводится к формуле:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m2 ) |
|
|
|
|
m1 (m1 |
. |
(3.58) |
|||||
|
|
|
|
|||||
|
|
(m1 |
m2 ) |
|
||||
|
|
m1 |
|
|||||
При дейтерировании двухатомной молекулы соотношение (3.58) можно переписать следующим образом:
|
|
|
|
|
2 m2 |
|
|
|
|
|
|
1 |
|
|
|
||||
|
|
|
|
, |
(3.59) |
||||
|
1 m |
||||||||
|
|
2 |
|
|
|
|
|
||
|
|
|
|
|
2 |
|
|
|
|
где m2 – масса атома, отличного от водорода. Когда эта масса достаточно велика, т. е. m2 >> m1 , то величина будет стремиться к своему
предельному значению 
 1
1 2 0,707. Этот результат физически понятен,
2 0,707. Этот результат физически понятен,
так как при большой массе m2 практически колеблется только атом
водорода (m1).
Для случая, когда массы изотопов будут мало отличаться друг от друга (например, ( Cl352 и Cl372 ), изменение частот колебаний будет невелико, т. е. будет мало отличаться от единицы. Пусть m1 = m2 и m'1 = m'2 , но m'2 =m1 + , где есть разность в изотопических массах, на основании (3.57) получим
|
|
|
1 |
|
1 |
|
, |
(3.60) |
|
m |
|
||||||
1 |
|
|
m |
|
|
|||
|
|
|
1 |
|
|
1 |
|
|
т. е. относительное изменение частот порядка  m1 . Для указанных
m1 . Для указанных
молекул это отличие равно 0,057. Необходимо при этом отметить, что различие в частотах колебаний изотопных молекул в обертонах выше, чем у основных тонов, и это различие тем больше, чем выше порядок обертона.
Метод изотопических замещений оказывается очень полезным при рассмотрении колебаний многоатомных молекул, так как позволяет относить полученные в ИК-спектре полосы к колебаниям соответствующих групп атомов в сложной молекуле.
116
В заключение необходимо отметить, что изотопическое замещение одного из атомов в двухатомной молекуле может приводить к появлению полос в ИК-спектре поглощения для молекул, не обладающих
дипольным моментом и относящихся к симметрии D h . Если молекула состоит из разных изотопов (например, HD и Сl37 Cl35), то колебание у этой молекулы происходит несимметричным образом и возникает переменный дипольный момент, обуславливающий поглощение ИК радиации. Симметрия молекулы при этом нарушается колебаниями, которые не являются полносимметричными. Только при одинаковых
ядрах двухатомная молекула при колебаниях сохраняет симметрию D h, при этом указанная молекула не будет поглощать или испускать ИКрадиацию. Чем больше различие в массах колеблющихся атомов, тем больше асимметрия колебаний, тем интенсивнее соответствующая полоса в ИК-спектре.
Эффект изотопного замещения в колебательных спектрах дает чувствительный и довольно точный метод обнаружения изотопов и измерения их относительных количеств путем измерения интенсивностей линий.
3.6. КОЛЕБАТЕЛЬНО-ВРАЩАТЕЛЬНЫЕ СПЕКТРЫ ДВУХАТОМНЫХ МОЛЕКУЛ
3.6.1. Общая характеристика колебательно-вращательных
спектров двухатомной молекулы.
Величины колебательных квантов (100 – 1000 см –1) на два порядка больше величин вращательных квантов (1 – 10 см–1). Поэтому возбуждение колебательных уровней энергии всегда сопровождается изменением вращательной энергии молекулы, что приводит к возникновению колебательно-вращательного спектра, т. е. происходит одновременное возбуждение как колебаний, так и вращений молекулы. Так как изменения вращательной энергии малы по сравнению с изменениями колебательной энергии, то в спектрах получаются полосы, которые соответствуют определенному колебательному переходу и структура которых обусловлена вращательными переходами т. е. колебательно-вращательные полосы. Вращательную структуру колебательных полос можно разрешить, применяя приборы с высокой разрешающей способностью (большая дисперсия) и при записи спектров газовых образцов. В этом случае вращательные полосы распадаются на
117
ряд отдельных линий, соответствующих отдельным вращательным переходам.
Изменение внутренней энергии молекулы Евн можно представить как изменение ее колебательной Екол, и вращательной Евр энергий. Пусть колебательный переход происходит между нижним и верхним колебательными уровнями, а внутренняя энергия нижнего состояния будет представляться суммой колебательной и вращательной энергий:
|
|
|
|
|
1 . |
(3.61) |
Eвн E B J |
J |
|
||||
Аналогичную формулу можем записать и для верхнего колебательного уровня
|
|
|
|
1 . |
(3.62) |
Eвн E B J J |
|
||||
В формулах (3.61) и (3.62) значок «''» относится к нижнему, а «'» – к верхнему колебательному уровню.Связь колебаний с вращениями
выражается в том, что вращательная постоянная В оказывается зависящей от колебательного квантового числа . Эта зависимость приближенно выражается формулой
B =Be – e( + 1/2), |
(3.63) |
где e – постоянная, отношение которой к Be имеет такой же порядок, как и постоянная ангармоничности xe, т. е. не превышает нескольких сотых. Be – вращательная постоянная, соответствующая равновесному расстоянию между атомами.
Зависимость вращательной постоянной от колебательного ( ) квантового числа обусловлена изменением момента инерции молекулы при возбуждении колебаний. Действительно, при возбуждении высоких колебательных уровней двухатомной молекулы ее равновесное расстояние увеличивается, что приводит к увеличению вращательного момента (I) и соответственно к уменьшению вращательной постоянной B. Например, для молекулы СО значения вращательных постоянных дляи соответственно равны B0 = 1,915 см–1 и В1 = 1,898 см–1, что соответствует величине е = 0,0175 см –1 (отношение В = 0,009, постоянная ангармоничности xe для этой молекулы равна 0,0061).
Для выяснения общего характера вращательной структуры колебательного спектра мы воспользуемся независимостью колебательной и вращательной энергии молекулы в предположении жесткости вращения молекулы. Вычислим разность значений энергии между двумя колебательно-вращательными уровнями
J ,J |
|
|
|
|
|
|
|
|
|
1 . |
|
|
E , |
(3.64) |
|||||||||||
Eвн Eвн E E B J J |
|
1 B J |
J |
|
||||||||
|
|
|
|
118 |
|
|
|
|
|
|
|
|
Если измерять энергию в см–1, то эта разность даст нам частоту чисто
колебательного перехода ~кол , которая получилась бы при J' = J'' = 0, и
0
частоты вращательных переходов
~ |
|
|
|
|
|
1 . |
(3.65) |
|
|||||||
вр B J J 1 B J |
J |
|
|||||
В силу запрета переходов J' = J'' = 0 (даже при правиле отбора J = 0) нулевая линия чисто колебательного перехода не может наблюдаться, и ее положениe определяется расчетом. Вращательная структура колебательной полосы определяется выражением (3.65). Существенная разница выражения (3.65) по сравнению с аналогичным выражением (2.17) для чисто вращательных спектров заключается в том, что в выражении (3.65) В' и В' относятся к разным колебательным состояниям молекулы, в то время как в чисто вращательных спектрах постоянная В относилась к одному колебательному состоянию. Влияние центробежного растяжения на величину B в чисто вращательных спектрах для небольших J мало, и им будем пренебрегать. Отличие В' от В' в формуле (3.65), определяемой зависимостью вращательной постоянной от колебательного квантового числа , более существенно. Согласно правилам отбора по вращательному квантовому числу J могут комбинировать между собой соседние вращательные уровни, относящиеся к различным колебательным состояниям, одинаковые вращательные уровни (кроме уровней J'–J" = 0) и вращательные уровни через один, т.е., J = J' – J" = 0, . Заданному значению J будет соответствовать ряд переходов, отличающихся J' и соответственно J". Совокупность вращательных линий при таких переходах называют ветвью соответствующей полосы. Эти ветви принято обозначать латинскими буквами в зависимости от J:
J = J' – J" = –2 |
(О-ветвь) |
J = J' – J" = –1 |
(Р-ветвь) |
J = J' – J" = 0 |
(Q-ветвь) |
J = J' – J" = +1 |
(R-ветвь) |
J = J' – J" = +2 |
(S-ветвь) |
Одни из таких ветвей будут обнаруживаться в спектрах ИКпоглощения и испускания, другие – в спектрах КР. Для всех этих переходов с изменением дипольного момента J будет изменяться на 1, т. е. будут обнаруживаться R и Р-ветви (иногда может обнаруживаться Q-ветвь, если в нормальном состоянии двухатомная молекула будет обладать электронным орбитальным моментом, отличным от нуля). В
119
спектрах КР наблюдаются Q.-, S- и О-ветви. Рассмотрим характеристики ветвей для ИК-поглощения.
3.6.2 Колебательно-вращательные спектры. ИК-поглощения
Колебательно-вращательные спектры, соответствующие дипольным переходам в ИК области, подвержены следующим правилам отбора для
вращательного квантового числа |
|
J = J' – J" = 1. |
(3.66) |
Это правило отбора относится к молекулам, не обладающим в нижнем электронном состоянии механическим моментом (преимущественно сюда относятся молекулы, находящиеся в -состоянии). Колебательные полосы таких молекул будут состоять из R-ветви, т. е. совокупности линий, для которых J = J' – J" = 1, и Р-ветви, т. е. совокупности линий, для которых J = J' – J" = –1.
Схема переходов, дающих колебательно–вращательную полосу для
R- и P-ветвей |
в ИК-спектре поглощения, показана на рис. 3.15. Частоты |
|
R-ветви всегда расположены в коротковолновую сторону от частоты |
||
~кол |
, а частоты Р-ветви расположены с длинноволновой стороны. |
|
0 |
||
Выражая |
Е = Е'вн – Е''вн и частоты переходов в одних и тех же |
|
единицах (см–1), мы получим соответствующие формулы для R-ветви
(J'– J" = 1)
~ R
,J
или, выражая J'' через J'
~ R
,J
~кол |
|
|
|
|
|
|
|
|
0 |
B J J 1 B J J 1 , |
|||||||
(J'' = |
J' – 1), получим |
|
|
|
||||
кол |
|
|
|
|
|
|
2 |
, |
0 |
B B J |
|
B B J |
|
||||
(3.67)
(3.68)
где J' = 1, 2, 3, ...(см. рис.3.15)
Аналогично получим, если произвести замену J' через J''(J'= J'' + 1)
~ R |
~кол |
|
|
|
J |
|
|
|
2 |
, |
(3.69) |
,J |
0 |
2B 3B B |
|
B B J |
|
||||||
где J' = 0, 1, 2, 3, ...
120
6
5
4
J' |
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
||
|
1 |
|
=1 |
|
|
|
|||
|
|
|||
|
0 |
|
||
|
|
|
||
|
6 |
|
|
|
|
|
|
||
|
5 |
|
|
|
J'' |
4 |
|
|
|
|
3 |
|
|
|
2 
1 =0
0
Р-ветвь |
0кол |
R-ветвь |
|
|
|
3.15. Схема переходов, дающих в ИК-спектре поглощения |
|
|
|
||
двухатомной молекулы R- и Р- ветви |
|
|
|
||
Формулы (3.68) и (3.69), |
|
~ |
|
~кол |
, |
дают ряд линий с частотами |
0 |
||||
которые при B' = B'' , были бы равноотстоящими, но в силу наличия квадратичного члена с B' B' будут сходиться. Если бы B' B'' , линии расходились бы. Для колебательно-вращательных спектров имеет место именно первый случай B' B'' , так как ' ''.
Аналогичную картину распределения линий вращательной структуры имеем для Р-ветви (J' – J'' = –1).
~ p |
~кол |
|
|
|
|
|
|
|
|
|
2 |
, |
(3.70) |
||
, J |
0 |
|
- B B J |
|
B - B J |
|
|
|
|||||||
если выражать J' через J'' (здесь J'' = 1,2 , 3, ...). Можно получить и |
|||||||||||||||
другую формулу |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
~ p |
~кол |
|
|
|
|
|
|
|
|
2 |
, |
|
|
(3.71) |
|
,J 0 |
- 2B 3B - B J |
|
B |
B J |
|
|
|
|
|||||||
если; выразить J'' через J'. Формулы (3.70) и (3.71) также дают ряд линий
~ ~кол
с0 , которые при B' = B'' были бы равноотстоящими, а в силу
наличия квадратичного члена с B' B'' будут расходиться (при B' B'' они сходились бы). Проанализируем формулы (3.68) и (3.70), которые подобны по своей записи, если J' и J'' принимают значения 1, 2, 3, ...
121

Разница этих формул состоит только в знаке линейного члена. Если в формуле (3.68) принять J' = m , где m = 1, 2, 3, ..., а в равенстве (3.70) положить J'' = –m , то обе формулы становятся одинаковыми и их можно записать в виде
~R,P |
~кол |
|
|
|
|
|
2 |
, |
(3.72) |
, J |
0 |
B B m B - B m |
|
||||||
где m = 1, 2, 3,... для |
R-ветви; |
|
m = |
–1, –2, |
–3, |
|
... |
для Р-ветви. В |
|
соответствии со знаком m часто R-ветвь называют положительной, а Р- ветвь – отрицательной ветвью. Зная расстояния между линиями P- и R- ветвей, можно по формулам (3.73) и (3.70) приблизительно оценить вращательную постоянную, а затем найти равновесное расстояние rе. На рис. 3.16 приведен колебательно-вращательный спектр ИК-поглощения молекулы НСl. Применяя формулу (3.72), нужно всегда помнить, что m > 0 соответствует значению вращательного квантового числа J = J' для верхнего колебательного уровня, a m < 0 – значению квантового числа J = J'' для нижнего,так что симметрия формулы (3.72) не является полной.
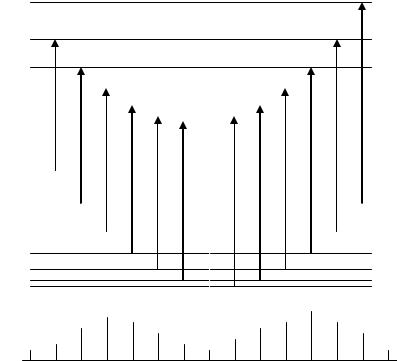
На рис. 3.16 линии R-ветви расположены справа |
от колебательной |
|
~кол |
~кол |
, отсутствующая в |
частоты |
, а Р-ветви – слева. Нулевая линия 0 |
|
колебательно-вращательном спектре, соответствует случаю m = 0. В
случае B' = B'' формула (3.72) упрощается и принимает вид |
||||
~ R, P |
~кол |
2Bm. |
(3.73 |
|
, J |
|
0 |
||
Выражение (3.73) дает |
равноотстоящие |
линии, симметрично |
||
|
|
|
|
~кол |
расположенные относительно чисто колебательной полосы 0 . |
||||
В случае двухатомных молекул, у которых электронный момент количества движения не равен нулю, наряду с R- и Р-ветвью появляется Q-ветвь (нулевая) ( J = J' – J'' = 0). Для Q-ветви получаем (J = J' = J'')
~ |
|
~ |
|
|
|
|
|
Q |
|
кол |
B - B J J 1 |
|
|
,J |
0 |
(3.74) |
||||
Iотн
~0кол
2700~ |
-1 |
2800 |
2900 |
Рис. 3.16. Колебательно-вращательный спектр
ИК-поглощения НСl. Смесь двух изотопических молекул НСl35 – 75 %, НСl37 – 25 %
122
