
- •Передмова
- •МЕХАНІКА
- •1. КІНЕМАТИКА МАТЕРІАЛЬНОЇ ТОЧКИ
- •1.1. Основні поняття
- •1.4. Прямолінійний рух
- •1.5. Криволінійний рух. Рівномірний рух по колу
- •2. ДИНАМІКА МАТЕРІАЛЬНОЇ ТОЧКИ
- •2.1. Основні закони динаміки. Сила. Рівнодійна сила
- •2.2. Сили в механіці
- •2.4. Алгоритм розв’язання кількісних задач із фізики
- •2.5. Методичні рекомендації щодо розв’язання задач з динаміки
- •2.6. Приклади розв’язання задач
- •3. ЗАКОНИ ЗБЕРЕЖЕННЯ В МЕХАНІЦІ
- •3.1. Імпульс тіла. Імпульс сили
- •3.2. Закон збереження імпульсу
- •3.3. Реактивний рух
- •3.4. Енергія. Закон збереження енергії. Види енергії
- •3.5. Види механічної енергії та їх зв’язок з роботою
- •3.6. Механічна робота і потужність
- •3.7. Механічний удар
- •3.8. Прості механізми
- •4. МЕХАНІКА ТВЕРДОГО ТІЛА
- •4.1. Основні поняття
- •4.2. Умови і види рівноваги твердого тіла
- •4.3. Момент імпульсу. Закон збереження моменту імпульсу
- •4.4. Зіставлення рівнянь механіки поступального й обертального рухів (табл. 2)
- •4.5. Приклади розв’язання задач
- •5. ГІДРОСТАТИКА І АЕРОСТАТИКА
- •5.1. Тиск
- •5.2. Закон Паскаля
- •5.3. Гідростатичний тиск
- •5.4. Сполучені посудини
- •5.5. Гідростатичний парадокс
- •5.6. Гідравлічна машина
- •5.7. Закон Архімеда
- •5.8. Умови плавання тіл (табл. 3)
- •5.9. Атмосферний тиск, його вимірювання
- •5.10. Приклади розв’язання задач
- •6. ГІДРОДИНАМІКА І АЕРОДИНАМІКА
- •6.1. Струминна течія рідин і газів
- •6.2. Рівняння Бернуллі
- •6.3. Підйомна сила крила літака
- •6.4. Коефіцієнт лобового опору для тіл різної форми (табл. 4)
- •1. ОСНОВИ МОЛЕКУЛЯРНО-КІНЕТИЧНОЇ ТЕОРІЇ БУДОВИ РЕЧОВИНИ
- •1.1. Основні положення молекулярно-кінетичної теорії та їх дослідне обґрунтування
- •2. ВЛАСТИВОСТІ ГАЗІВ (ГАЗОВІ ЗАКОНИ)
- •2.2. Газові закони
- •2.3. Закон Дальтона
- •2.5. Середня довжина вільного пробігу молекул
- •2.6. Приклади розв’язання задач
- •3. ВЛАСТИВОСТІ ПАРИ
- •3.1. Пара. Випаровування і конденсація
- •3.2. Насичена і ненасичена пара
- •3.3. Вологість повітря (відносна й абсолютна). Точка роси
- •3.4. Кипіння. Перегріта рідина
- •3.5. Приклади розв’язання задач
- •4.2. Поверхнева енергія. Поверхневий натяг
- •4.3. Явище змочування. Капілярні явища
- •4.4. Формула Лапласа
- •4.5. Приклади розв’язання задач
- •5. ВЛАСТИВОСТІ ТВЕРДИХ ТІЛ
- •5.1. Кристалічні та аморфні тіла. Їхні властивості
- •5.2. Типи твердих кристалів
- •5.3. Рідкі кристали
- •5.4. Дефекти кристалічних ґраток
- •5.5. Механічні властивості твердих тіл
- •5.6. Приклади розв’язання задач
- •6. ТЕПЛОВЕ РОЗШИРЕННЯ ТВЕРДИХ І РІДКИХ ТІЛ
- •6.1. Графік залежності потенціальної енергії взаємодії найпростіших молекул від відстані між ними (потенціальна яма)
- •6.2. Лінійне й об’ємне розширення твердих і рідких тіл
- •6.3. Особливості теплового розширення води
- •6.4. Приклади розв’язання задач
- •1.1. Внутрішня енергія ідеального газу
- •1.2. Робота ідеального газу. Її геометричне тлумачення
- •1.5. Питома теплоємність речовини
- •1.6. Питома теплота згоряння палива. ККД нагрівача
- •1.7. Змінювання агрегатного стану речовини
- •2. ПЕРШИЙ ЗАКОН ТЕРМОДИНАМІКИ. АДІАБАТИЧНИЙ ПРОЦЕС
- •3. ДРУГИЙ ЗАКОН ТЕРМОДИНАМІКИ. ЕНТРОПІЯ
- •4. ТЕПЛОВІ ДВИГУНИ
- •ЕЛЕКТРОДИНАМІКА
- •1. ЕЛЕКТРОСТАТИКА
- •1.1. Електричний заряд. Закон збереження заряду
- •1.7. Електризація тіл
- •2. ПОСТІЙНИЙ СТРУМ
- •2.1. Електричний струм. Сила струму. Густина струму
- •2.3. Послідовне і паралельне з’єднання провідників
- •2.4. ЕРС. Закон Ома для повного кола. З’єднання елементів
- •2.6. Приклади розв’язання задач
- •3. СТРУМИ ПРОВІДНОСТІ
- •3.2. Струм в електролітах
- •3.4. Струм у напівпровідниках
- •3.5. Струм у вакуумі (струм переносу)
- •3.6. Приклади розв’язання задач
- •4. МАГНЕТИЗМ
- •4.1. Магнітне поле. Магнітна індукція поля
- •4.2. Магнітне поле струму
- •4.3. Дія магнітного поля на рухомий заряд (сила Лоренца) і провідник зі струмом (сила Ампера). Правило лівої руки
- •4.4. Дія магнітного поля на рамку зі струмом. Магнітний потік
- •4.5. Закон взаємодії паралельних струмів
- •4.6. Магнітне поле у речовині
- •4.7. Приклади розв’язання задач
- •5. ЕЛЕКТРОМАГНІТНА ІНДУКЦІЯ
- •5.1. Явище електромагнітної індукції. Вихрове електричне поле
- •5.3. Індукційні струми в суцільних провідниках
- •5.4. Самоіндукція. Індуктивність. Енергія магнітного поля
- •5.5. Електромагнітне поле. Теорія Максвелла в якісному вигляді
- •5.6. Приклади розв’язання задач
- •ФІЗИКА КОЛИВАНЬ
- •1. КОЛИВАЛЬНИЙ РУХ
- •1.1. Основні поняття
- •1.2. Гармонічні коливання
- •2. ЗМІННИЙ СТРУМ
- •2.1. Одержання змінного синусоїдного струму. Закономірності змінного струму
- •2.2. Діюче значення змінного струму
- •2.3. Опір змінному струму. Закон Ома для змінного струму
- •2.4. Електричний резонанс. Резонанс напруг. Резонанс струмів
- •2.5. Випрямлення змінного струму
- •2.6. Трансформація змінного струму
- •2.7. Змінний струм високої частоти
- •2.8. Приклади розв’язання задач
- •3. ЕЛЕКТРОМАГНІТНІ КОЛИВАННЯ
- •3.2. Закономірності вільних електромагнітних коливань. Згасаючі коливання
- •3.3. Отримання незгасаючих електромагнітних коливань
- •3.4. Приклади розв’язання задач
- •4. МЕХАНІЧНІ ХВИЛІ. ЗВУК
- •4.1. Поздовжні і поперечні хвилі. Промінь. Довжина хвилі. Фронт хвилі
- •4.2. Принцип Гюйгенса
- •4.3. Інтерференція хвиль
- •4.4. Дифракція хвиль
- •4.5. Звук. Звукові хвилі. Інтенсивність, висота і тембр звуку
- •4.6. Луна. Звуковий резонанс
- •4.7. Приклади розв’язання задач
- •5. ЕЛЕКТРОМАГНІТНІ ХВИЛІ
- •5.1. Випромінювання електромагнітних хвиль відкритим коливальним контуром
- •5.3. Принцип радіозв’язку. Модуляція і детектування (демодуляція)
- •5.4. Класифікація радіохвиль і особливості їх поширення
- •5.5. Приклади розв’язання задач
- •ОПТИКА
- •1. ХВИЛЬОВА ОПТИКА
- •1.1. Монохроматичне світло. Заломлення світла
- •1.2. Дисперсія світла
- •1.4. Інтерференція білого світла за Френелем
- •1.5. Інтерференція білого світла за Ньютоном. Кільця Ньютона
- •1.6. Дифракція білого світла
- •1.7. Поляризація світла
- •2. ГЕОМЕТРИЧНА ОПТИКА
- •2.2. Закони відбивання світла
- •2.3. Закони заломлення світла. Повне відбивання світла
- •2.4. Хід променів через плоскопаралельну пластинку, призму
- •2.5. Сферичні лінзи
- •2.6. Око як оптична система
- •2.8. Сферичні дзеркала
- •2.9. Приклади розв’язання задач
- •3. ВИПРОМІНЮВАННЯ ТА СПЕКТРИ
- •3.1. Люмінесценція
- •3.2. Інфрачервоні та ультрафіолетові промені
- •3.3. Рентгенівські промені
- •3.4. Спектри випромінювання. Спектри поглинання
- •3.5. Спектральний аналіз
- •1.1. Поняття про простір і час
- •1.2. Постулати СТВ. Перетворення Лоренца
- •1.4. Приклади розв’язання задач
- •2. КВАНТОВА ОПТИКА
- •2.1. Теорія Планка. Імпульс фотона
- •2.2. Фотоефект
- •2.3. Фотоелементи та їх застосування
- •2.4. Світловий тиск
- •2.5. Корпускулярно-хвильовий дуалізм
- •2.6. Хімічний вплив світла. Чорно-біла фотографія. Фотосинтез. Ланцюгові реакції
- •2.7. Приклади розв’язання задач
- •3. ФІЗИКА АТОМА
- •3.1. Планетарна модель атома Резерфорда
- •3.2. Постулати Бора. Борівські орбіти
- •3.3. Атом Гідрогену за Н. Бором
- •3.4. Приклади розв’язання задач
- •4. ФІЗИКА АТОМНОГО ЯДРА
- •4.1. Відкриття протона і нейтрона
- •4.2. Теорія будови ядра
- •4.3. Енергія зв’язку ядра. Дефект маси
- •4.4. Природна радіоактивність
- •4.6. Часткове звільнення внутрішньоядерної енергії при екзотермічних ядерних реакціях
- •4.7. Закон радіоактивного розпаду
- •4.8. Приклади розв’язання задач
- •5. ЕЛЕМЕНТАРНІ ЧАСТИНКИ
- •5.1. Фізика елементарних частинок
- •5.2. Приклади розв’язання задач
- •Предметний покажчик
2. Перший закон термодинаміки. Адіабатичний процес
При кристалізації тіла виділяється така сама кількість
теплоти, яка була витрачена на його плавлення.
Питома теплота пароутворення (конденсації) (L) — це величина, яка чисельно дорівнює кількості теплоти, яку необхідно витратити для перетворення 1 кг рідини на пару при незмінній температурі:
L = mQ .
Одиниця питомої теплоти плавлення і пароутворення —
«джоуль на кілограм» (Дж/кг). При конденсації пари у рідину виділяється така сама кількість теплоти, яка була витрачена на її випаровування.
Внутрішня енергія тіла змі нюється при нагріванні або охо-
лодженні, пароутворенні або конденсації , плавленні або кристалізації. У всіх випадках тілу передається або від нього відні-
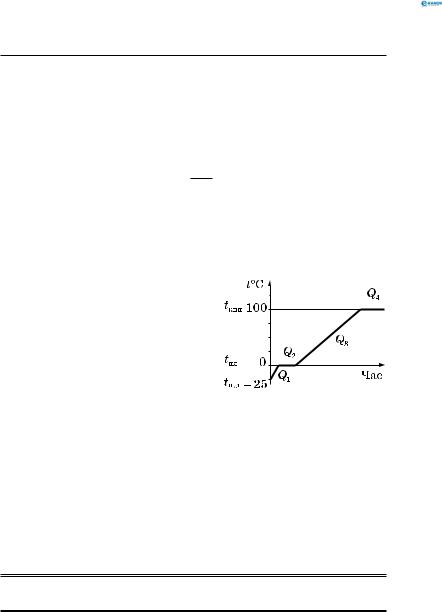
мається деяка кількість теплоти. Графік залежності темпера-
тури від часу для кристалічного тіла при зміні його агрегатного стану (т. т. → р. → п.) зображений на рис. 152.
Наприклад, лід → вода → водяна пара при нормальному атмосферному тиску:
Q1 = cлm(tпл −tп. л ), Q2 = λm ,
Q3 = cвm(tкип −tпл ) , Q4 = Lm.
2. Перший закон термодинаміки. Адіабатичний процес
Закон збереження і перетворення енергії, поширений на теплові явища, називається першим законом (першим
началом) термодинаміки.
191

Основи термодинаміки
Зміна внутрішньої енергії ∆U при переході її із одного стану в інший дорівнює сумі роботи зовнішніх сил A і кількості теплоти Q, переданої системі:
∆U = Q + A .
Якщо система сама виконує роботу A′ над зовнішніми тілами, то (оскільки A′ = − A ) перший закон термодинаміки зручно формулювати так: кількість теплоти Q, передана системі, витрачається на зміну її внутрішньої енергії ∆U і наздійсненнясистемоюроботи A′ надзовнішнімитілами:
Q = ∆U + A′.
Застосування першого закону термодинаміки до різних
ізопроцесів у газі подано в табл. 6.
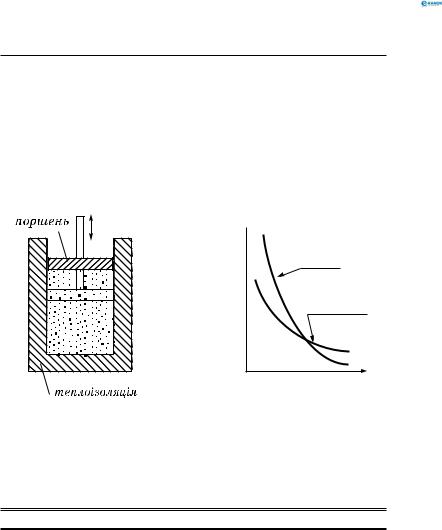
Адіабатичний процес — процес у теплоізольованій сис-
темі (рис. 153, а):
Q =0.
Рівняння Пуассона для адіабатичного процесу в ідеальному газі:
ν = |
Cp |
|
= |
i +2 |
|
— це відношення молярних (чи питомих) те- |
||
C |
i |
|
||||||
|
|
|
|
|
|
|||
|
v |
|
|
|
|
|
|
|
плоємностей газу при сталому тиску й об’ємі. |
||||||||
|
|
|
|
|
|
|
|
Таблиця 6 |
|
|
|
|
|
||||
Ізотермічний |
|
Ізохоричний |
Ізобаричний |
Адіабатичний |
||||
T = const , |
|
V = const , |
p = const , |
|||||
m = const |
|
m = const |
m = const |
Q =0 |
||||
|
|
|||||||
|
|
|
|
|
|
|
||
∆T =0 |
|
|
|
∆V =0 |
∆p =0 |
Q =0 |
||
|
|
|
|
|
|
|
||
∆U =0 |
|
|
|
A′ =0 |
Q = ∆U + A′ |
∆U + A′=0 |
||
|
|
|
|
|
|
|
||
Q = A′ |
|
|
|
Q = ∆U |
|
∆U = − A′ |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
∆U = A |
|
|
|
|
|
|
|
|
|
Діаграма адіабатичного процесу в координатах p, V.
Адіабата ( pVν = const) розміщується більш круто, ніж ізотерма (T = const, pV = const). Це пояснюється тим, що при
192
3. Другий закон термодинаміки. Ентропія
адіабатичному стисненні збільшення тиску газу зумовлено не тільки зменшенням його об’єму, як при ізотермічному стисненні, а й підвищенням температури. При адіабатичному розширенні температура знижується (∆U = −A′) , при стисненні — підвищується (∆U = A) (рис. 153, б).
Оскільки ідеальної теплоізолюючої оболонки бути не може, адіабатичний процес у природі може бути тільки швидкоплинним: Q →0.
p 
Q 0
T const
0 |
V |
|
|
а |
б |
Рис. 153 |
|
3. Другий закон термодинаміки. Ентропія
Другий закон (друге начало) термодинаміки:
—Неможливо здійснити такий періодичний процес, єдиним наслідком якого було б повне перетворення на роботу теплоти, отримуваної від нагрівача (формулювання Кельвіна).
—Неможливий процес, єдиним результатом якого є передача енергії у формі теплоти від менш нагрітого тіла до більш нагрітого (формулювання Клаузіуса).
193

Основи термодинаміки
—Вічний двигун другого роду неможливий, тобто двигун, ККД якого при перетворенні теплоти на роботу дорівнює 100 % (формулювання Карно).
Упорядкований рух може переходити в неупорядкований спонтанно (природний процес) — це, наприклад, перетворення механічної енергії на теплову. Зворотний процес спонтанно відбуватися не може (необоротний процес), але він можливий за умови виконання роботи зовнішніми силами.
Друге начало термодинаміки визначає направленість процесу, його ймовірність. Імовірність події вимірюється відношенням кількості способів її здійснення до кількості
способів здійснення всіх можливих подій.
Ентропія (S) — це функція, що характеризує міру хаотичності в системі, яка перебуває у стані, імовірність здійснення якого w. При цьому ентропія пропорційна логарифму ймовірності: S = k lnw. Якщо стан системи установлюється єдиним способом, його ймовірність w = 1, а ентропія
S= k ln1= 0.
Утакій термінології друге начало термодинаміки формулюється так:
—Можливі лише такі процеси, при яких ентропія не змінюється або зростає:
∆S 0 (нерівність Клаузіуса).
4. Теплові двигуни
Тепловий двигун — машина, що перетворює внутрішню енергію палива на механічну енергію.
Тепловий двигун має працювати циклічно; після розширення газу настає стиснення.
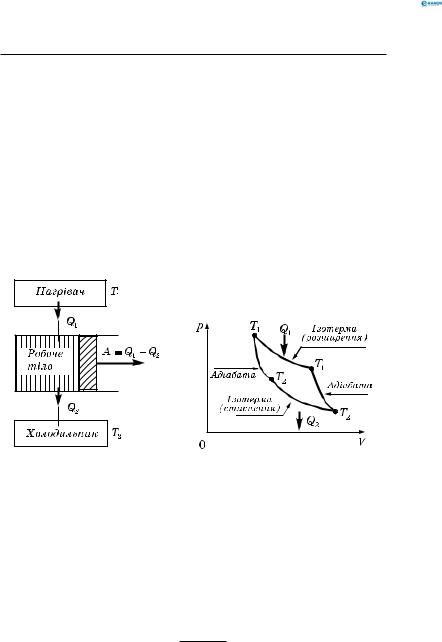
Три основні частини теплового двигуна (рис. 154, а):
1)нагрівач (T1 ) — джерело внутрішньої енергії;
2)робоче тіло (газ або пара), що виконує механічну роботу за рахунок внутрішньої енергії, отриманої від нагрівача;
194
4. Теплові двигуни
3)холодильник (T2 <T1 ) , що забезпечує природний процес передачітеплавідбільшнагрітоготіладобільшхолодного, чим здійснює компенсацію процесу перетворення тепло-
воїенергіїнамеханічну.Холодильникомможебутиоточуюче середовище (так охолоджується радіатор побутового кондиціонера, радіатор двигуна внутрішнього згоряння). Цикл Карно — схема ідеальної теплової машини (з най-
вищим ККД).
Робота газу, що здійснюється, повністю відбувається за рахунок кількості теплоти, відданої нагрівачем. При стисненні газу робота зовнішніх сил повністю перетворюється на теплоту, що віддається холодильнику (рис. 154, б).
|
|
а |
б |
|
Рис. 154 |
Термодинамічний (термічний) ККД теплового двигуна:
ηт = |
Q1 −Q2 |
, де Q1 −Q2 = Aробочого тіла . |
Q |
||
|
1 |
|
Теорема Карно: термічний ККД циклу Карно не залежить від природи робочого тіла і є лише функцією температур нагрівача (T1 ) і холодильника (T2 ) :
ηі = T1 −T2 .
T1
ККД реальних теплових машин менший від ККД ідеальної машини. У реальній тепловій машині завжди наявні
195
Основи термодинаміки
втрати на нагрівання, механічну роботу в механізмі машини; таким чином, корисна робота є меншою за роботу робочого тіла:
Економічний ККД теплової машини — це відношення корисної роботи двигуна (Aкор = N t) до кількості теплоти, виділеної при згорянні палива:
Aкор .
qm
Деякі види теплових машин:
1.Парова і газова турбіни.
2.Парові машини.
3.Поршневі двигуни внутрішнього згоряння: а) карбюраторні (бензинові), б) дизелі.
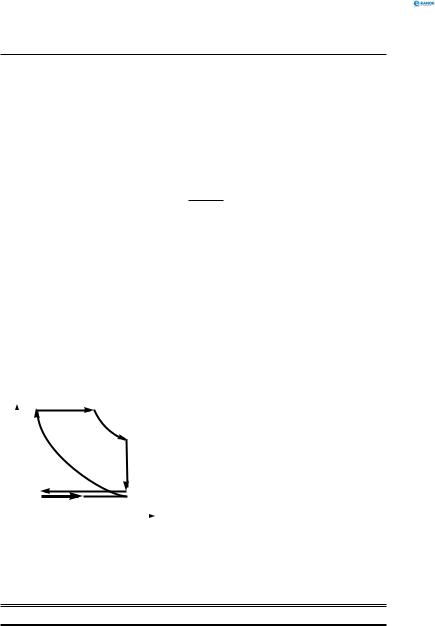
4.Безпоршневі двигуни внутрішнього згоряння (реактивні двигуни).
ККД сучасних дизелів досягає 40 %. Принцип роботи дизельного двигуна: 1-й такт — всмоктується повітря,
|
|
|
|
2-й такт — відбувається швидке |
p |
III |
|
|
стиснення повітря (отже, його |
|
III |
|
розігрів), 3-й такт — через фор- |
|
|
|
|
||
|
|
|
сунку вприскується пальне, від |
|
|
|
|
|
|
|
II |
|
|
високої температури воно само- |
|
|
IV |
запалюється. Продукти згорян- |
|
|
|
|
||
|
|
|
ня, розширюючись, виконують |
|
|
IV |
|
|
|
|
|
|
роботу з переміщення поршня, |
|
|
I |
|
|
|
|
|
|
4-й такт — вихід (вихлоп) про- |
|
0 |
|
|
|
|
|
|
|
V дуктів згоряння. Потім процес |
|
|
Рис. 155 |
|
|
повторюється (рис. 155). |
5. Приклади розв’язання задач
Задача 1.
Об’єм 160 г водню, температура якого 27 °С, при ізобарному нагріванні збільшився вдвічі. Визначити роботу газу
196
5. Приклади розв’язання задач
при розширенні, кількість теплоти, що пішла на його нагрівання, зміну внутрішньої енергії.
Дано: |
|
||
t1 |
=27 °C |
|
|
m |
=160 г |
кг |
|
M(H2 ) =2 10−3 |
|||
моль |
|||
p = const |
|||
|
|||
V2 |
=2V1 |
|
|
i =5 |
|
||
A′ — ? ∆U — ? Q — ?
СІ: |
|
||
T1 |
=300 K |
|
|
m |
=0,16 кг |
кг |
|
M(H2 ) =2 10−3 |
|||
моль |
|||
p = const |
|||
|
|||
V2 |
=2V1 |
|
|
i =5 |
|
||
Розв’язання:
При ізобарному нагріванні робота газу дорівнює:
A′= p∆V . |
|
||||
За рівнянням Клапейрона—Менделєєва: |
|
||||
p∆V = |
m |
R∆T , |
|
||
|
|
|
|||
|
|
M |
|
||
отже, робота газу при ізобарному процесі: |
|
||||
A′ = |
m |
R∆T. |
(1) |
||
|
|||||
|
M |
|
|||
Зміна внутрішньої енергії двоатомного ідеального газу дорівнює:
∆U = |
i |
|
m |
R∆T = |
5 |
|
m |
R∆T . |
(2) |
2 |
|
M |
2 |
|
M |
||||
|
|
|
|
|
|
За другим законом термодинаміки визначимо кількість теплоти:
|
|
|
|
Q = ∆U + A′ . |
|
|
|
|
|
||
Тоді |
|
|
|
|
|
|
|
|
|
|
|
Q = |
5 |
|
m |
R∆T + |
m |
R∆T = |
7 |
|
m |
R∆T . |
(3) |
2 |
|
M |
M |
2 |
|
M |
|||||
|
|
|
|
|
|
|
|||||
Кінцеву температуру T2 визначимо за законом Гей-Люс сака:
V1 |
= |
T1 |
, T2 = |
V2T1 |
= |
2V1T1 |
=2T1 . |
|
V |
T |
V |
V |
|||||
|
|
|
|
|||||
2 |
|
2 |
|
1 |
|
1 |
|
197

Основи термодинаміки
Зміна температури ∆T дорівнює:
∆T =T2 −T1 =2T1 −T1 =T1 .
Підставимо значення ∆T у формули (1), (2), (3) і отри-
маємо:
A′ = Mm RT1 , ∆U = 52 Mm RT1 , Q = 72 Mm RT1 .
Обчислення:
A′= ∆U = Q = кг моль Дж К = Дж ,
кг К моль
{ A′} = |
0,16 8,31 300 |
=199440, |
|||||
2 10−3 |
|||||||
|
|
|
|
|
|
||
{ ∆U} = |
|
5 0,16 8,31 300 |
|
=498600 , |
|||
|
2 2 10−3 |
|
|
||||
|
|
|
|
|
|
||
{Q} = |
|
7 0,16 8,31 300 |
|
=698040 . |
|||
|
|
2 2 10−3 |
|
||||
|
|
|
|
|
|
||
Відповідь: A′ =199,4 кДж, ∆U =498,6 кДж, Q =698,04 кДж.
Задача 2.
Один моль ідеального газу здійснює замкнений процес, що складається з двох ізохор і двох ізобар. Визначити роботу, здійснювану газом за один цикл, якщо точки 2 і 4 лежать на одній ізотермі.
Дано:
T1
T3
T2 =T4 =T
ν =1 моль
A′ — ?
Розв’язання:
Робота при замкненому циклі дорівнює площі фігури (1—2—3—4) у координатах pV:
A′=( p2 − p1 ) (V4 −V1 ) = = p2V4 − p2V1 − p1V4 + p1V1.
Застосуємо рівняння Клапейрона—Менделєєва для одного моля у кожному стані газу:
p1V1 = RT1 , p2V2 = RT2 , p3V3 = RT3 , p4V4 = RT4 .
198
5. Приклади розв’язання задач
Із рис. 156 випливає:
p4 = p1, p3 = p2, V2 = V1, V3 = V4 .
Підставимо відповідні значення у рівняння Клапейро на—Менделєєва:
p1V1 = RT1 , |
(1) |
p |
|
2 |
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|||||
p2V1 = RT2 , |
(2) |
p2, p3 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|||
p2V4 = RT3 , |
(3) |
|
|
1 |
|
|
|
|
4 |
|
|
p1V4 = RT4 . |
(4) |
p1, p4 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
||
Підставимо рівняння (1) — |
0 |
|
|
|
|
|
|
|
|
|
|
2 |
V3 |
V |
|||||||||
(4) у формулу для роботи газу: |
|
V |
|
|
|||||||
A′= RT3 −RT2 −RT4 + RT1 = |
|
|
|
V1 |
V4 |
|
|
||||
= R(T3 −2T +T1 ) , |
|
|
|
|
|
|
Рис. 156 |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
оскільки T2 = T4 = T .
Перетворивши рівняння (1) — (4), виявимо зв’язок T з T1 і T3 :
p1V1 = RT1,
p2V2 = RT,
p2V4 = RT3,
p1V4 = RT,
Отже: T = T3
T1 T
T1 =
T =
T3 =
T =
T =
|
p1V1 |
|
, |
T |
|
|
p V R |
|
|
p |
|
|
||||
|
|
|
|
|
|
|
|
|
||||||||
|
R |
|
|
|
|
= |
|
= |
|
|
||||||
|
|
|
|
|
|
|
2 |
2 |
2 |
, |
||||||
|
|
|
|
T |
p V R |
p |
||||||||||
|
p V |
|
|
|
|
|
|
|
|
|
||||||
|
2 |
2 |
|
|
1 |
|
|
1 |
1 |
|
|
1 |
|
|
||
|
|
|
, |
|
|
|
|
|
|
|
|
|
|
|||
|
R |
|
|
|
|
|
|
|
|
|
|
|
||||
|
p2V4 |
|
|
, |
T |
|
|
p |
V R |
|
|
p |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
p V |
|
|
|
= |
|
= |
. |
||||||||
|
|
|
|
3 |
|
2 |
4 |
2 |
||||||||
|
R |
|
|
|
|
|
|
|
|
|
|
|
||||
|
1 |
4 |
|
|
T |
|
|
p1V4R |
|
|
p1 |
|
|
|||
|
|
, |
|
|
|
|
|
|
|
|
|
|
||||
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
TT . |
|
|
|
|
|
|
|
|
|
|
|||||
|
1 |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Відповідь: робота газу A′= R(T3 −2 TT1 3 +T1 ).
Задача 3.
У калориметрі масою m1 , питома теплоємність якого c1, міститься вода масою m2 , нагріта до температури t1 . У калориметр опускають суміш мідних і алюмінієвих ошурків масою m, які мають температуру t2 . У результаті температура води підвищується до θ . Визначити масу мідних і алюмінієвих ошурків.
199

Основи термодинаміки
Дано: |
|
|
Розв’язання: |
|
|
||
mк = m1 |
mсуміші = m = m3 + m4 |
|
Закон збереження енер- |
cк = c1 |
cAl = c3 |
|
гії для теплових процесів |
tп.к = t1 |
cCu = c4 |
|
має вигляд: |
mв = m2 |
tп Al = tп Cu = t2 |
|
Qодерж = Qвід , |
cв = c2 |
θ |
|
Qодерж = Q1 +Q2 = |
tп.в =t1 |
|
|
|
m3 — ? |
|
|
= cкmк (θ−t1 ) +cвmв (θ−t1 ), |
m4 — ? |
|
|
|
|
Qодерж = c1m1 (θ−t1 ) +c2m2 (θ−t1 ), |
||
|
|
||
|
|
|
Qвід = m3c3 (t2 −θ)+m4c4 (t2 −θ) . |
Прирівняємо Qодерж і Qвід |
і спростимо: |
||
|
(θ−t1 ) (c1m1 +c2m2 ) =(t2 −θ) (c3m3 +c4m4 ) . |
||
Оскільки m =m3 +m4 , то отримуємо два рівняння з двома невідомими. Знайдемо m4 і m3 :
m4 = |
(θ−t1 ) (c1m1 +c2m2 ) −c3m(t2 −θ) |
|
, |
|
||||
|
|
(t2 −θ) (c4 −c3 ) |
||||||
|
|
|
|
|
|
|
||
m3 =m −m4 = |
m(t2 |
−θ) c4 −(θ−t1 ) (c1m1 +c2m2 ) |
. |
|||||
|
|
|
||||||
|
|
|
|
(t2 −θ) (c4 −c3 ) |
|
|
|
|
Відповідь: m3 = |
|
m(t2 −θ) c4 −(θ−t1 ) (c1m1 +c2m2 ) |
|
, |
|
|||
|
|
|
(t2 −θ) (c4 −c3 ) |
|
|
|||
|
|
|
|
|
|
|
||
m4 = |
(θ−t1 ) (c1m1 +c2m2 ) −c3m(t2 −θ) |
. |
|
||
|
(t2 −θ) (c4 −c3 ) |
|
Задача 4.
На електроплитці з ККД 78 % нагрівалась мідна каструля з водою. Маса каструлі 800 г, маса води 2,1 кг. Яка потужність електроплитки, якщо процес нагрівання до кипіння тривав 40 хв і при цьому 15 % води випарувалось? Початкова температура води 15 °С.
200

|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5. Приклади розв’язання задач |
|||||||||||||
Дано: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Розв’язання: |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
η=78% |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Qкор |
|
|
|
|
||||||||
m1 =800 г =0,8 кг |
|
|
|
|
|
|
|
|
|
|
|
|
η= |
100%, |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
c1 = cCu =380 |
|
|
|
|
Дж |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Qзатр |
|
|
|||||||
|
|
|
(кг К) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
m2 =2,1 кг |
|
Дж |
|
|
|
|
|
|
|
|
|
|
|
Qкор = Q1 +Q2 +Q3 = |
||||||||||||||||
c2 = cв =4200 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
кг К |
|
|
|
|
|
|
|
= c1m1 (θ−tп ) +c2m2 (θ−tп ) + Lmп , |
||||||||||||||||||||
τ =40 хв =2400 с |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
tп1 = tп2 = tп =15°C |
|
|
|
|
|
|
|
|
|
|
|
|
|
Qзатр = Nзатр τ. |
||||||||||||||||
m3 =mп =0,15mв =0,15m2 |
|
|
|
|
ККД електроплитки дорів- |
|||||||||||||||||||||||||
Lв =2,3 10−6 |
|
Дж |
|
|
|
|
|
|
|
|
нює: |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
кг |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Nзатр — ? |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
η= |
c1m1 (θ−tп ) +c2m2 (θ−tп ) + Lmп |
100%. |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||||||
|
Звідси |
|
|
|
|
|
|
|
|
Nзатр τ |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
c1m1 (θ−tп ) +c2m2 (θ−tп ) + Lmп |
|
|
||||||||||||||||||||||||||
|
Nзатр = |
|
100%. |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
η t |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Обчислення: |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
= |
Дж К |
кг |
= |
|
Дж |
= Вт |
|
|
||||||||||||||
|
|
|
|
|
|
Nзатр |
|
|
|
|
|
|
|
|
|
|
|
, |
|
|||||||||||
|
|
|
|
|
|
кг |
К |
с |
|
с |
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
{ Nзатр } = |
380 0,8 (100−15) 100 |
+ |
|
|||||||||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
78 2400 |
|
|
|
|
|
|
|
||||||
+ |
4200 2,1 (100−15) 100 |
|
+ |
|
2,3 106 0,15 2,1 100 |
≈800. |
||||||||||||||||||||||||
78 2400 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
78 2400 |
|
|
||||||||||||||
Відповідь: Nзатр ≈800 Вт.
Задача 5.
Свинцева куля, що летить зі швидкістю v0, пробивши дошку, зменшує свою швидкість до v. Початкова температура t. Визначити, яка частина кулі розплавиться, якщо вважати, що на нагрівання пішла k-та частина втраченої кінетичної енергії (k <1) .
201

Основи термодинаміки
Дано:
tп = t
tк = tпл
v0
v
c
Q = k∆Eк
mрід — ?
m
Розв’язання:
Зміна кінетичної енергії кулі дорів-
нює:∆Eк= |
mv2 |
− |
mv02 |
= |
m |
(v2 |
−v02 ). |
|
2 |
2 |
2 |
||||||
|
|
|
|
|
Кількість теплоти, отриманої кулею на нагрівання й часткове плавлення:
Q = cm(tпл −t) +λmрід .
Ця величина є k-ю частиною втраченої енергії кулі:
|
|
|
|
|
|
|
|
|
Q = k∆Eк , |
|
|
||
отже, |
cm(tпл |
−t) +λmрід =k |
m |
(v2 −v02 ) . |
|||||||||
|
|||||||||||||
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
Розділивши обидві частини рівняння на λ, отримаємо |
|||||||||||||
шукану величину: |
|
|
|
|
|
|
|
|
|||||
|
|
|
m |
|
|
|
k(v2 −v02 )−2c(tпл |
−t) |
|||||
|
|
|
|
рід |
= |
|
|
|
|
|
. |
||
|
|
|
|
m |
|
|
2λ |
|
|||||
|
|
|
|
|
|
|
|
|
|||||
|
m |
|
|
|
k(v2 |
−v02 )−2c(tпл −t) |
|
|
|||||
Відповідь: |
рід |
|
= |
|
|
|
|
|
|
|
. |
|
|
m |
|
|
|
|
|
2λ |
|
||||||
|
|
|
|
|
|
|
|
|
|||||
Задача 6.
Що станеться, якщо в посудину з водою при 0 °С покласти кусок льоду при 0 °С ( p = pатм ) ?
Розв’язання:
Лід тане при 0 °С при pатм =105 Па лише тоді, коли він отримує кількість теплоти, необхідної для перетворення
його на рідину. Вода буде кристалізуватися при 0 °С тільки в тому випадку, коли вона віддаватиме таку ж кількість теплоти (якщо маси води і льоду однакові). Лід і вода перебувають у термодинамічній рівновазі, яка виключає теплообмін. Отже, ніяких змін у посудині не станеться.
Задача 7.
У посудині з водою швидко відкачують повітря при 0 °С. Що станеться в посудині?
202

5. Приклади розв’язання задач
Розв’язання:
За рахунок інтенсивного випаровування частини води з посудини станеться поступове заморожування частини води, що залишилася:
Qвід = Qодерж , Lmпари = λmльоду .
Температура у посудині під час цього процесу не змінюється.
Задача 8.
Тверда ртуть масою 15 г при –40 °С поміщена у воду масою 6 г при 7 °С Визначити температуру суміші й масу кінцевих продуктів.
Дано:
m1 |
=6 г =6 10−3 кг |
|||||
c1 |
=4200 |
Дж |
||||
кг К |
|
|||||
tп |
|
=7 °C |
||||
m12 |
=15 г =15 10−3 кг |
|||||
tп2 |
|
= −40 °C |
||||
c2 |
=138 |
|
Дж |
|||
кг К |
|
|||||
λрт = λ2 =11,7 103 Джкг
λльоду =3,34 105 Джкг
cльоду =2100 ( Дж )
кг К
tпл2 = −39°C
tкр1 = 0 °C
θ — ?, mв′ — ?, mл — ?
Розв’язання:
Вихідна суміш складається з двох компонентів — ртуті й води. Оскільки температура ртуті нижча точки кристалізації води, то можлива поява третього компонента — льоду. Це залежить від стану системи в момент, коли температура суміші знизиться до 0 °С.
Обчислимо кількість теплоти Q1 , відданої водою при охолодженні до 0 °С:
Qвід = Q1 = c1m1 (tп 1 −tкр 1 ) = 4200 6 10−3 (7 −0) ≈176 Дж.
Графік залежності температури від часу для води зображений на рис. 157, а.
Обчислимо кількість теплоти Q2 , яка пішла на нагрівання ртуті до температури плавлення (від –40 до –39 °С),
203
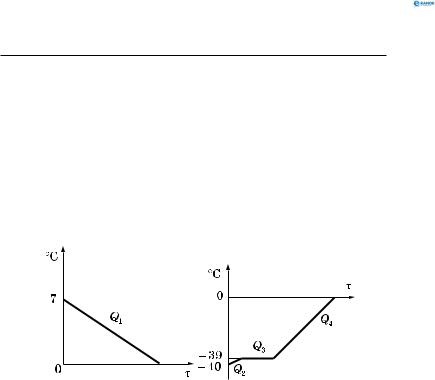
Основи термодинаміки
при плавленні ртуті Q3 і нагріванні рідкої ртуті (від –39 до 0 °С) Q4 . Приймаємо питому теплоємність ртуті як незмінну у твердій і рідкій фазах:
Qодерж = Q2 + Q3 + Q4 = c2m2 (tпл2 −tп2 )+ λ2m2 + c2m2 (tкр1 −tпл2 ) ,
Qодерж =138 15 10−3 (−39+40) +
+11,7 103 15 10−3 +138 15 10−3 (0+39) ≈258 Дж.
Графік залежності температури від часу для ртуті показаний на рис. 157, б.
t, |
|
|
t, |
а |
б |
|
Рис. 157 |
Порівняємо Qвід і Qодерж . Якщо Qвід = Qодерж , то температура суміші дорівнювала б 0 °С. Якщо Qвід > Qодерж , то ртуть
мала б температуру вище 0°С. В обох випадках було б два компоненти суміші — рідка ртуть і вода.
У нашому випадку Qвід < Qодерж , отже, вода перетворюватиметься на лід (повністю або частково), і температура сумі-
ші може стати нижчою 0°С (при повному замерзанні води). Масу утвореного льоду можна визначити за формулою:
|
mл = |
Qодерж −Qвід |
, |
|
||
|
|
|
||||
|
|
λльоду |
|
|
|
|
m = |
(258 Дж−176 Дж) кг |
≈24,55 10−5 |
кг , |
|||
3,34 105 Дж |
||||||
л |
|
|
|
|||
mл ≈ 0,25 г < mв .
204

5. Приклади розв’язання задач
Маса води дорівнюватиме:
mв′ =6 г −0,25г =5,75 г .
Відповідь: температура суміші, у яку входять лід, вода і ртуть, дорівнюватиме 0 °С. Суміш міститиме в собі 0,25 г льоду, 5,75 г води і 15 г ртуті.
Задача 9.
Двигун внутрішнього згоряння має ККД 28 % при температурі згоряння палива 927 °С і температурі відхідних газів 447 °С. На скільки ККД двигуна менший від ККД ідеальної теплової машини?
Дано: |
|
СІ: |
|
|
|
|
|||
t1 =927 °C |
|
T1 =1200 |
К |
|
|
T2 =720 |
К |
||
t2 =447 °C |
|
|||
|
η=28% |
|
||
η=28% |
|
|
||
|
|
|
|
|
|
|
|
|
|
∆η — ? |
|
Розв’язання: |
||
|
||||
|
|
|||
ηі = |
T1 −T2 |
100%, ∆η= ηі −η. |
||
|
||||
|
|
T |
|
|
|
1 |
|
|
|
Обчислення:
ηі = 1200−720 100%=40%, 1200
∆η=(40−28)%=12%.
Відповідь: ККД двигуна менший від ККД ідеальної теплової машини на 12 %.
Задача 10.
Яку середню потужність розвиває двигун мотоцикла, якщо при швидкості 108 км/год витрачається бензину 3,7 л на 100 км шляху, а ККД двигуна 25 %? Густина бензину
700 кг/м3.
205

Основи термодинаміки
Дано: |
км |
|
СІ: |
|
м |
|
|
|
|
|
|
|
||||||||||
v = 108 |
|
v = 30 |
|
|
|
|
|
|
|
|||||||||||||
|
год |
с |
|
|
|
|
|
|
|
|||||||||||||
V =3,7 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
л |
V = 3,7 10−3 м3 |
|
|
|||||||||||||||||||
S =100 |
км |
S = 1 105 |
|
м |
|
|
||||||||||||||||
η=25% |
η=0,25 |
|
|
|
|
|
|
|
||||||||||||||
ρ = 700 |
|
кг |
|
ρ = 700 |
кг |
|
|
|
|
|||||||||||||
|
м3 |
м3 |
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||
q = 46 106 |
Дж |
|
|
|
q = 46 106 |
Дж |
|
|
|
|||||||||||||
|
|
|
|
|||||||||||||||||||
|
|
|
|
кг |
|
|
|
|
|
|
|
|
|
|
кг |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N — ? |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Розв’язання: |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
Економічний ККД: |
|
|
||||||||||||||
|
|
|
|
|
|
η = |
|
A |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
Q |
|
|
|
|
N S |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
A = N t η = |
|
|
|
|
|
, |
|
|||||||||
|
|
|
|
|
|
|
V ρ q v |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
t = |
|
|
S |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
η V ρ q v |
|
|||||||||
|
|
|
|
|
|
|
v |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
N = |
|
|
. |
||||||||||
|
|
|
|
|
|
Q = mq |
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
S |
|
|
||||||||||
|
|
|
|
|
|
m = Vρ |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
Обчислення: |
|
|
0,25 |
3,7 |
10−3 700 46 106 |
3 |
N = |
|
|
|
Вт ≈ 8,9 10 Вт. |
|
|
105 |
||
|
|
|
|
Відповідь: N ≈ 8,9 кВт.
206
