
- •Передмова
- •МЕХАНІКА
- •1. КІНЕМАТИКА МАТЕРІАЛЬНОЇ ТОЧКИ
- •1.1. Основні поняття
- •1.4. Прямолінійний рух
- •1.5. Криволінійний рух. Рівномірний рух по колу
- •2. ДИНАМІКА МАТЕРІАЛЬНОЇ ТОЧКИ
- •2.1. Основні закони динаміки. Сила. Рівнодійна сила
- •2.2. Сили в механіці
- •2.4. Алгоритм розв’язання кількісних задач із фізики
- •2.5. Методичні рекомендації щодо розв’язання задач з динаміки
- •2.6. Приклади розв’язання задач
- •3. ЗАКОНИ ЗБЕРЕЖЕННЯ В МЕХАНІЦІ
- •3.1. Імпульс тіла. Імпульс сили
- •3.2. Закон збереження імпульсу
- •3.3. Реактивний рух
- •3.4. Енергія. Закон збереження енергії. Види енергії
- •3.5. Види механічної енергії та їх зв’язок з роботою
- •3.6. Механічна робота і потужність
- •3.7. Механічний удар
- •3.8. Прості механізми
- •4. МЕХАНІКА ТВЕРДОГО ТІЛА
- •4.1. Основні поняття
- •4.2. Умови і види рівноваги твердого тіла
- •4.3. Момент імпульсу. Закон збереження моменту імпульсу
- •4.4. Зіставлення рівнянь механіки поступального й обертального рухів (табл. 2)
- •4.5. Приклади розв’язання задач
- •5. ГІДРОСТАТИКА І АЕРОСТАТИКА
- •5.1. Тиск
- •5.2. Закон Паскаля
- •5.3. Гідростатичний тиск
- •5.4. Сполучені посудини
- •5.5. Гідростатичний парадокс
- •5.6. Гідравлічна машина
- •5.7. Закон Архімеда
- •5.8. Умови плавання тіл (табл. 3)
- •5.9. Атмосферний тиск, його вимірювання
- •5.10. Приклади розв’язання задач
- •6. ГІДРОДИНАМІКА І АЕРОДИНАМІКА
- •6.1. Струминна течія рідин і газів
- •6.2. Рівняння Бернуллі
- •6.3. Підйомна сила крила літака
- •6.4. Коефіцієнт лобового опору для тіл різної форми (табл. 4)
- •1. ОСНОВИ МОЛЕКУЛЯРНО-КІНЕТИЧНОЇ ТЕОРІЇ БУДОВИ РЕЧОВИНИ
- •1.1. Основні положення молекулярно-кінетичної теорії та їх дослідне обґрунтування
- •2. ВЛАСТИВОСТІ ГАЗІВ (ГАЗОВІ ЗАКОНИ)
- •2.2. Газові закони
- •2.3. Закон Дальтона
- •2.5. Середня довжина вільного пробігу молекул
- •2.6. Приклади розв’язання задач
- •3. ВЛАСТИВОСТІ ПАРИ
- •3.1. Пара. Випаровування і конденсація
- •3.2. Насичена і ненасичена пара
- •3.3. Вологість повітря (відносна й абсолютна). Точка роси
- •3.4. Кипіння. Перегріта рідина
- •3.5. Приклади розв’язання задач
- •4.2. Поверхнева енергія. Поверхневий натяг
- •4.3. Явище змочування. Капілярні явища
- •4.4. Формула Лапласа
- •4.5. Приклади розв’язання задач
- •5. ВЛАСТИВОСТІ ТВЕРДИХ ТІЛ
- •5.1. Кристалічні та аморфні тіла. Їхні властивості
- •5.2. Типи твердих кристалів
- •5.3. Рідкі кристали
- •5.4. Дефекти кристалічних ґраток
- •5.5. Механічні властивості твердих тіл
- •5.6. Приклади розв’язання задач
- •6. ТЕПЛОВЕ РОЗШИРЕННЯ ТВЕРДИХ І РІДКИХ ТІЛ
- •6.1. Графік залежності потенціальної енергії взаємодії найпростіших молекул від відстані між ними (потенціальна яма)
- •6.2. Лінійне й об’ємне розширення твердих і рідких тіл
- •6.3. Особливості теплового розширення води
- •6.4. Приклади розв’язання задач
- •1.1. Внутрішня енергія ідеального газу
- •1.2. Робота ідеального газу. Її геометричне тлумачення
- •1.5. Питома теплоємність речовини
- •1.6. Питома теплота згоряння палива. ККД нагрівача
- •1.7. Змінювання агрегатного стану речовини
- •2. ПЕРШИЙ ЗАКОН ТЕРМОДИНАМІКИ. АДІАБАТИЧНИЙ ПРОЦЕС
- •3. ДРУГИЙ ЗАКОН ТЕРМОДИНАМІКИ. ЕНТРОПІЯ
- •4. ТЕПЛОВІ ДВИГУНИ
- •ЕЛЕКТРОДИНАМІКА
- •1. ЕЛЕКТРОСТАТИКА
- •1.1. Електричний заряд. Закон збереження заряду
- •1.7. Електризація тіл
- •2. ПОСТІЙНИЙ СТРУМ
- •2.1. Електричний струм. Сила струму. Густина струму
- •2.3. Послідовне і паралельне з’єднання провідників
- •2.4. ЕРС. Закон Ома для повного кола. З’єднання елементів
- •2.6. Приклади розв’язання задач
- •3. СТРУМИ ПРОВІДНОСТІ
- •3.2. Струм в електролітах
- •3.4. Струм у напівпровідниках
- •3.5. Струм у вакуумі (струм переносу)
- •3.6. Приклади розв’язання задач
- •4. МАГНЕТИЗМ
- •4.1. Магнітне поле. Магнітна індукція поля
- •4.2. Магнітне поле струму
- •4.3. Дія магнітного поля на рухомий заряд (сила Лоренца) і провідник зі струмом (сила Ампера). Правило лівої руки
- •4.4. Дія магнітного поля на рамку зі струмом. Магнітний потік
- •4.5. Закон взаємодії паралельних струмів
- •4.6. Магнітне поле у речовині
- •4.7. Приклади розв’язання задач
- •5. ЕЛЕКТРОМАГНІТНА ІНДУКЦІЯ
- •5.1. Явище електромагнітної індукції. Вихрове електричне поле
- •5.3. Індукційні струми в суцільних провідниках
- •5.4. Самоіндукція. Індуктивність. Енергія магнітного поля
- •5.5. Електромагнітне поле. Теорія Максвелла в якісному вигляді
- •5.6. Приклади розв’язання задач
- •ФІЗИКА КОЛИВАНЬ
- •1. КОЛИВАЛЬНИЙ РУХ
- •1.1. Основні поняття
- •1.2. Гармонічні коливання
- •2. ЗМІННИЙ СТРУМ
- •2.1. Одержання змінного синусоїдного струму. Закономірності змінного струму
- •2.2. Діюче значення змінного струму
- •2.3. Опір змінному струму. Закон Ома для змінного струму
- •2.4. Електричний резонанс. Резонанс напруг. Резонанс струмів
- •2.5. Випрямлення змінного струму
- •2.6. Трансформація змінного струму
- •2.7. Змінний струм високої частоти
- •2.8. Приклади розв’язання задач
- •3. ЕЛЕКТРОМАГНІТНІ КОЛИВАННЯ
- •3.2. Закономірності вільних електромагнітних коливань. Згасаючі коливання
- •3.3. Отримання незгасаючих електромагнітних коливань
- •3.4. Приклади розв’язання задач
- •4. МЕХАНІЧНІ ХВИЛІ. ЗВУК
- •4.1. Поздовжні і поперечні хвилі. Промінь. Довжина хвилі. Фронт хвилі
- •4.2. Принцип Гюйгенса
- •4.3. Інтерференція хвиль
- •4.4. Дифракція хвиль
- •4.5. Звук. Звукові хвилі. Інтенсивність, висота і тембр звуку
- •4.6. Луна. Звуковий резонанс
- •4.7. Приклади розв’язання задач
- •5. ЕЛЕКТРОМАГНІТНІ ХВИЛІ
- •5.1. Випромінювання електромагнітних хвиль відкритим коливальним контуром
- •5.3. Принцип радіозв’язку. Модуляція і детектування (демодуляція)
- •5.4. Класифікація радіохвиль і особливості їх поширення
- •5.5. Приклади розв’язання задач
- •ОПТИКА
- •1. ХВИЛЬОВА ОПТИКА
- •1.1. Монохроматичне світло. Заломлення світла
- •1.2. Дисперсія світла
- •1.4. Інтерференція білого світла за Френелем
- •1.5. Інтерференція білого світла за Ньютоном. Кільця Ньютона
- •1.6. Дифракція білого світла
- •1.7. Поляризація світла
- •2. ГЕОМЕТРИЧНА ОПТИКА
- •2.2. Закони відбивання світла
- •2.3. Закони заломлення світла. Повне відбивання світла
- •2.4. Хід променів через плоскопаралельну пластинку, призму
- •2.5. Сферичні лінзи
- •2.6. Око як оптична система
- •2.8. Сферичні дзеркала
- •2.9. Приклади розв’язання задач
- •3. ВИПРОМІНЮВАННЯ ТА СПЕКТРИ
- •3.1. Люмінесценція
- •3.2. Інфрачервоні та ультрафіолетові промені
- •3.3. Рентгенівські промені
- •3.4. Спектри випромінювання. Спектри поглинання
- •3.5. Спектральний аналіз
- •1.1. Поняття про простір і час
- •1.2. Постулати СТВ. Перетворення Лоренца
- •1.4. Приклади розв’язання задач
- •2. КВАНТОВА ОПТИКА
- •2.1. Теорія Планка. Імпульс фотона
- •2.2. Фотоефект
- •2.3. Фотоелементи та їх застосування
- •2.4. Світловий тиск
- •2.5. Корпускулярно-хвильовий дуалізм
- •2.6. Хімічний вплив світла. Чорно-біла фотографія. Фотосинтез. Ланцюгові реакції
- •2.7. Приклади розв’язання задач
- •3. ФІЗИКА АТОМА
- •3.1. Планетарна модель атома Резерфорда
- •3.2. Постулати Бора. Борівські орбіти
- •3.3. Атом Гідрогену за Н. Бором
- •3.4. Приклади розв’язання задач
- •4. ФІЗИКА АТОМНОГО ЯДРА
- •4.1. Відкриття протона і нейтрона
- •4.2. Теорія будови ядра
- •4.3. Енергія зв’язку ядра. Дефект маси
- •4.4. Природна радіоактивність
- •4.6. Часткове звільнення внутрішньоядерної енергії при екзотермічних ядерних реакціях
- •4.7. Закон радіоактивного розпаду
- •4.8. Приклади розв’язання задач
- •5. ЕЛЕМЕНТАРНІ ЧАСТИНКИ
- •5.1. Фізика елементарних частинок
- •5.2. Приклади розв’язання задач
- •Предметний покажчик
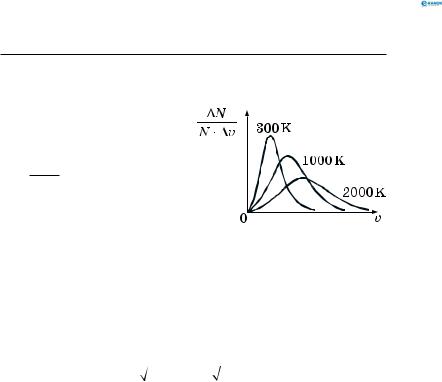
2.Властивості газів (газові закони)
2.4.Розподіл молекул ідеального газу
за швидкостями (розподіл Максвелла)
Розподіл молекул ідеального газу за швидкостями зображено на рис. 126.
∆N — частка мо-
N
лекул, модуль швидкості яких міститься в інтервалі
від v до v + ∆v .
Рис. 126 |
2.5. Середня довжина вільного пробігу молекул
Середня довжина вільного пробігу молекул — середня відстань між двома послідовними зіткненнями молекул:
|
= |
1 |
= |
kT |
|
l |
|
|
, |
||
2 πd2n |
2 πpd2 |
де p = nkT;
d — ефективний діаметр молекули (мінімальна відстань, на яку зближуються центри двох молекул при їх зітк ненні);
n — концентрація молекул.
2.6. Приклади розв’язання задач
Задача 1.
Для деякої маси газу залежність тиску від температури має такий вигляд, як на рис. 127, а. Як змінюється об’єм газу?
Розв’язання:
Виконуємо додаткові побудови (рис. 127, б). Проводимо дві ізохори через точку 1 (V1 = const) і точ-
ку 2 (V2 = const) і одну ізотерму, яка перетинає дві ізохори. Точки перетину ізохор з ізотермою дають можливість визначити графічно p1 і p2.
149

Молекулярна фізика |
|
|
p |
2 |
|
|
|
|
|
1 |
|
0 |
|
T |
|
а |
б |
|
|
Рис. 127 |
Застосовуємо закон Бойля—Маріотта:
p1V1 = p2V2 , якщо T = const , m = const .
Із графіка видно, що збільшується.
p |
2 |
|
3 |
1 |
0 |
V |
p |
2 |
|
|
3 |
1 |
|
|
0 |
T |
Задача 3. |
|
p1 > p2 , отже, V1 < V2, тобто об’єм
Задача 2.
Данографікциклу 1→2 →3 для ідеального газу даної маси в координатах p, V. Побудувати графік у координатах p, T і V, T.
Розв’язання: |
|
V |
1 |
3 |
2 |
|
|
0 |
T |
За скільки помахів поршневого насоса ємністю V0 мож на відкачати газ у скляному балоні ємністю V до тиску p,
150

2. Властивості газів (газові закони)
якщо спочатку тиск у балоні дорівнював атмосферному p0 ? Процес ізотермічний.
Дано: |
|
Розв’язання: |
|
|
|
|
|||
V0 |
|
У балоні газ у стані |
p0, |
V. При під- |
V |
|
|||
|
ключенні насоса — об’єм |
(V0 |
+ V) , тиск p. |
|
p0 |
|
|||
|
За законом Бойля—Маріотта після пер- |
|||
p |
|
|||
|
шого помаху |
|
|
|
T = const |
|
|
|
|
|
p0V = p1 (V0 + V) . |
|||
|
|
|||
n — ? |
|
|||
|
|
|
|
|
Звідси p1 = Vp0+VV .
0
Після другого помаху p1V = p2 (V0 + V) .
Звідси p = |
p V |
|
= |
|
|
|
|
p V2 |
= p |
|
|
V |
2 |
|
||||||||||||||
1 |
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
. |
|||||||||||||
|
|
|
|
|
|
|
(V + V )2 |
V + V0 |
||||||||||||||||||||
2 |
|
|
V + V0 |
|
0 |
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
Після n помахів p = p |
|
|
V |
|
|
n |
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
. |
|
|
|
|
|||||||||||||||||
|
|
+ V0 |
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
n |
0 |
|
V |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p |
|
|
|
|
|
V |
|
|
|
Прологарифмуємо вираз: lg |
n |
|
= nlg |
|
|
. |
||||||||||||||||||||||
p0 |
|
V + V0 |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
pn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
lg |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Звідси n = |
|
|
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
0 |
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
lg |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
V + V0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
lg |
|
pn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Відповідь: n = |
|
|
|
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
lg |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
+ V0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Задача 4.
Компресор засмоктує з атмосфери щосекунди 4 л повітря, які подаються в балон ємністю 120 л. Через який час тиск у балоні буде перевищувати атмосферний у 9 разів? Початковий тиск у балоні дорівнює атмосферному.
151

Молекулярна фізика
Дано: |
|
СІ: |
|
|
|
|
|||||
|
V = 120 |
л |
|
V =0,12 м3 |
|
|
|||||
|
∆V0 |
=4 |
л/с |
|
∆V |
|
=4 10 |
−3 |
м /с |
||
|
∆t |
|
∆t |
|
|||||||
|
|
|
|
|
|
|
0 |
|
|
3 |
|
|
p |
|
=9 |
|
|
p |
=9 |
|
|
||
|
p0 |
|
|
|
|
|
|||||
|
|
|
p |
|
|
||||||
|
p0 = pатм |
|
0 |
|
|
|
|
||||
|
|
|
p0 = pатм |
|
|
||||||
|
∆t =1 с |
|
∆t =1 с |
|
|
||||||
t — ? |
|
|
|
|
|
|
|
||||
Розв’язання:
Процес ізотермічний, застосовуємо закон Бойля—Ма
ріотта. Об’єм повітря при тиску p0 |
|
|
+t |
∆V0 |
|
|||||||||||||
дорівнює V |
|
. |
||||||||||||||||
∆t |
||||||||||||||||||
Це саме повітря в балоні V має тиск p: |
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
∆V0 |
|
|
|
|
|
|
|
||
|
|
|
p0 |
V +t |
|
|
|
|
|
= pV . |
|
|
|
|
||||
|
|
|
|
∆t |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
−1 ∆t |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|||||||||||
Виразимо t: t = |
|
|
p0 |
|
|
|
|
. |
|
|
|
|
||||||
|
|
∆V0 |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
Обчислення: |
|
|
|
|
|||||||||
|
м3 Па с |
= с , {t} = |
|
0,12 (9−1) 1 |
=240 . |
|
|
|||||||||||
t = |
|
|
|
|
|
|
||||||||||||
м3 Па |
|
|
4 10−3 |
|
|
|||||||||||||
Відповідь: t = 4 хв.
|
l1 |
hðò1 |
l2 |
hðò1 |
|
|
hðò2 |
Рис. 128
Задача 5.
У трубці, закритій з одного кінця, стовпчик повіт ря замкнутий стовпчиком ртуті завдовжки h = 20 см. Коли трубка розміщена відкритим кінцем униз, довжина
стовпчика |
повітря |
дорівнює |
||
l1 = 10 см. |
Якщо |
ж |
трубку |
|
нахилити |
під |
кутом |
α =30° |
|
до горизонту |
отвором униз, |
|||
довжина |
повітряного |
стовп- |
||
152

2. Властивості газів (газові закони)
чика дорівнюватиме l2 =8,46 см. Визначити атмосферний тиск (рис. 128).
Дано: |
|
СІ: |
|
|
ρрт =13600 кг/м3 |
|
ρрт =13,6 103 |
кг/м3 |
|
hрт1 =20 см |
|
hрт1 =0,2 м |
|
|
l1 =10 см |
|
l1 =0,1 м |
|
|
l2 =8,46 см |
|
l2 =8,46 10−2 |
м |
|
α =30° |
|
α =30° |
|
|
pатм — ? |
|
|
|
|
|
|
Розв’язання: |
|
|
Процес ізотермічний, m = const. |
|
|||
Застосовуємо закон Бойля—Маріотта: |
|
|||
|
|
p1V1 = p2V2 , |
|
|
V1 = Sl1 , V2 = Sl2 , p1Sl1 = p2Sl2 p1l1 = p2l2 . |
(1) |
|||
Визначимо p1 |
і p2 : |
|
|
|
p1 +ρртghрт1 = pатм p1 = pатм −ρртghрт1 , |
|
|||
p2 +ρртghрт2 = pатм p2 = pатм −ρртghрт2 .
Підставимо значення p1 і p2 в (1):
|
|
( pатм −ρртghрт1 )l1 =( pатм −ρртghрт2 )l2 , |
|||||||
|
|
|
|
hрт2 = hрт1 sinα , |
|
|
|
|
|
|
( pатм −ρртghрт1 )l1 =( pатм −ρртghрт1 sinα)l2 . |
||||||||
Звідки pатм = |
ρртghрт1 (l1 −l2 sinα) |
. |
|
|
|
|
|||
|
|
|
|
|
|
||||
|
|
|
|
l1 −l2 |
|
|
|
|
|
|
|
|
|
Обчислення: |
|
|
|
|
|
p |
= |
кг м м м |
= Па , |
|
|
|
|
||
|
|
|
|
|
|||||
атм |
м3 с2 м |
|
|
|
|
||||
|
|
|
|
|
|
1 |
|||
|
|
13600 9,8 0,2 0,1−0,0846 |
|
|
|
||||
|
|
|
|||||||
{ pатм } = |
|
|
|
|
2 |
=105 . |
|||
|
(0,1−0,0846) |
|
|
||||||
|
|
|
|
|
|
|
|||
Відповідь: pатм =100 кПа.
153
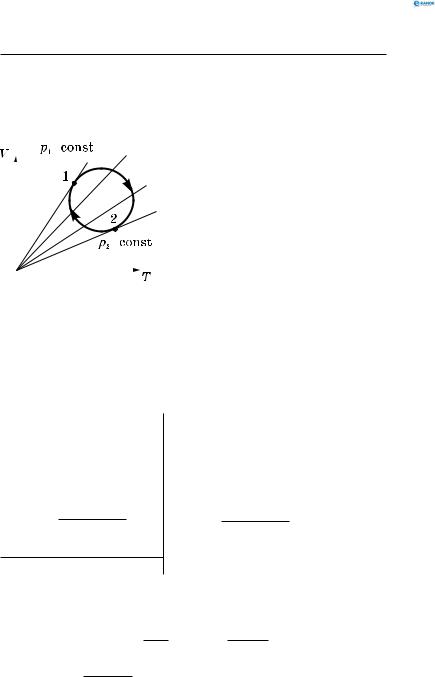
Молекулярна фізика
Задача 6.
Із даною кількістю ідеального газу проводять коловий
процес (цикл), зображений на діаграмі у вигляді кола. На |
|||
|
|
якій ділянці циклу тиск газу |
|
= |
збільшується, а на якій — змен- |
||
шується (рис. 129)? |
|||
|
|
||
|
|
Розв’язання: |
|
|
|
Проведемо ряд ізобар через |
|
|
|
коловий процес. Оскільки на- |
|
|
|
хил ізобар тим більший, чим |
|
|
= |
менший тиск газу (це витікає |
|
|
|
із p = const ізобарного проце- |
|
O |
|
су), то p1 < p2. Таким чином, на |
|
|
|||
|
|
ділянці циклу 1→2 тиск га- |
|
Рис. 129 |
зу збільшується, а на ділянці |
|
|
|
2 →1 — зменшується. |
Задача 7. |
|
У повітряній кулі об’ємом 1400 м3 міститься водень при температурі 7 °С і тиску 720 мм рт. ст. Визначити силу тяжіння цього водню.
Дано:
V = 1400 м3
T = (7 + 273)К = 280 К p =720 мм рт. ст.
M(H2 ) = 2 10−3 кг/моль
R = 8,31 ( Дж )
К моль g =9,8 м/с2
mg — ?
СІ:
V = 1,4 103 м3
T = (7 + 273)К = 280 К p ≈ 9,6 104 Па
M(H2 ) = 2 10−3 кг/моль
R = 8,31 ( Дж )
К моль g =9,8 м/с2
Розв’язання:
Рівняння Клапейрона—Менделєєва: pV = Mm RT , m = pVMRT ,
тоді mg = pVMgRT .
154

2. Властивості газів (газові закони)
|
|
|
Обчислення: |
|
|
||
|
|
= |
Па м3 кг К моль м |
|
= Н , |
||
mg |
|
|
|
||||
Дж моль |
с2 К |
||||||
|
|
|
|
|
|||
{mg} = |
|
9,6 104 1400 2 |
10−3 9,8 |
|
=1132 . |
||
|
|
8,31 280 |
|
||||
|
|
|
|
|
|||
Відповідь: mg = 1,13 кН.
Задача 8.
У циліндричній посудині з площею основи 250 см2 міститься 10 г азоту, стисненого поршнем, на якому лежить гиря масою 12,5 кг. Визначити роботу газу при його нагріванні від 25 до 625 °С. Атмосферний тиск 760 мм рт. ст. Чи залежить робота від маси гирі?
Дано: |
|
|
|
|
|
|
|
|
СІ: |
|
|
|
||||||||||
S =250 |
см2 |
|
|
|
|
|
|
S =250 0,0001 м2 =2,5 10−2 м2 |
||||||||||||||
m =10 |
г |
|
|
|
|
|
|
m =10 0,001кг =10−2 кг |
||||||||||||||
m1 =12,5 кг |
|
|
|
|
|
|
m1 |
|
=12,5 кг |
|
|
|
||||||||||
t1 |
=25°C |
|
|
|
|
|
|
T1 |
=(273+25) К =298 К |
|
|
|
||||||||||
t2 |
=625°C |
|
|
|
|
|
|
T2 |
=(273+625) К =898 К |
|||||||||||||
p0 |
=760 мм рт. ст. |
|
|
|
|
|
p0 |
|
=760 133,3 Па =105 |
Па |
||||||||||||
M(N2 ) =28 10−3 |
кг/моль |
|
|
M(N2 ) =28 10−3 кг/моль |
||||||||||||||||||
A — ? |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
Розв’язання: |
|
|
|
||||||||||
|
|
A = p∆V, оскільки процес ізобарний. |
|
|
|
|||||||||||||||||
|
Знайдемо p: p = pатм + |
|
m1g |
. |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
|
||
|
|
За рівнянням Клапейрона—Менделєєва визначимо V1, |
||||||||||||||||||||
V2, |
V2 −V1 : |
|
|
mRT1 |
|
|
|
|
|
|
|
|
mRT2 |
|
||||||||
pV1 |
= |
|
m |
RT1 V1 = |
|
, |
|
pV2 = |
m |
RT2 V1 = |
|
. |
||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
M |
|
|
|
Mp |
|
|
|
M |
|
Mp |
|||||||||
|
|
Тоді |
mR |
|
|
|
|
|
|
|
|
mR |
|
|
|
|
|
|||||
|
|
|
|
|
A = |
|
(T2 |
−T1 ) p = |
(T2 −T1 ) , |
|
|
|
||||||||||
|
|
|
|
|
Mp |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
M |
|
|
|
|||||
|
|
|
|
|
|
|
|
A = |
mR |
|
(T2 −T1 ) . |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
M |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
155

Молекулярна фізика
Робота не залежить від маси гирі й від площі основи посудини.
|
|
|
Обчислення: |
|
|
|
|
= |
кг моль Дж |
= Дж , |
|
A |
|
||||
кг К моль |
|||||
{ A} = |
10−2 8,31 (898−298) |
=1780 . |
|||
|
|
28 10−3 |
|
||
|
|
|
|
|
|
Відповідь: A = 1,78 кДж.
Задача 9.
Після того як у кімнаті протопили піч, температура підвищилася з 15 до 27 °С. На скільки процентів зменшилось число молекул у кімнаті?
|
Дано: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СІ: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
t1 = 15°C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T1 =(273+15) К =288 К |
|
|
|
|
|
||||||||||||||||||||||||||||||
|
t2 |
= 27 °C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T2 =(273+27) К =300 К |
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
p1 |
= p2 = p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
∆N |
|
100% — ? |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Розв’язання: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
p = nkT , |
|
p =n1kT1 |
|
|
тиск газу сталий; |
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p =n2kT2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
n1 = |
|
N1 |
, n2 = |
|
|
|
N2 |
|
|
, |
p = |
|
|
N1 |
|
|
kT1 , |
p = |
|
|
N2 |
|
kT2 , |
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
V |
|
|
|
V |
|
|
|
|
V |
|
|
|
|
V |
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N1 |
= |
|
|
pV |
, |
|
N2 = |
|
|
pV |
|
, |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
kT |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
kT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pV |
|
|
|
|
|
pV |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
− |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
−N2 |
|
|
|
|
|
|
− |
|
|
|
|
|
|
|
|
pV |
|
|
1 |
|
|
|
−T1 |
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
|
|
|
|
|
|
T1 |
|
|
T2 |
|
|
|
|
|||||||||||
|
|
∆N |
= |
|
N1 |
|
= |
|
|
kT1 |
|
|
|
kT2 |
|
|
|
= |
|
|
|
|
|
|
|
|
|
= |
T2 |
, |
||||||||||||||||||||||||
|
|
N |
|
N |
|
|
|
|
|
|
|
pV |
|
|
|
|
|
|
|
|
|
|
pV |
|
|
1 |
|
|
|
|
|
T |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
1 |
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
kT1 |
|
|
|
|
|
|
|
|
|
|
|
|
k |
|
|
T1 |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
∆N |
100%= |
|
T2 −T1 |
|
|
|
100%. |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
156
