
- •Передмова
- •МЕХАНІКА
- •1. КІНЕМАТИКА МАТЕРІАЛЬНОЇ ТОЧКИ
- •1.1. Основні поняття
- •1.4. Прямолінійний рух
- •1.5. Криволінійний рух. Рівномірний рух по колу
- •2. ДИНАМІКА МАТЕРІАЛЬНОЇ ТОЧКИ
- •2.1. Основні закони динаміки. Сила. Рівнодійна сила
- •2.2. Сили в механіці
- •2.4. Алгоритм розв’язання кількісних задач із фізики
- •2.5. Методичні рекомендації щодо розв’язання задач з динаміки
- •2.6. Приклади розв’язання задач
- •3. ЗАКОНИ ЗБЕРЕЖЕННЯ В МЕХАНІЦІ
- •3.1. Імпульс тіла. Імпульс сили
- •3.2. Закон збереження імпульсу
- •3.3. Реактивний рух
- •3.4. Енергія. Закон збереження енергії. Види енергії
- •3.5. Види механічної енергії та їх зв’язок з роботою
- •3.6. Механічна робота і потужність
- •3.7. Механічний удар
- •3.8. Прості механізми
- •4. МЕХАНІКА ТВЕРДОГО ТІЛА
- •4.1. Основні поняття
- •4.2. Умови і види рівноваги твердого тіла
- •4.3. Момент імпульсу. Закон збереження моменту імпульсу
- •4.4. Зіставлення рівнянь механіки поступального й обертального рухів (табл. 2)
- •4.5. Приклади розв’язання задач
- •5. ГІДРОСТАТИКА І АЕРОСТАТИКА
- •5.1. Тиск
- •5.2. Закон Паскаля
- •5.3. Гідростатичний тиск
- •5.4. Сполучені посудини
- •5.5. Гідростатичний парадокс
- •5.6. Гідравлічна машина
- •5.7. Закон Архімеда
- •5.8. Умови плавання тіл (табл. 3)
- •5.9. Атмосферний тиск, його вимірювання
- •5.10. Приклади розв’язання задач
- •6. ГІДРОДИНАМІКА І АЕРОДИНАМІКА
- •6.1. Струминна течія рідин і газів
- •6.2. Рівняння Бернуллі
- •6.3. Підйомна сила крила літака
- •6.4. Коефіцієнт лобового опору для тіл різної форми (табл. 4)
- •1. ОСНОВИ МОЛЕКУЛЯРНО-КІНЕТИЧНОЇ ТЕОРІЇ БУДОВИ РЕЧОВИНИ
- •1.1. Основні положення молекулярно-кінетичної теорії та їх дослідне обґрунтування
- •2. ВЛАСТИВОСТІ ГАЗІВ (ГАЗОВІ ЗАКОНИ)
- •2.2. Газові закони
- •2.3. Закон Дальтона
- •2.5. Середня довжина вільного пробігу молекул
- •2.6. Приклади розв’язання задач
- •3. ВЛАСТИВОСТІ ПАРИ
- •3.1. Пара. Випаровування і конденсація
- •3.2. Насичена і ненасичена пара
- •3.3. Вологість повітря (відносна й абсолютна). Точка роси
- •3.4. Кипіння. Перегріта рідина
- •3.5. Приклади розв’язання задач
- •4.2. Поверхнева енергія. Поверхневий натяг
- •4.3. Явище змочування. Капілярні явища
- •4.4. Формула Лапласа
- •4.5. Приклади розв’язання задач
- •5. ВЛАСТИВОСТІ ТВЕРДИХ ТІЛ
- •5.1. Кристалічні та аморфні тіла. Їхні властивості
- •5.2. Типи твердих кристалів
- •5.3. Рідкі кристали
- •5.4. Дефекти кристалічних ґраток
- •5.5. Механічні властивості твердих тіл
- •5.6. Приклади розв’язання задач
- •6. ТЕПЛОВЕ РОЗШИРЕННЯ ТВЕРДИХ І РІДКИХ ТІЛ
- •6.1. Графік залежності потенціальної енергії взаємодії найпростіших молекул від відстані між ними (потенціальна яма)
- •6.2. Лінійне й об’ємне розширення твердих і рідких тіл
- •6.3. Особливості теплового розширення води
- •6.4. Приклади розв’язання задач
- •1.1. Внутрішня енергія ідеального газу
- •1.2. Робота ідеального газу. Її геометричне тлумачення
- •1.5. Питома теплоємність речовини
- •1.6. Питома теплота згоряння палива. ККД нагрівача
- •1.7. Змінювання агрегатного стану речовини
- •2. ПЕРШИЙ ЗАКОН ТЕРМОДИНАМІКИ. АДІАБАТИЧНИЙ ПРОЦЕС
- •3. ДРУГИЙ ЗАКОН ТЕРМОДИНАМІКИ. ЕНТРОПІЯ
- •4. ТЕПЛОВІ ДВИГУНИ
- •ЕЛЕКТРОДИНАМІКА
- •1. ЕЛЕКТРОСТАТИКА
- •1.1. Електричний заряд. Закон збереження заряду
- •1.7. Електризація тіл
- •2. ПОСТІЙНИЙ СТРУМ
- •2.1. Електричний струм. Сила струму. Густина струму
- •2.3. Послідовне і паралельне з’єднання провідників
- •2.4. ЕРС. Закон Ома для повного кола. З’єднання елементів
- •2.6. Приклади розв’язання задач
- •3. СТРУМИ ПРОВІДНОСТІ
- •3.2. Струм в електролітах
- •3.4. Струм у напівпровідниках
- •3.5. Струм у вакуумі (струм переносу)
- •3.6. Приклади розв’язання задач
- •4. МАГНЕТИЗМ
- •4.1. Магнітне поле. Магнітна індукція поля
- •4.2. Магнітне поле струму
- •4.3. Дія магнітного поля на рухомий заряд (сила Лоренца) і провідник зі струмом (сила Ампера). Правило лівої руки
- •4.4. Дія магнітного поля на рамку зі струмом. Магнітний потік
- •4.5. Закон взаємодії паралельних струмів
- •4.6. Магнітне поле у речовині
- •4.7. Приклади розв’язання задач
- •5. ЕЛЕКТРОМАГНІТНА ІНДУКЦІЯ
- •5.1. Явище електромагнітної індукції. Вихрове електричне поле
- •5.3. Індукційні струми в суцільних провідниках
- •5.4. Самоіндукція. Індуктивність. Енергія магнітного поля
- •5.5. Електромагнітне поле. Теорія Максвелла в якісному вигляді
- •5.6. Приклади розв’язання задач
- •ФІЗИКА КОЛИВАНЬ
- •1. КОЛИВАЛЬНИЙ РУХ
- •1.1. Основні поняття
- •1.2. Гармонічні коливання
- •2. ЗМІННИЙ СТРУМ
- •2.1. Одержання змінного синусоїдного струму. Закономірності змінного струму
- •2.2. Діюче значення змінного струму
- •2.3. Опір змінному струму. Закон Ома для змінного струму
- •2.4. Електричний резонанс. Резонанс напруг. Резонанс струмів
- •2.5. Випрямлення змінного струму
- •2.6. Трансформація змінного струму
- •2.7. Змінний струм високої частоти
- •2.8. Приклади розв’язання задач
- •3. ЕЛЕКТРОМАГНІТНІ КОЛИВАННЯ
- •3.2. Закономірності вільних електромагнітних коливань. Згасаючі коливання
- •3.3. Отримання незгасаючих електромагнітних коливань
- •3.4. Приклади розв’язання задач
- •4. МЕХАНІЧНІ ХВИЛІ. ЗВУК
- •4.1. Поздовжні і поперечні хвилі. Промінь. Довжина хвилі. Фронт хвилі
- •4.2. Принцип Гюйгенса
- •4.3. Інтерференція хвиль
- •4.4. Дифракція хвиль
- •4.5. Звук. Звукові хвилі. Інтенсивність, висота і тембр звуку
- •4.6. Луна. Звуковий резонанс
- •4.7. Приклади розв’язання задач
- •5. ЕЛЕКТРОМАГНІТНІ ХВИЛІ
- •5.1. Випромінювання електромагнітних хвиль відкритим коливальним контуром
- •5.3. Принцип радіозв’язку. Модуляція і детектування (демодуляція)
- •5.4. Класифікація радіохвиль і особливості їх поширення
- •5.5. Приклади розв’язання задач
- •ОПТИКА
- •1. ХВИЛЬОВА ОПТИКА
- •1.1. Монохроматичне світло. Заломлення світла
- •1.2. Дисперсія світла
- •1.4. Інтерференція білого світла за Френелем
- •1.5. Інтерференція білого світла за Ньютоном. Кільця Ньютона
- •1.6. Дифракція білого світла
- •1.7. Поляризація світла
- •2. ГЕОМЕТРИЧНА ОПТИКА
- •2.2. Закони відбивання світла
- •2.3. Закони заломлення світла. Повне відбивання світла
- •2.4. Хід променів через плоскопаралельну пластинку, призму
- •2.5. Сферичні лінзи
- •2.6. Око як оптична система
- •2.8. Сферичні дзеркала
- •2.9. Приклади розв’язання задач
- •3. ВИПРОМІНЮВАННЯ ТА СПЕКТРИ
- •3.1. Люмінесценція
- •3.2. Інфрачервоні та ультрафіолетові промені
- •3.3. Рентгенівські промені
- •3.4. Спектри випромінювання. Спектри поглинання
- •3.5. Спектральний аналіз
- •1.1. Поняття про простір і час
- •1.2. Постулати СТВ. Перетворення Лоренца
- •1.4. Приклади розв’язання задач
- •2. КВАНТОВА ОПТИКА
- •2.1. Теорія Планка. Імпульс фотона
- •2.2. Фотоефект
- •2.3. Фотоелементи та їх застосування
- •2.4. Світловий тиск
- •2.5. Корпускулярно-хвильовий дуалізм
- •2.6. Хімічний вплив світла. Чорно-біла фотографія. Фотосинтез. Ланцюгові реакції
- •2.7. Приклади розв’язання задач
- •3. ФІЗИКА АТОМА
- •3.1. Планетарна модель атома Резерфорда
- •3.2. Постулати Бора. Борівські орбіти
- •3.3. Атом Гідрогену за Н. Бором
- •3.4. Приклади розв’язання задач
- •4. ФІЗИКА АТОМНОГО ЯДРА
- •4.1. Відкриття протона і нейтрона
- •4.2. Теорія будови ядра
- •4.3. Енергія зв’язку ядра. Дефект маси
- •4.4. Природна радіоактивність
- •4.6. Часткове звільнення внутрішньоядерної енергії при екзотермічних ядерних реакціях
- •4.7. Закон радіоактивного розпаду
- •4.8. Приклади розв’язання задач
- •5. ЕЛЕМЕНТАРНІ ЧАСТИНКИ
- •5.1. Фізика елементарних частинок
- •5.2. Приклади розв’язання задач
- •Предметний покажчик

2. Властивості газів (газові закони)
Спростимо вирази (1) і (2) підстановкою значень і знайдемо відношення маси азоту до маси водню:
|
|
|
m |
+ |
|
|
|
m |
|
|||||||||||
4 |
|
|
|
а |
|
|
|
в |
|
|||||||||||
|
M(N) |
|
M(H2 ) |
|
||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
M(H2 ) = 2M(H) , |
|
|||||||||||||||||||
4 |
|
|
|
mа |
|
|
|
+ 4 |
|
|
mв |
|
||||||||
|
|
|
|
|
|
2M(H) |
|
|||||||||||||
|
|
M (N) |
|
|||||||||||||||||
|
|
|
|
mа |
|
|
= |
|
|
|
|
mв |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
. |
|
||||||||
|
M(N) |
|
M(H) |
|
||||||||||||||||
Отже, |
|
mа |
|
= |
|
|
M(N) |
|
||||||||||||
|
mв |
|
|
|
M(H) |
|
||||||||||||||
|
m |
|
14 |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
||||||||||||||
|
|
|
а |
|
= |
|
|
|
|
|
= 14 . |
|
||||||||
|
m |
|
1 |
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||
|
|
в |
|
|
|
|
|
|
|
|
|
|||||||||
|
|
m |
+ |
|
= 3 |
а |
|||
M(N) |
||||
|
|
|
||
|
|
|
|
|
m
= 3 (а ) + 3
M N
.
Обчислення:
m
в ,
M(H)
Mm(Hв ) ,
Відповідь: маса азоту в 14 разів більша за масу водню.
2.Властивості газів (газові закони)
—Гази не зберігають ні форми, ні об’єму.
—Характер молекулярного руху в газах — безладний (хаотичний) рух.
2.1. Рівняння стану ідеального газу (рівняння Клапейрона—Менделєєва)
Рівняння стану ідеального газу зв’язує макроскопічні
параметри p, V, T, які характеризують стан даної маси тіла. Рівняння стану ідеального газу (рівняння Клапейрона— Менделєєва), яке зв’язує макропараметри одного стану газу:
pV = Mm RT , або pV = vRT .
145

Молекулярна фізика
Рівняння стану ідеального газу (рівняння Клапейрона) , яке зв’язує макроскопічні стани системи даної маси газу при переході із стану 1 у стан 2:
( p1, V1, T1 ) m= const→( p2, V2, T2 ) ,
p1V1 = p2V2 . T1 T2
2.2. Газові закони
Газові закони визначають кількісну залежність між двома параметрами даної маси газу при фіксованому значенні третього параметру.
Процеси, перебіг яких відбувається при незмінному значенні одного із параметрів, називаються ізопроцесами.
2.2.1. Закон Бойля—Маріотта (ізотермічний процес)
T = const , ∆T = 0 , m = const .
Ізотермічний процес описується законом Бойля— Маріотта: для даної маси газу добуток тиску газу на його
об’єм є сталим, якщо температура газу не змінюється:
p1V1 = p2V2 , або pV = const .
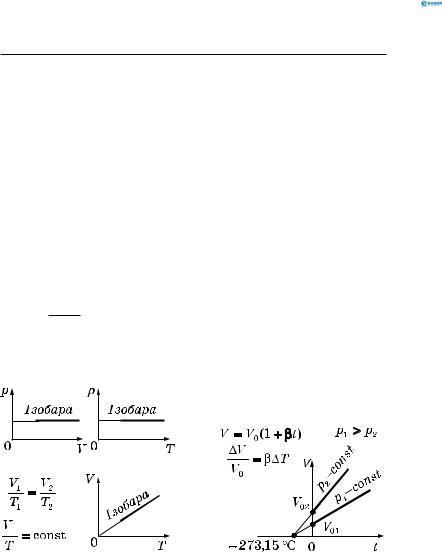
Ізотерма — графік залежності між параметрами даної маси газу при постійній температурі (рис. 121).
Рис. 121
Ізотермічний процес проходить повільно, оскільки він зумовлений теплообміном з навколишнім середовищем.
146
2.Властивості газів (газові закони)
2.2.2.Закон Гей-Люссака (ізобарний процес)
p = const , ∆ p = 0 , m = const .
Ізобарний процес описується законом Гей-Люссака: для даної маси газу відношення об’єму і температури є сталим,
якщо тиск газу не змінюється: |
|
|
|
|
|
||||||
|
V1 |
|
= |
V2 |
, або |
|
V |
|
= const . |
||
|
T |
|
T |
T |
|
|
|
||||
1 |
|
2 |
|
|
|
|
|
|
|
||
Закон Гей-Люссака можна подати у вигляді |
|||||||||||
V = V0 |
(1+βt) , або |
|
|
∆V |
=β∆T , |
||||||
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
V |
||
|
|
|
|
|
|
|
|
|
0 |
|
|
де t — температура за міжнародною шкалою; V0 — об’єм при 0 °С;
β— коефіцієнт об’ємного розширення газу;
β= 2731 К−1 — при сталому тиску для ідеального газу.
Ізобара — графік залежності між параметрами стану даної маси газу при сталому тиску (рис. 122, 123).
Рис. 122 Рис. 123
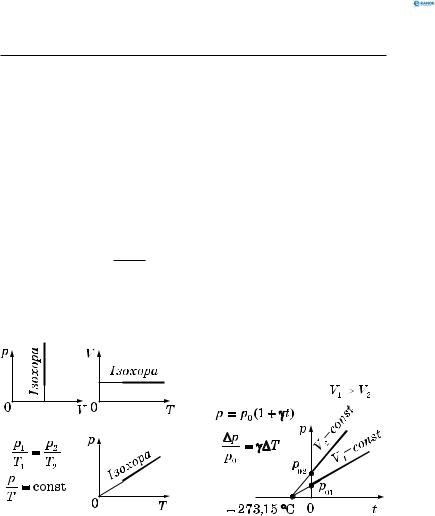
2.2.3. Закон ќарля (ізохорний процес)
V = const , ∆V = 0 , m = const .
Ізохорний процес описується законом Шарля: для даної маси газу відношення тиску до температури є сталим, якщо об’єм не змінюється:
147
Молекулярна фізика
p1 |
= |
p2 |
, або |
P |
= const . |
|
T |
T |
T |
||||
|
|
|
||||
1 |
|
2 |
|
|
|
Закон Шарля можна подати у вигляді
p = p0 (1+ γt) , або |
∆p |
= γ∆T , |
|
p |
|||
|
|
||
|
0 |
|
де p — тиск газу при температурі t;
p0 — тиск газу при температурі 0 °С; γ — термічний коефіцієнт тиску;
для всіх газів γ = 2731 К−1 .
Ізохора — графік залежності між параметрами стану даної маси газу при сталому об’ємі (рис. 124; 125).
Рис. 124 |
Рис. 125 |
2.3. Закон Дальтона
Закон Дальтона: тиск суміші газів дорівнює сумі парціальних тисків складових газів:
p = p1 + p2 +…+ pn .
Парціальний тиск — це тиск, який створював би газ, якби він займав даний об’єм сам.
148
