
- •Курс лекцій з фізики
- •Змістовний модуль 9
- •I. Фізичні основи механіки…………………………………………………….18
- •II. Електростатика…………………………………………………………….....47
- •III. Постійний електричний струм………………………………………..77
- •IV. Електромагнетизм………………………………………………………….…91
- •V. Коливання та хвилі……………………………………………...…122
- •VI. Хвильова оптика……………………………………………….…150
- •VII. Ядерна фізика…………………………………………………….244
- •VIII. Основи молекулярної фізики і термодинаміки……………...261
- •IX. Фізика твердого тіла………………………………………..…283
- •Змістовний модуль № 1
- •Вступна лекція
- •Роль фізики у розвитку техніки та вплив техніки на розвиток фізики
- •I. Фізичні основи механіки
- •Механічний рух полягає в зміні з часом взаємного розташування тіл, або їх частин у просторі.
- •1. Основи кінематики поступального руху
- •В). Циліндрично-полярні координати ρ, φ, z.
- •Якщо траекторія – пряма лінія , то такий рух називають прямолінійним, а якщо крива – криволінійним. Найпростішим прикладом криволінійного руху є рух матаеріальної точки по колу :
- •2. Основи кінематики обертального руху
- •3. Абсолютні і відносні швидкості та прискорення
- •І закон Ньютона
- •Іі закон Ньютона
- •III закон Ньютона
- •5. Закон збереження імпульсу
- •6. Рух тіла із змінною масою. Реактивний рух
- •Імпульс системи
- •Одержана формула виражає закон руху центра мас
- •7.1. Сили інерції
- •Приклади руху тіл у нісв
- •8.1 Момент сили та момент імпульса
- •8.2 Рівняння моментів
- •8.3 Момент інерції тіла відносно осі обертання
- •8.4 Рівняння динаміки обертального руху
- •8.5 Закон збереження момента імпульса
- •9. Пружні напруження. Закон Гука. Деформація стрижнів
- •10. Робота. Енергія
- •10.1 Кінетична енергія з найдемо роботу , яку виконує сила при переміщенні матеріальної точки масою m із положення 1 в положення 2.
- •10.3 Закон збереження механічної енергії
- •10.4 Кінетична енергія тіла при обертальному русі
- •11. Рівняння руху та рівноваги твердого тіла
- •Іі. Електростатика
- •15. Закон збереження електричного заряду. Електричне поле. Напруженість електричного поля
- •16. Потік вектора напруженості.
- •17. Теорема Остроградського-Ґаусса
- •18. Застосування теореми Остроградського-Ґаусса до розрахунку напруженості електростатичних полів
- •20. Напруженість як градієнт потенціалу Розглянемо випадок переміщення одиничного додатнього точкового заряду q iз точки 1 в точку 2 вздовж осі X.
- •17. Провідники у електростатичному полі
- •Явище перерозподілу поверхневих зарядів на провіднику у зовнішньому електростатичному полі називається електростатичною індукцією, а перерозподілені заряди – індукованими зарядами.
- •17.1 Електрична ємність
- •17.2 Взаємна електроємність
- •18. Енергія зарядженого відокремленого провідника, конденсатора. Енергія електростатичного поля. Об’ємна густина енергії
- •19. Діелектрики у електростатичному полі
- •19.1 Типи діелектриків. Електронна і орієнтаційна поляризація
- •19.2 Неполярні діелектрики. Електронна поляризація
- •19.3 Полярні діелектрики. Дипольна, або орієнтаційна поляризація
- •19.4 Іонні діелектрики. Іонна поляризація
- •20. Механічні ефекти в діелектриках. Електрострикція та п’єзоефект. Сегнотелектрики.
- •22.Закон Ома у диференціальній формі
- •23. Закон Джоуля-Лєнца
- •24. Закон Ома у інтегральній формі
- •25. Розрахунок параметрів електричних кіл
- •26. Електричний струм у вакуумі
- •27. Робота виходу електронів з металу. Контактна різниця потенціалів
- •28. Термоелектричні явища
- •29. Електричний струм у газах
- •29.1. Типи газових розрядів:
- •2. Взаємодія між постійним електричним струмом і магнітною стрілкою
- •Якщо контур зі струмом повернути на 90° від рівноважного положення, то на нього буде діяти максимальний обертальний момент Мmax.
- •31. Закон Біо-Савара-Лапласа
- •32. Закон повного струму для магнітного поля у вакуумі. Вихровий характер магнітного поля
- •Якщо контур не охоплює провідник зі струмом, то
- •33. Cила Лоренца
- •34. Контур зі струмом у магнітному колі
- •35. Магнітний потік. Теорема Остроградського-Ґаусса
- •36. Робота переміщення провідника і контуру зі струмом у магнітному полі
- •Матеріал для самостійної роботи
- •37. Магнітні моменти атомів. Намагніченість. Атоми в магнітному полі
- •39. Магнітне поле в речовині. Закон повного струму для магнітного поля в речовині. Напруженість магнітного поля
- •40. Феромагнетики
- •41. Явище електромагнітної індукції. Закон Ленца. Закон електромагнітної індукції (закон Фарадея)
- •42. Явище самоіндукції. Індуктивність
- •43. Явище взаємної індукції
- •44. Енергія магнітного поля
- •46. Вільні електромагнітні коливання у коливальному контурі
- •Якщо конденсатор зарядити (надати заряд q), а потім замкнути коло ключем к, то він починає розряджатись.
- •Тоді сила струму змінюється у контурі за законом
- •47. Диференціальне рівняння згасаючих коливань і його розв’язок
- •Графік залежності х від часу наведено на рис.1
- •48. Диференціальне рівняння вимушених коливань і його розв’язок. Резонанс
- •49. Вимушені коливання у електромагнітному коливальному контурі. Кола змінного струму. Закон Ома
- •50. Резонанс напруг
- •51. Розгалуження змінних струмів. Резонанс струму
- •52. Робота та потужність змінного струму
- •53. Утворення хвиль в пружному середовищі. Поздовжні і поперечні хвилі. Рівняння біжучої хвилі
- •54. Інтерференція хвиль. Рівняння стоячої хвилі
- •55.Звукові хвилі та їх властивості. Ефект Допплера.
- •Ефект Допплера
- •56. Основи теорії Максвелла для електромагнітного поля. Струм зміщення
- •57. Рівняння Максвелла для електромагнітного поля
- •58. Основні властивості електромагнітних хвиль
- •Змістовний модуль 8
- •Vіii. Основи молекулярної фізики і термодинаміки
- •99. Статистичний і термодинамічний
- •100. Рівняння молекулярно-кінетичної теорії ідеального газу для тиску
- •101. Середня кінетична енергія
- •102. Розподіл Максвелла молекул
- •103. Барометрична формула. Розподіл Больцмана частинок у зовнішньому потенціальному полі
- •104. Закон рівномірного розподілу енергії за ступенями вільності молекул
- •105. Перший закон термодинаміки. Робота газу при зміні його об'єму
- •106. Теплоємність. Класична молекулярно-кінетична теорія теплоємностей ідеального газу та її обмеженість.
- •107. Застосування першого закону термодинаміки до ізопроцесів
- •108. Адіабатний процес. Застосування першого закону термодинаміки до адіабатного процесу ідеального газу
- •109. Коловий процес. Теплові двигуни і холодильні машини. Оборотні і необоротні процеси
- •110. Цикл Карно і його коефіцієнт корисної дії для ідеального газу
- •111. Другий закон термодинаміки
- •112. Ентропія. Ентропія ідеального газу
- •113. Теорема Нернста та її наслідки
- •Іх. Фізика твердого тіла
- •114. Поняття про квантові статистики Бозе – Ейнштейна і Фермі - Дірака
- •115. Розподіл електронів провідності в металі за енергіями. Енергія Фермі
- •116. Енергетичні зони в кристалах
- •117. Розподіл електронів по енергетичних зонах. Валентна зона і зона провідності. Метали, діелектрики і напівпровідники
- •118. Власна провідність напівпровідників
- •119. Домішкова провідність напівпровідників
- •121. Люмінесценція твердих тіл
- •123.Рідкі кристали
106. Теплоємність. Класична молекулярно-кінетична теорія теплоємностей ідеального газу та її обмеженість.
Для характеристики теплових властивостей газу, як і будь-якого іншого тіла, користуються особливою величиною - теплоємністю.
Теплоємністю тіла називається фізична величина, яка числово дорівнює кількості теплоти, яку потрібно надати тілу, щоб підвищити його температуру на один кельвін:
![]()
Значення СТ залежить віл маси тіла, його хімічного складу, термодинамічного стану і виду процесу зміни стану тіла, в якому надходить теплота Q.
Питомою теплоємністю c називається фізичпа величина, що числово дорівнює кількості теплоти, яку слід надати одиниці маси цієї речовини для підвищення її температури на 1К :
![]()
М![]() олярною
теплоємністю С називається фізична
величина, яка числово дорівнює
кількості теплоти, яку треба надати
одному молю речовини для підвищення
його температури на 1К :
олярною
теплоємністю С називається фізична
величина, яка числово дорівнює
кількості теплоти, яку треба надати
одному молю речовини для підвищення
його температури на 1К :
де
v = m/ - кількість молей газу.
Між молярною теплоємністю С і питомою теплоємністю с існує співвідношення: С = с.
Оскільки величина теплоємності газу залежить від умов, при яких йому надається кількість теплоти, то розрізняють теплоємність при сталому об'ємі СV і теплоємність при сталому тиску CP. В першому випадку нагрівання газу відбувається при сталому об'ємі, а в другому - при сталому тиску.
Якщо нагрівають газ, то згідно з першим законом термодинаміки Q = dU + A,
а для одного моля газу
CdT = dUm + pdVm.
Якщо газ нагрівається при сталому об'ємі, то надана газу теплота йде лише на збільшення його внутрішньої енергії:
![]()
Якщо газ нагрівається при постійному тиску, то
![]()
![]()
Т![]() ут
враховано, що не залежить від виду
процесу, оскільки внутрішня енергія
ідеального газу не залежить ні від p, ні
від V, а визначається лише температурою.
Тому завжди
ут
враховано, що не залежить від виду
процесу, оскільки внутрішня енергія
ідеального газу не залежить ні від p, ні
від V, а визначається лише температурою.
Тому завжди
З![]() гідно
з рівнянням Менделєєва - Клапейрона
гідно
з рівнянням Менделєєва - Клапейрона
В результаті
Сp = СV + R.
Отриманий вираз називається рівнянням Маєра. Воно вказує на те, що Ср завжди більше від СV на величину універсальної газової сталої. Це пояснюється тим, що під час нагрівання газу при сталому тиску потрібна додаткова кількість теплоти на виконання роботи розширення газу.
Оскільки dUm = i/2 RdT, то
![]()
Отримані вирази для СV i Ср добре збігаються з експериментом для одноатомних і багатьох двоатомних газів при кімнатній температурі (Н2, N2, O2). Однак у Сl2 CV = 6/2 R, що неможливо пояснити. У триатомних газів спостерігаються систематичні відхилення від теорії.
Експеримент показав, що теплоємність залежить від температури. Водночас згідно з формулами для СV i Ср вона стала для даного газу.
Причина розбіжності теорії і експерименту для температурної залежності СV полягає в тому, що закон про рівномірний розподіл енергій між всіма ступенями вільності молекул не є правильним, а лише наближено застосовується для найпростіших газів, що перебувають при не дуже низьких температурах.
Лише квантова теорія дає змогу пояснити температурну залежність теплоємності.
107. Застосування першого закону термодинаміки до ізопроцесів
Ізопроцесами в газах називаються процеси, при яких один із основних параметрів стану (V, р, Т) зберігається постійним.
Ізохорний процес (V = соnst, m=соnst).
Діаграма цього процесу в координатах р, V зображається прямою, яка паралельна до осі ординат, де 1-2 - ізохорнне нагрівання, а 1-3 - ізохорне охолодження (рис. 50).
П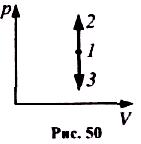 ри
iзохорному процесі
газ не виконує роботи над зовнішніми
тілами: А
= рdV = 0.
ри
iзохорному процесі
газ не виконує роботи над зовнішніми
тілами: А
= рdV = 0.
О тже,
з першого закону термодинаміки Q
= dU+ +A
для ізохорного процесу випливає, що
Q
= dU. Оскільки dUm
= CVdT,
то для довільної маси газу
тже,
з першого закону термодинаміки Q
= dU+ +A
для ізохорного процесу випливає, що
Q
= dU. Оскільки dUm
= CVdT,
то для довільної маси газу
![]()
І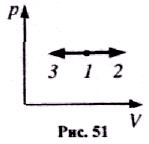 зобарний
процес (р = соnst, m = const).
зобарний
процес (р = соnst, m = const).
Діаграма цього процесу в координатах р,V зображається прямою, яка паралельна до осі V (рис. 51), де 1-2 - ізобарний процес розширення. 1-3 - ізобарний стиск.
Р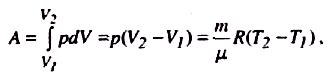 обота,
яку виконує газ при ізобарному
розширенні від об'єму V1
до V2,
дорівнює
обота,
яку виконує газ при ізобарному
розширенні від об'єму V1
до V2,
дорівнює
де використано рівняння Менделєєва - Клапeйрона.
При ізобарному процесі при наданні газу масою m кількості теплоти
![]()
його внутрішня енергія зростає на величину
![]()
Г![]() аз
виконує роботу
аз
виконує роботу
Ізотермічний процес (Т = соnst, m = соnst).
Д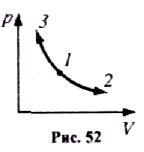 іаграма
цього процесу в координатах р, V є
гіперболою. 1-3 -ізотермічний стиск, 1-2 -
ізотермічне розширення (рис. 52).
іаграма
цього процесу в координатах р, V є
гіперболою. 1-3 -ізотермічний стиск, 1-2 -
ізотермічне розширення (рис. 52).
Робота газу при ізотермічному розширенні:
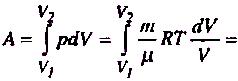
![]()
При Т = соnst внутрішня енергія ідеального газу не змінюється, тобто
![]()
т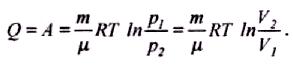 обто
вся кількість теплоти, надана газу,
витрачається на виконання ним роботи
проти зовнішніх сил:
обто
вся кількість теплоти, надана газу,
витрачається на виконання ним роботи
проти зовнішніх сил:
Робота розширення газу (V2 > V1) додатна. У випадку стиску газу (процес 1-3) робота А, що виконується газом, від'ємна, водночас зовнішні сили виконують додатну роботу А' = -А. При цьому Q < 0, тобто теплота від газу відводиться.
