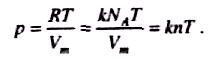- •Курс лекцій з фізики
- •Змістовний модуль 9
- •I. Фізичні основи механіки…………………………………………………….18
- •II. Електростатика…………………………………………………………….....47
- •III. Постійний електричний струм………………………………………..77
- •IV. Електромагнетизм………………………………………………………….…91
- •V. Коливання та хвилі……………………………………………...…122
- •VI. Хвильова оптика……………………………………………….…150
- •VII. Ядерна фізика…………………………………………………….244
- •VIII. Основи молекулярної фізики і термодинаміки……………...261
- •IX. Фізика твердого тіла………………………………………..…283
- •Змістовний модуль № 1
- •Вступна лекція
- •Роль фізики у розвитку техніки та вплив техніки на розвиток фізики
- •I. Фізичні основи механіки
- •Механічний рух полягає в зміні з часом взаємного розташування тіл, або їх частин у просторі.
- •1. Основи кінематики поступального руху
- •В). Циліндрично-полярні координати ρ, φ, z.
- •Якщо траекторія – пряма лінія , то такий рух називають прямолінійним, а якщо крива – криволінійним. Найпростішим прикладом криволінійного руху є рух матаеріальної точки по колу :
- •2. Основи кінематики обертального руху
- •3. Абсолютні і відносні швидкості та прискорення
- •І закон Ньютона
- •Іі закон Ньютона
- •III закон Ньютона
- •5. Закон збереження імпульсу
- •6. Рух тіла із змінною масою. Реактивний рух
- •Імпульс системи
- •Одержана формула виражає закон руху центра мас
- •7.1. Сили інерції
- •Приклади руху тіл у нісв
- •8.1 Момент сили та момент імпульса
- •8.2 Рівняння моментів
- •8.3 Момент інерції тіла відносно осі обертання
- •8.4 Рівняння динаміки обертального руху
- •8.5 Закон збереження момента імпульса
- •9. Пружні напруження. Закон Гука. Деформація стрижнів
- •10. Робота. Енергія
- •10.1 Кінетична енергія з найдемо роботу , яку виконує сила при переміщенні матеріальної точки масою m із положення 1 в положення 2.
- •10.3 Закон збереження механічної енергії
- •10.4 Кінетична енергія тіла при обертальному русі
- •11. Рівняння руху та рівноваги твердого тіла
- •Іі. Електростатика
- •15. Закон збереження електричного заряду. Електричне поле. Напруженість електричного поля
- •16. Потік вектора напруженості.
- •17. Теорема Остроградського-Ґаусса
- •18. Застосування теореми Остроградського-Ґаусса до розрахунку напруженості електростатичних полів
- •20. Напруженість як градієнт потенціалу Розглянемо випадок переміщення одиничного додатнього точкового заряду q iз точки 1 в точку 2 вздовж осі X.
- •17. Провідники у електростатичному полі
- •Явище перерозподілу поверхневих зарядів на провіднику у зовнішньому електростатичному полі називається електростатичною індукцією, а перерозподілені заряди – індукованими зарядами.
- •17.1 Електрична ємність
- •17.2 Взаємна електроємність
- •18. Енергія зарядженого відокремленого провідника, конденсатора. Енергія електростатичного поля. Об’ємна густина енергії
- •19. Діелектрики у електростатичному полі
- •19.1 Типи діелектриків. Електронна і орієнтаційна поляризація
- •19.2 Неполярні діелектрики. Електронна поляризація
- •19.3 Полярні діелектрики. Дипольна, або орієнтаційна поляризація
- •19.4 Іонні діелектрики. Іонна поляризація
- •20. Механічні ефекти в діелектриках. Електрострикція та п’єзоефект. Сегнотелектрики.
- •22.Закон Ома у диференціальній формі
- •23. Закон Джоуля-Лєнца
- •24. Закон Ома у інтегральній формі
- •25. Розрахунок параметрів електричних кіл
- •26. Електричний струм у вакуумі
- •27. Робота виходу електронів з металу. Контактна різниця потенціалів
- •28. Термоелектричні явища
- •29. Електричний струм у газах
- •29.1. Типи газових розрядів:
- •2. Взаємодія між постійним електричним струмом і магнітною стрілкою
- •Якщо контур зі струмом повернути на 90° від рівноважного положення, то на нього буде діяти максимальний обертальний момент Мmax.
- •31. Закон Біо-Савара-Лапласа
- •32. Закон повного струму для магнітного поля у вакуумі. Вихровий характер магнітного поля
- •Якщо контур не охоплює провідник зі струмом, то
- •33. Cила Лоренца
- •34. Контур зі струмом у магнітному колі
- •35. Магнітний потік. Теорема Остроградського-Ґаусса
- •36. Робота переміщення провідника і контуру зі струмом у магнітному полі
- •Матеріал для самостійної роботи
- •37. Магнітні моменти атомів. Намагніченість. Атоми в магнітному полі
- •39. Магнітне поле в речовині. Закон повного струму для магнітного поля в речовині. Напруженість магнітного поля
- •40. Феромагнетики
- •41. Явище електромагнітної індукції. Закон Ленца. Закон електромагнітної індукції (закон Фарадея)
- •42. Явище самоіндукції. Індуктивність
- •43. Явище взаємної індукції
- •44. Енергія магнітного поля
- •46. Вільні електромагнітні коливання у коливальному контурі
- •Якщо конденсатор зарядити (надати заряд q), а потім замкнути коло ключем к, то він починає розряджатись.
- •Тоді сила струму змінюється у контурі за законом
- •47. Диференціальне рівняння згасаючих коливань і його розв’язок
- •Графік залежності х від часу наведено на рис.1
- •48. Диференціальне рівняння вимушених коливань і його розв’язок. Резонанс
- •49. Вимушені коливання у електромагнітному коливальному контурі. Кола змінного струму. Закон Ома
- •50. Резонанс напруг
- •51. Розгалуження змінних струмів. Резонанс струму
- •52. Робота та потужність змінного струму
- •53. Утворення хвиль в пружному середовищі. Поздовжні і поперечні хвилі. Рівняння біжучої хвилі
- •54. Інтерференція хвиль. Рівняння стоячої хвилі
- •55.Звукові хвилі та їх властивості. Ефект Допплера.
- •Ефект Допплера
- •56. Основи теорії Максвелла для електромагнітного поля. Струм зміщення
- •57. Рівняння Максвелла для електромагнітного поля
- •58. Основні властивості електромагнітних хвиль
- •Змістовний модуль 8
- •Vіii. Основи молекулярної фізики і термодинаміки
- •99. Статистичний і термодинамічний
- •100. Рівняння молекулярно-кінетичної теорії ідеального газу для тиску
- •101. Середня кінетична енергія
- •102. Розподіл Максвелла молекул
- •103. Барометрична формула. Розподіл Больцмана частинок у зовнішньому потенціальному полі
- •104. Закон рівномірного розподілу енергії за ступенями вільності молекул
- •105. Перший закон термодинаміки. Робота газу при зміні його об'єму
- •106. Теплоємність. Класична молекулярно-кінетична теорія теплоємностей ідеального газу та її обмеженість.
- •107. Застосування першого закону термодинаміки до ізопроцесів
- •108. Адіабатний процес. Застосування першого закону термодинаміки до адіабатного процесу ідеального газу
- •109. Коловий процес. Теплові двигуни і холодильні машини. Оборотні і необоротні процеси
- •110. Цикл Карно і його коефіцієнт корисної дії для ідеального газу
- •111. Другий закон термодинаміки
- •112. Ентропія. Ентропія ідеального газу
- •113. Теорема Нернста та її наслідки
- •Іх. Фізика твердого тіла
- •114. Поняття про квантові статистики Бозе – Ейнштейна і Фермі - Дірака
- •115. Розподіл електронів провідності в металі за енергіями. Енергія Фермі
- •116. Енергетичні зони в кристалах
- •117. Розподіл електронів по енергетичних зонах. Валентна зона і зона провідності. Метали, діелектрики і напівпровідники
- •118. Власна провідність напівпровідників
- •119. Домішкова провідність напівпровідників
- •121. Люмінесценція твердих тіл
- •123.Рідкі кристали
100. Рівняння молекулярно-кінетичної теорії ідеального газу для тиску
У молекулярно-кінетичній теорії користуються моделлю ідеального газу, що задовольняє такі умови:
1) власний об'єм молекул газу нехтовно малий порівняно з об'ємом посудини;
2) між молекулами газу відсутні силпи взаємодії;
3) зіткнення молекул газу між собою і зі стінками посудини абсолютно пружні.
Модель ідеального газу можна використати, вивчаючи реальні гази, оскільки вони при умовах, близьких до нормальних, а також при низьких тисках і високих температурах близькі за своїми властивостями до ідеального газу.
Основне рівняння молекулярно-кінетичної теорії пов'язує параметри газу з характеристиками руху його молекул, тобто встановлює залежність між тиском і об'ємом газу та кінетичною енергією поступального руху його молекул.
Тиск газу в посудині є результатом, зіткнення молекул газу із стінками посудини. Тиск газу є макроскопічним проявом руху молекул.
Р озглянемо
однорідний газ, який поміщений в посудину
кубічної форми. Напрямимо осі системи
відліку вздовж ребер куба (рис. 38). Нехай
певна молекула М рухається в посудині
зі швидкістю v. Швидкість v можна розкласти
на три складові координатних осей:
озглянемо
однорідний газ, який поміщений в посудину
кубічної форми. Напрямимо осі системи
відліку вздовж ребер куба (рис. 38). Нехай
певна молекула М рухається в посудині
зі швидкістю v. Швидкість v можна розкласти
на три складові координатних осей:
v =vx + vy + vz.
В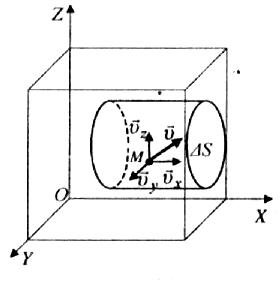 иділимо
на стінці посудини елементарну
площину S,
яка перпендикулярна до осі X. При кожному
зіткненні молекула передає площині
імпульс 2m0vx
,
де m0
–
маса молекули. За час t
площини досягнуть ті молекули, які
знаходяться в об’ємі циліндра з основою
S
і висотою vxt.
Кількість цих молекул дорівнює nSvxt,
де n - кількість молекул в одиниці об’єму
газу. З них тільки половина потрапляє
на площину S.
Решта через повну безладність молекулярних
рухів рухаеться не до стінки, а від неї.
За час t
об площину S
ударяються Nx
= 1/2nStvx
молекул газу.
иділимо
на стінці посудини елементарну
площину S,
яка перпендикулярна до осі X. При кожному
зіткненні молекула передає площині
імпульс 2m0vx
,
де m0
–
маса молекули. За час t
площини досягнуть ті молекули, які
знаходяться в об’ємі циліндра з основою
S
і висотою vxt.
Кількість цих молекул дорівнює nSvxt,
де n - кількість молекул в одиниці об’єму
газу. З них тільки половина потрапляє
на площину S.
Решта через повну безладність молекулярних
рухів рухаеться не до стінки, а від неї.
За час t
об площину S
ударяються Nx
= 1/2nStvx
молекул газу.
Загальний імпульс, який переданий молекулами площини Px = =2m0v1xN2x + 2m0v2xN2x + … +2m0vlxNlx = m0St(n1v21x + n2v22x + … +nl2lx), n1,n2…nn – кількість молекул, що мають швидкості v1,v2…vn, відповідно. Тиск газу на площину S
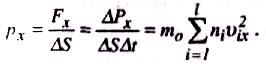 Зважаючи
на цілковиту хаотичність рухів молекул,
тиск газу в будь-якому нанрямку повинен
бути однаковий, тобто
Зважаючи
на цілковиту хаотичність рухів молекул,
тиск газу в будь-якому нанрямку повинен
бути однаковий, тобто
px = py = pz = p.
Д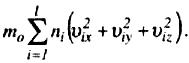 одамо
почленно рівняння для px,
py
i pz:
одамо
почленно рівняння для px,
py
i pz:
p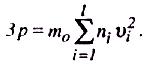 x
+ py+
pz
= 3p =
x
+ py+
pz
= 3p =
Ч![]() ерез
те, що v2ix
+ v2iy
+ v2iz
= v2i
,
то
ерез
те, що v2ix
+ v2iy
+ v2iz
= v2i
,
то
В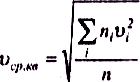 еличина
- це сума квадратів швидкостей усіх
молекул в одиниці об'єму газу. При великій
кількості молекул немає потреби знати
значення квадрита швидкості кожної
молекули. Тому знайдемо середнє значення
цієї величини. За визначенням
еличина
- це сума квадратів швидкостей усіх
молекул в одиниці об'єму газу. При великій
кількості молекул немає потреби знати
значення квадрита швидкості кожної
молекули. Тому знайдемо середнє значення
цієї величини. За визначенням
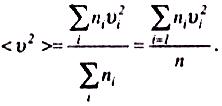
Величина
називається середньою квадратичною швидкістю.
В![]() результаті тиск газу дорівнюватиме:
результаті тиск газу дорівнюватиме:
Це рівняння називається основним рівнянням молекулярно-кінетичної теорії ідеального газу для тиску.
З![]() найдену
формулу перепишемо у вигляді:
найдену
формулу перепишемо у вигляді:
д![]() е
<к>
- середня кінетична енергія поступального
руху однієї молекули газу.
е
<к>
- середня кінетична енергія поступального
руху однієї молекули газу.
Г![]() устина
газу
устина
газу
Тоді
О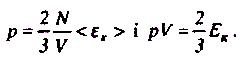 скільки
кінетична енергія поступального
руху молекул газу Еk
= =N<к>,
то
скільки
кінетична енергія поступального
руху молекул газу Еk
= =N<к>,
то
Ц![]() е
рівняння перепишемо так чином:
е
рівняння перепишемо так чином:
де m = Nm0 - маса газу.
Для одного моля газу m = і V = Vm.
Тоді pVm = 1/3v2ср.кв.
З іншого боку, за рівнянням Менделєєва-Клапейрона
pVm = RT
О![]() тже,
тже,

Оскільки =moNA, R = kNA , де k - стала Больцмана, то
З рівняння Менделєєва-Клапейрона