
сборник ДСТ_3 выпуск_2013
.pdf
 Раздел 3
Раздел 3  ПИЩЕВАРИТЕЛЬНЫЙ ТРАКТ
ПИЩЕВАРИТЕЛЬНЫЙ ТРАКТ
ночной «перекус»). По словам пациентов, развитию приступа боли способствовали наклоны туловища, приседания, подъем тяжестей. Одна из больных отмечала колющую боль в сердце в сочетании с потемнением в глазах, одышкой при нахождении в согнутом положении в течение 15 мин. («заела молния на сапогах»). У 8 (29,6±8,8%) детей жгучая боль иррадиировала в левую лопатку, плечо и корень языка, симулируя стенокардию. Приступ боли иногда сопровождался артериальной гипо- (11 детей; 40,7±9,5%) или гипертензией (7 детей; 25,9±8,4%), причем у 2 (4,4±5,0%) больных только ночью.
У7 (25,9±8,4%) пациентов поводом для обращения к детскому кардиологу были ощущения перебоев в работе сердца, у 11 (40,7±9,5%) – приступы учащенного сердцебиения, у 1 (3,7±3,6%) – брадикардия на ЭКГ, причем у 2 детей нарушение ритма сердца было зафиксировано с помощью суточного мониторирования только в ночное время. У 1 (3,7±3,6%) ребенка во время приема пищи и только во время ночного сна возникала желудочковая экстрасистолия, зарегистрированная во время 24-часового мониторирования ЭКГ. Причиной для направления в стационар 16 пациентов были пре- (10 детей; 37,0±9,3%) и синкопальные (6 детей; 22,0±8,0%) состояния, однако во время проведения тилттеста синкопе не было индуцировано.
Изжога, как и боль у 13 (48,1±9,6%) больных с ГПОД обычно отмечалась после еды или при обстоятельствах, способствующих появлению рефлюкса (наклоны, прыжки, бег, подъем тяжестей, горизонтальное положение). У некоторых больных изжога преобладала в ночное время.
Увсех пациентов выявлены симптомы вегетативной дисфункции различной степени выраженности. У 3 больных наблюдались симпатоадреналовые кризы, у 1 ребенка – вагоинсулярный криз.
Увсех пациентов обнаружены признаки недифференцированной дисплазии соединительной ткани (НДСТ) максимальной степени выраженности. Скелетные изменения были представлены: деформацией позвоночника (сколиоз, кифоз, гиперлордоз) у 23 (85,2±6,8%) детей, гипермобильностью суставов - у 22 (81,5±7,5%), деформацией грудной клетки - у 7 (25,9±8,4%), плоскостопием - у
10 (37,0±9,3%), выраженной сандалевидной щелью - у 12 (44,4±9,6%). У 13 (48,1±9,6%) пациентов выявлено нарушение прикуса и диспластический рост зубов.
Изменения сердечно-сосудистой системы включали: пролапс митрального клапана (ПМК) I-II ст. у 26 (96,0±3,6%) детей, косые и поперечные хорды в полости левого желудочка у 17 (63,0±9,3%), патологическую извитость внутренней сонной артерии, гипоплазию позвоночных артерий у 7 (25,9±8,4%).
Висцеральные маркеры НДСТ у обследованных больных были следующими: деформация желчного пузыря у 9 (33,3±9,1%), пиелоэктазия у 7 (25,9±8,4%), долихосигма у 3 (11,1±6,0%). Общее количество признаков НДСТ у
171

 Раздел 3
Раздел 3  ПИЩЕВАРИТЕЛЬНЫЙ ТРАКТ
ПИЩЕВАРИТЕЛЬНЫЙ ТРАКТ
каждого пациента составляло от 7 до 18, причем количество главных признаков - от 5 до 12.
Увсех родственников первой степени родства обследованных больных выявлены различные фенотипические и висцеральные проявления НДСТ, а именно: деформация грудной клетки, плоскостопие, привычные подвывихи голеностопных суставов, расширенная подкожная венозная сеть, паховые и пупочные грыжи, ДЖВП, ПМК, нефроптоз, висцероптоз, дивертикулез толстого кишечника и др. Семейный анамнез по различной патологии желудочнокишечного тракта (ЖКТ) был отягощен у всех пациентов, однако лишь у 3 (11,1±6,0%) детей в анамнезе жизни имелись указания на наличие хронического гастродуоденита и ДЖВП.
Указанные особенности жалоб, анамнеза и клинических данных явились основанием для исключения патологии ЖКТ. В связи с этим в план обследования была включена фиброгастродуоденоскопия (ФГДС), проведенная с помо-
щью эндоскопа GIF P-30 «Olympus».
При ФГДС у всех детей выявлена гиперемия слизистой оболочки пищевода в нижней трети, зияние или полусомкнутость розетки кардии. Отмечался пролапс складок слизистой оболочки желудка на 3,0-3,5 см, релакс наступал через 20-30 с. Слизистая желудка была гиперемирована, отечна у всех пациентов, в просвете желудка у 19 (70,4±6,6%) детей. определялось большое количество слизи и желчи, у 5 (18,5±7,5%) – умеренное. У 24 (88,9±6,0%) больных пилорус был отечным, у 2 (4,4±5,0%) - зиял. У 22 (81,5±7,5%) детей имели место гиперемия, отечность, контактная ранимость слизистой двенадцатиперстной кишки. Де-нол – тест у 21 (77,8±8,9%) ребенка был положительным, у 5 (18,5±7,5%) – слабоположительным. Гиперацидное состояние определено у 3 (11,1±6,0%) детей, гипоацидное у 22 (81,5±7,5%), нормацидное у 2 (4,4±5,0%). Таким образом,
увсех пациентов были выявлены признаки ГПОД и ГЭРБ.
У21 (77,8±8,9) ребенка на основании клинических данных и УЗИ органов брюшной полости диагностирована ДЖВП по гипомоторному типу.
Результаты корреляционного анализа, проведенного с целью выявления возможной связи ГПОД с другими маркерами НДСТ, свидетельствовали о наличии прямой сильной связи между ГПОД и деформацией позвоночника (r=0,80), прямой средней связи между ГПОД и гипермобильностью суставов (r=0,63), нестабильностью шейного отдела позвоночника (r=0,43), плоскостопием (r=0,40), выраженной сандалевидной щелью (r=0,40), воронкообразной или килевидной деформацией грудной клетки (r=0,40), нарушением прикуса, диспластическим ростом зубов (r=0,38), множественным кариесом (r=0,39), кожными проявлениями НДСТ – обилием родинок, кофейными пятнами (r=0,56). Установлена прямая сильная связь между ГПОД и ПМК, ГПОД и ДЖВП (r=0,74), прямая средняя связь между ГПОД и косыми, поперечными хордами в левом желудочке (r=0,64),
172

 Раздел 3
Раздел 3  ПИЩЕВАРИТЕЛЬНЫЙ ТРАКТ
ПИЩЕВАРИТЕЛЬНЫЙ ТРАКТ
S-образной девиацией/извитостью внутренней сонной артерии, гипоплазией позвоночной артерии (r=0,36), деформацией желчного пузыря (r=0,36), пиелоэкта-
зией (r=0,36); астигматизмом (r=0,38).
Заключение: таким образом, результаты проведенного нами исследования свидетельствуют о том, что ГПОД достоверно чаще встречается у девочек в сравнении с мальчиками; характеризуется многообразием клинических проявлений, наиболее частыми из которых служат симптомы недостаточности кардии, рефлюкс-эзофагита и вегетативных нарушений. Тяжесть клинической симптоматики обусловлена размером грыжи, сопутствующей патологией ЖКТ, выраженностью НДСТ, степенью дисбаланса вегетативной нервной системы. Важным для практического врача является анализ фенотипических признаков НДСТ у ребенка: с увеличением их количества возрастает вероятность ГПОД.
У детей к наиболее прогностически значимым в отношении ГПОД относится сочетание следующих признаков НДСТ: деформация позвоночника (сколиоз, кифоз, гиперлордоз), гипермобильность суставов, деформация грудной клетки, плоскостопие, нарушение прикуса, обилие пигментных пятен и родинок, ПМК, косые и поперечные хорды в левом желудочке, патологическая извитость внутренней сонной артерии, гипоплазия/извитость позвоночных артерий, деформация желчного пузыря, ДЖВП, пиелоэктазия.
Список литературы
1.Гастроэнтерологія / за ред. Харченко Н.В., Бабак О.Я. – К., 2007. – 720 с.
2.Нагорна Н.В. Бордюгова О.В., Дубова Г.В. та ін. Кардіальні аспекти грижі стравохідного отвору діафрагми // Здоровье ребенка. – 2009. – №3(18). – С.
74-79.
3.Майданник В.Г. Болезни органов пищеварения у детей. – К.: СП «Інтертехнодрук», 2010. – 1157 с.
4.Майданник В.Г., Корнейчук В.В., Хайтович Н.В., Салтыкова Г.В. Заболевания пищевода, желудка и двенадцатиперстной кишки у детей. – К.: ВБ «Аванпост-Прим», 2008. – 432 с.
5.Гастроэнтерология детского возраста / под ред. С.В. Бельмера, А.И. Хавкина. – М.: ИД Медпрактика-М, 2003. – 360 с.
6.Евтушенко С.К., Морозова Т.М., Шестова Е.П. и др. Синдром мышечной гипотонии у новорожденных и детей раннего возраста / Учебное пособие. – Донецк, 2008. – 240 с.
7.Кадурина Т.И., Горбунова. В.Н. Дисплазия соединительной ткани / Руководство для врачей. – СПб. : Элби-СПб, 2009. – 704 с.
8.Николаева О.В. Ермолаев М.Н. Гастроэзофагеальная рефлюксная болезнь у детей и дисплазия соединительной ткани // Здоровье ребенка – 2008. – №1. – С. 9–13.
173

 Раздел 3
Раздел 3  ПИЩЕВАРИТЕЛЬНЫЙ ТРАКТ
ПИЩЕВАРИТЕЛЬНЫЙ ТРАКТ
9.Колкин Я.Г., Колкина В.Я. Вегетативные маски хиатусных грыж // Доктор.
– 2004. – №3. – С. 29-32.
10.Нагорна Н.В., Бордюгова О.В., Дубова Г.В. та ін. Грижа стравохідного отвору діафрагми в дітей – веселковий одяг хамелеона // Здоровье ребенка. – 2009. – №2(17). – С. 98-102.
В.В. СУМЕНКО 1, С.Е. ЛЕБЕДЬКОВА 1, О.Е. ЧЕЛПАЧЕНКО 1, Н.Н. КАГАН 2
К ВОПРОСУ О РАСШИРЕНИИ ПЕЧЕНОЧНЫХ ВЕН У ДЕТЕЙ С ВЕГЕТАТИВНОЙ ДИСТОНИЕЙ И ДИСПЛАЗИЕЙ СОЕДИНИТЕЛЬНОЙ ТКАНИ
1Государственная медицинская академия, Оренбург
2Областная детская клиническая больница
Введение: в настоящее время известен ряд заболеваний, сопровождающихся патологическим расширением печеночных вен (ПВ) у детей [1]. Однако нередко при проведении ультразвуковых исследований паренхиматозных органов брюшной полости отмечается идиопатическое пограничное расширение печеночных вен у практически здоровых детей, клиническая интерпритация которых во врачебной практике затруднена.
Широкая распространённость диспластических изменений соединительной ткани сердца, его соединительно-тканного каркаса и клапанного аппарата, а так же артерий и вен при недифференцированных соединительнотканных дисплазиях (НСТД) хорошо известна [2, 3, 4]. Синдром соединительно-тканной дисплазии сердца (СТДС) включает в себя пространственное несоответствие размеров сердца и грудной клетки, предполагающее следующие варианты ремоделирования сердца: астенический (малое сердце), констриктивный (сдавливающий), ложностенотический (ротация основных стволов), псевдодилатационный (расширение корня аорты) и торако-диафрагмальное лёгочное сердце [5]. Выделяют дефекты соединительно-тканного каркаса и клапанного аппарата сердца: малые аномалии сердца (МАС), которые рассматриваются как проявления системного дефекта соединительной ткани, выполняющие самостоятельную роль в развитии сердечно сосудистой патологии. Прежде всего, это пролапс митрального клапана (ПМК), способный приводить к нарушениям сердечного ритма, митральной регургитации, высокой опасности развития инфекционного эндокардита и других осложнений [6]; аномально расположенные хорды (АРХ) сердца, которые часто являются причиной нарушений ритма и проводимости [7], а сак же изолирован-
174

 Раздел 3
Раздел 3  ПИЩЕВАРИТЕЛЬНЫЙ ТРАКТ
ПИЩЕВАРИТЕЛЬНЫЙ ТРАКТ
ные АРХ ив сочетании с ПМК выявляются у детей с вегетативной дистонией, с синдромом сосудистых нарушений, с геморрагическим синдромом, что отличает этих пациентов от здоровых лиц [8].
Нарушение структуры и функции соединительной ткани сердца и межтканевых отношений являются третьей важной составляющей синдрома СТДС. Нарушения ионного транспорта и метаболизма миокарда становится причиной развития различных нарушений ритма и проводимости, и изменений формы пред- сердно-желудочкового комплекса ЭКГ [3].
Важное клиническое значение имеет характерный для лиц с диспластическим статусом сосудистый синдром, проявляющийся поражением артерий эластического типа: идиопатическим расширением стенки с формирование аневризмы; поражение артерий смешанного и мышечного типа (бифуркационно – гемодинамические аневризмы, долихоэктазии удлинённых и локальных расширенных артерий, патологическая извитость); поражением вен (патологическая извитость, варикозное расширение вен верхних и нижних конечностей, геморроидальных и других вен), телеангиоэктазиями, эндотелиальной дисфункцией. Изменения сосудов сопровождаются повышением тонуса в системе крупных и мелких артерий и артериол, уменьшением объема и скороcти наполнения артериального русла, снижением венозного тонуса и избыточным депонированием крови в периферических венах [Г.И.Нечаева, В.М.Яковлев 2008].
Одним из важных, но малоизученных клинико-эхокардиографических симптомов сосудистого синдрома является расширение печеночных вен.
Цель работы: определить клинико-эхографические особенности состояния сердечно-сосудистой системы у детей с пограничным расширением печёночных вен.
Пациенты и методы: проведено популяционное клиникоэпидемиологическое исследование методом 10%-ной репрезентативной выборки 970 детей в возрасте 11-16 лет, из них 467 мальчиков и 503 девочек. Исследуемую группу (1) составили 95 детей с расширением печёночных вен. В контрольную группу (2) вошли 60 детей без расширения печёночных вен. Внешние фенотипические признаки соединительнотканной дисплазии СТД определялись по критериям О.Е. Блинниковой, А.Н. Семячкиной, P. Beithon. Всем детям проведено ультразвуковое исследование печени в положении на спине, из-под края рёберной дуги конвексным датчиком 5 MГц, при свободном дыхании, размеры печёночных вен измерялся на расстоянии 1-2 сантиметра от впадения их в нижнюю полу вену. Печеночные вены размером 7,5-10 мм считались погранично расширенными. Детям обеих групп выполнено ЭКГ и эхокардиографическое (ЭхоКГ) обследование детей на аппарате «Vivid 7» с допплерографией для выявления признаков дисплазии соединительной ткани сердца (ДСТС). Исходный вегетативный тонус определялся по опроснику Вейна-Белоконь, вегетативное
175

 Раздел 3
Раздел 3  ПИЩЕВАРИТЕЛЬНЫЙ ТРАКТ
ПИЩЕВАРИТЕЛЬНЫЙ ТРАКТ
обеспечение – по данным клиноортостатической пробы, вегетативная реактивность - по пробе Кушелевского, индексу Кердо.
Статистическая обработка материала проведена путем подсчёта показателя распространенности признака, вычисления средних величин (М) и ошибки (m). Математическая оценка результатов исследования включала применение общепринятых методов вариационной статистики с вычислением критерия Стьюден- та-Фишера (Г.Ф.Лакин, 1990) c использованием программы Ехcel.
Результаты и обсуждение: при популяционном исследовании детей 1116 лет было установлено, что диаметр печёночных вен в среднем составил 5,74+ 0,6 мм. (стандартное отклонение 1,5). По показателям 95% доверительного интервала, диаметр печёночных вен у здоровых детей находятся в пределах от 4,6 до 6,95 мм. У детей печёночные вены считались погранично расширенными, если их диаметр находящимся в диапазоне от 7,5 мм., установленной нами верхней границе нормы и 10 мм, верхней границе нормы по данным В.В.Митькова (2002). Пограничное расширение ПВ было выявлено у 95 детей, что составило 9,8%, при этом, в сочетании с расширением нижней полой вены до 20-22 мм - у
20 детей (2,1%).
У 80 детей исследуемой группы (84,2%) отмечались внешние признаки СТД: синдром гипермобильности суставов -55,8 + 5,1 % (в контрольной группе – 33,3 +6,1 %, p<0,01), гиперрастяжимость кожи – 24,2 + 4,4 % (в контрольной группе -18,3 + 5 %, p>0,05), повышенная кровоточивость – 33,7 + 4,8 % (в контрольной группе – 31,7 + 6%, p>0,05), деформации грудной клетки – 12,6 + 3,4 % (в контрольной группе – 4,2 + 2,6 %, p<0,05), сколиозы различной степени выраженности – 25,3 + 4,5% (в контрольной группе -11,7 + 4,1 %, p<0,05), расширение подкожной венозной сети туловища, верхних и нижних конечностей – 27,4 + 4,6 % (в контрольной группе – 9,2 + 3,7 %, p<0,05), «крыловидные» лопатки – 15,8 + 3,7 % (в контрольной группе -11,7 + 4,1 %, p<0,05), плоскостопие – 22,1 + 4,3 % (в контрольной группе -18,3 + 5%, p>0,05), глубокая «сандалевидная» щель между 1-м и 2-м пальцем стопы – 12,6 + 3,4 % (в контрольной группе -10 + 3,9%, p>0,05), удлинение 4-го пальца кисти относительно 2-го – 24,2 + 4,4% (в контрольной группе – 25 %) (Рис. 1).
Кроме внешних признаков СТД определялись эхокардиографические изменения, свидетельствующие о наличии соединительнотканной дисплазии сердца.
В исследуемой группе выявлено 49 детей (51 + 5,1 %) с пролапсом трикуспидального клапана (ПТК) 1-2 степени с регургитацией (на + и ++), в контрольной группе – 9,2 + 3,7 %, p<0,001; удлинение Евстахиевой заслонки НПВ обнаружено у 47 детей исследуемой группы, что составило 49,5 + 5,1 %, (в контрольной группе – 18,3 + 5 %, р<0,001); идиопатическое расширение легочной артерии регистрировалось у 11 детей т.е у 11,6 + 3,3 %, (контроль – 5,8 + 3 %, p>0,05).
176

 Раздел 3
Раздел 3  ПИЩЕВАРИТЕЛЬНЫЙ ТРАКТ
ПИЩЕВАРИТЕЛЬНЫЙ ТРАКТ
Рис. 1. Частота встречаемости внешних фенотипических признаков у детей с расширенными печеночными венами
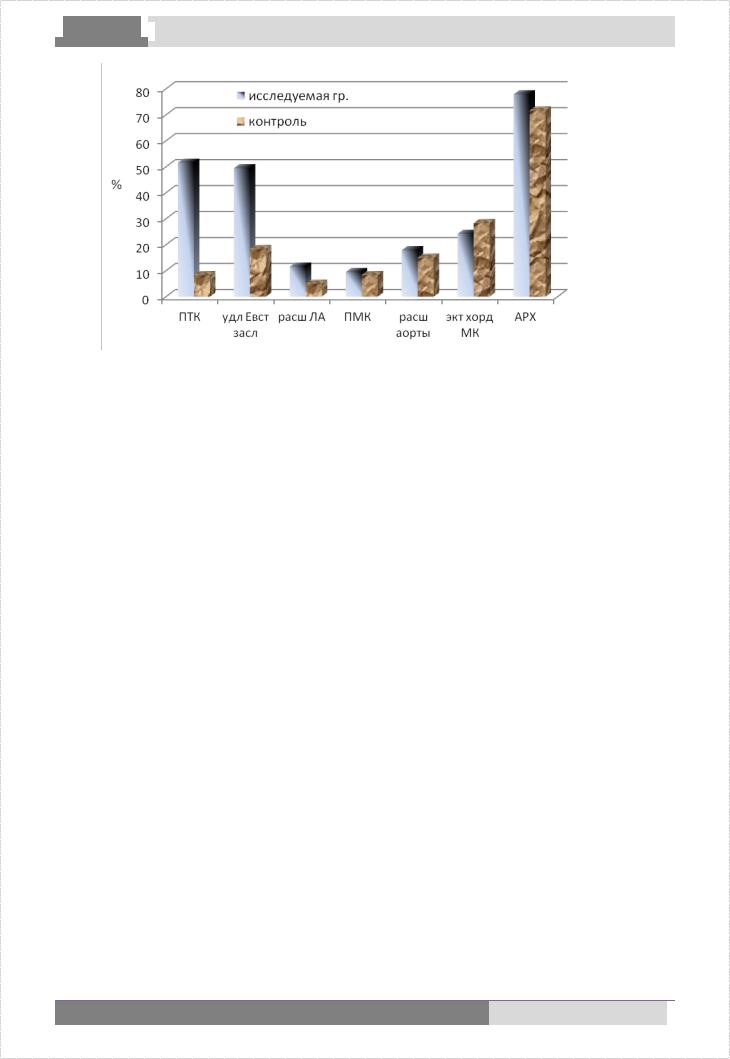
Пролапс митрального клапана 1 -2 ст. с регургитацией (++) определялся у 9 (9,5 + 3,1 %) детей (в контрольной группе – 8,3 + 3,7 %, р>0,05); расширение аорты на уровне синусов Вальсальвы имели место у 17 (17,9 + 3,9 %) детей 1-й группы (в контрольной группе – 15 4,6 %, р>0,05); эктопия крепления хорд митрального клапана отмечалась у 23 (24,2 + 4,4 %), (в контрольной группе – 28,3 + 5,8 %, р>0,05); дополнительные диагональные и поперечные трабекулы выявлены у 74 детей, что составило 77,9 + 4,3 % (в контрольной группе – 71,7 + 5,8 %, р>0,05); диастолическая функция левого желудочка сохранялась в пределах нормы.
Снижение сократительной способности миокарда выявлено у 2 детей 1-й группы (2,1 + 1,6 %), (в контрольной группе – 1,6% + 2 , р>0,05) (Рис. 2).
При углубленном клиническом исследовании детей с пограничным расширением печеночных вен у 93,2 + 2,6 % детей диагностирован синдром вегетативной дистонии по ваготоническому типу с недостаточным обеспечением, при наличии на ЭКГ умеренной и выраженной брадикардии или брадиаритмии (в контрольной группе 15 + 4,6 %, p<0,001).
177
 Раздел 3
Раздел 3  ПИЩЕВАРИТЕЛЬНЫЙ ТРАКТ
ПИЩЕВАРИТЕЛЬНЫЙ ТРАКТ
Рис. 2. Структура дисплазии сердца у детей с расширенными печёночными венами
В этих случаях расширение печёночных вен, вероятно, связано с увеличением фазы диастолы сердца, а также с ремоделированием сердца и структурными изменениями соединительной ткани, характерными для СТДС. Деформация грудины, ребер, позвоночника и связанное с ними высокое стояние диафрагмы приводят к уменьшению грудной полости, повышению внутригрудного давления, нарушают приток и отток крови, способствуют возникновению аритмий сердца [5]. В то же время, повышение внутригрудного давления приводит к снижению эффекта присасывающего действия сердца [9, 10].
Выводы: для детей с наличием расширенных печеночных вен наиболее характерны:
-внешние фенотипические признаки СТД, среди которых достоверно чаще встречаются: сколиозы различной степени выраженности, деформации грудной клетки, расширение подкожной венозной сети туловища, верхних и нижних конечностей;
-соединительно-тканные дисплазии сердца в виде пролапса трикуспидального клапана с регургитацией;
-синдром вегетативной дистонии по ваготоническому типу с недостаточным обеспечением, с регистрирующейся на ЭКГ умеренной или выраженной брадикардией или брадиаритмией.
Увеличение ширины печеночных вен и замедленный кровоток по ним, свидетельствует о застойных явлениях в печени кардиального происхождения [11] и скрытой сердечной недостаточности на доманифестном уровне (НК-0).
Список литературы
178

 Раздел 3
Раздел 3  ПИЩЕВАРИТЕЛЬНЫЙ ТРАКТ
ПИЩЕВАРИТЕЛЬНЫЙ ТРАКТ
1.Клиническое руководство по ультразвуковой диагностике (в 2-х томах под ре. В.В.Митькова). 1 том. М.:Видар, 1996. -336 с.
2.Соединительнотканные дисплазии сердца/Э.В.Земцовский. СПб: ТОО «Политекс-Норд-Вест», 1998, -96 с.
3.Земцовский Э.В. Диспластические фенотипы. Диспластическое сердце. Аналитический обзор. – СПб.: Изд-во «Ольга», 2007. 80 с.
4.Наследственные нарушения соединительной ткани. Российские ревомендации. Кардиоваскулярная терапия и профилактика. №6, 2009, Приложение 5.
5.Г.И.Нечаева, В.М.Яковлев, В.П.Конев, И.В.Друк, С.Л.Морозов. Дисплазия соединительной ткани: основные клинические синдромы, формулировка диагноза, лечение. Лечащий врач, №2, 2008, с 22-28.
6.Яковлев В.М., Карпов Р.С., Шевцова Е.В. Соединительно-тканная дисплазия митрального клапана. Томск: Сибирский издательский дом,
2004. -144 с.
7.Т.М.Домницкая. Аномально расположенные хорды сердца. –М.: ИД «Медпрактика-М», 2007, 95 с.
8.Трисветова Е.Л., Бова А.А. Пролапс митрального клапана// Кардиология. – 2002. -№8. –с.66-67.
9.Clinikal applications of Doppler Ultrasaund //2nd ed Eds. Teilor J.W. Burns P.N., Wells P.N.T. Raven Press. New. York. 1995. P. 35-53.
10.Кунцевич Г.И., Белолапотко Е.А. Цветовое допплеровское картирование и импульсная допплерография абдоминальных сосудов // Ультразвуковая диагностика сосудистых заболеваний / Под ред. НикитинаЮ.М., Труханова А.И. М.:Видар. 1998. С. 297-330.
11.Ультразвуковая диагностика в детской хирургии. / Под ред. И.В.Дворяковского, О.А.Беляевой. – М.:Профит, 1997. – 248 с.
179

 Раздел 4
Раздел 4  СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
РАЗДЕЛ 4
Сердечно-сосудистая система
В.В. Аникин, С.С. Александров, В.И. Тищенко, С.А. Александров
ОПРЕДЕЛЕНИЕ ПРЕДИКТОРОВ ВНЕЗАПНОЙ СЕРДЕЧНОЙ СМЕРТИ ПРИ НЕДИФФЕРЕНЦИРОВАННОЙ ДИСПЛАЗИИ СОЕДИНИТЕЛЬНОЙ ТКАНИ ГБОУ ВПО Тверская ГМА Минздравсоцразвития России, Тверь
Недостаточная изученность внезапной сердечной смерти (ВСС) позволяет широко варьировать гипотетические разработки её этиологии и патогенеза [1]. Причём, теоретические представления накапливаются, как в глобальном направлении (генные полиморфизмы [2], повреждение структуры гипоталамуса и гипофиза [3], нарушения липидного метаболизма [4], изменение молекулярных особенностей тканевой воды [5]), так и в более узком, специализированном направлении (развитие относительного охлаждения миокарда, связанного с повышением пропускных способностей крови для инфракрасного излучения [6]; ухудшение кровоснабжения в бассейне правой коронарной артерии, приводящее к дисфункции центров сердечного автоматизма и электрической нестабильности миокарда [7]; патологические изменения трёхстворчатого клапана, ассоциированные с нарушениями в проводящей системе сердца [8]). Одним из актуальных и вместе с тем далеко неоднозначных путей изучения может быть оценка участия недифференцированной дисплазии соединительной ткани (НДСТ) в патогенезе внезапной сердечной смерти [9].
Цель работы: оценить предикторную роль морфологических изменений при ВСС у лиц с признаками недифференцированной дисплазии соединительной ткани.
Материалы и методы: по данным ГУ «Тверское областное бюро судеб- но-медицинской экспертизы» за последние 6 лет был выделен массив лиц, умерших в возрасте до 40 лет от ВСС, имевших признаки НДСТ, который объединил 292 случая (мужчин – 246; женщин – 46). Средний возраст наступления ВСС у мужчин составил 32±0,2 года, в то время как у женщин – 36±0,4 лет. Для постановки диагноза использовали номенклатуру и критерии, рекомендованные экспертным комитетом ВОЗ, в которых к ВСС относят внезапно развивающееся состояние, возникающее вследствие электрической нестабильности сердца, в отсутствие реанимационных мероприятий или их безуспешности [10].
Основное внимание уделялось детальному изучению состояния сердечно– сосудистой системы, включая гистологическое исследование сердца, его кла-
180
