
сборник ДСТ_3 выпуск_2013
.pdf
Раздел 4 |
СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА |
|
|
|
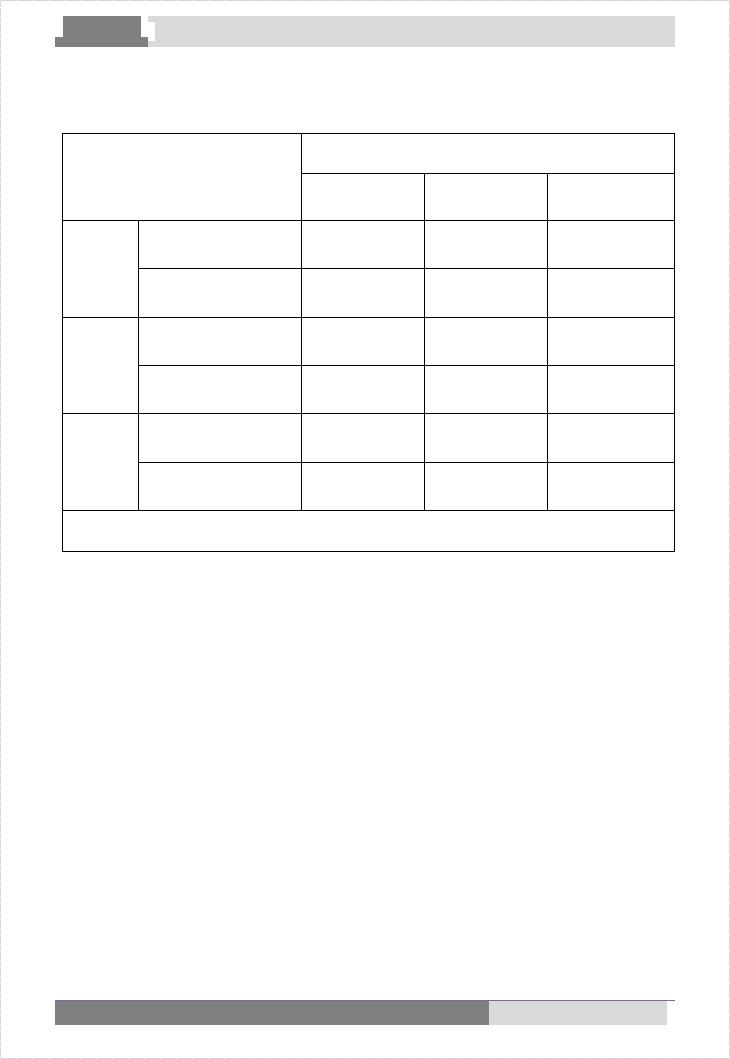
Таблица 1. |
Средние значения эхокардиографических параметров детей с ДСТ при различных формах малых аномалий развития сердца
МАРС, n=391 |
УО, мл |
КДО, мл |
EF, % |
FS, % |
MVcf, % |
d ЛЖ, см |
1.ПМК, n=89 |
49,49 1,84 |
77,17 2,78 |
65,02 0,51 |
35,30 0,40 |
1,19 0,02 |
4,14 0,06 |
2.ПТК, n=28 |
53,19 3,17 |
83,19 5,10 |
64,90 0,91 |
35,36 0,70 |
1,14 0,03 |
4,27 0,12 |
3.ДХА, n=46 |
43,63 2,23 |
67,31 3,78 |
64,65 0,55 |
34,77 0,46 |
1,17 0,02 |
3,92 0,10 |
|
р1 0,1, р2 0,05 |
|
|
|
|
р1,2 0,05 |
4.ЛХЛЖ, n=70 |
48,01 1,75 |
74,39 2,79 |
65,11 0,57 |
35,24 0,45 |
1,15 0,01 |
4,16 0,07 |
|
|
|
|
|
р1 0,1 |
р3 0,05 |
5.ПМК+ЛХЛЖ, n=51 |
51,39 2,35 |
75,42 3,53 |
65,47 0,73 |
35,70 0,58 |
1,22 0,03 |
4,12 0,07 |
|
р3 0,05 |
|
|
|
р2 0,1, р4 0,05 |
|
6.ПТК+ ЛХЛЖ, n=11 |
47,45 4,08 |
75,73 7,00 |
65,48 1,56 |
35,30 1,26 |
1,20 0,06 |
4,07 0,18 |
7.ПМК+ПТК+ ЛХЛЖ, n==8 |
49,88 4,35 |
78,25 7,73 |
63,99 1,40 |
34,79 1,04 |
1,17 0,05 |
4,27 0,22 |
8.ПМК+ПТК, n=33 |
45,19 2,34 |
68,63 3,92 |
66,38 0,92 |
36,29 0,71 |
1,22 0,05 |
4,00 0,10 |
|
р2 0,05, р5 0,1 |
|
р3 0,1 |
р3 0,1 |
р4 0,1 |
р2 0,1 |
9.Контроль, n=55 |
33,44 1,46 |
54,84 3,00 |
64,12 0,79 |
36,06 1,66 |
1,23 0,07 |
3,54 0,12 |
|
р1,2,3,4,5,6,7,8 0,001 |
р1,2,4,5 0,001, |
р8 0,1 |
|
|
р1,2,4,5 0,001 |
|
|
р3 0,05, р6,7,8 0,01 |
|
|
|
р3,8 0,05 |
|
|
|
|
|
|
р6 0,1 |
231

 Раздел 4
Раздел 4  СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
Таблица 2. Эхокардиографические показатели насосной и сократительной функций у детей с ДСТ сердца в
сравнении с нормативными данными А.С.Воробьева (1999)
масса, кг
 10,1-
10,1-
15,0 15,1-  20,0
20,0
20,1-  25,0
25,0
25,1-  30,0
30,0
30,1-  35,0
35,0
35,1-  40,0
40,0
40,1-  45,0
45,0
45,1-  50,0
50,0
50,1-  55,0
55,0
55,1-
 60,0
60,0
пол, |
КДРнор- |
КДР при |
КДОнор- |
КДО |
при |
УО нор- |
УО |
при |
EF |
норма- |
EF |
при |
кол.чел |
матив,см. |
СДСТ,см |
матив,мл |
СДСТ,мл. |
матив,мл. |
СДСТ,мл. |
тив, % |
СДСТ, % |
||||
м,n=1 |
2,7-3,1 |
3,20 |
27-38 |
43,00 |
|
18-26 |
|
28,00 |
66,67-68,42 |
|
63,67 |
|
ж,n=3 |
2,6-3,0 |
3,20 |
25-35 |
43,00 |
|
17-24 |
|
28,00 |
68,00-68,57 |
|
63,67 |
|
м,n=16 |
3,1-3,4 |
3,62 0,08 |
38-48 |
55,11 3,19 |
27-32 |
32,83 2,32 |
66,67-71,05 |
65,01 0,56 |
||||
ж,n=25 |
3,0-3,4 |
3,24 0,08 |
35-48 |
42,25 2,25 |
25-32 |
28,27 1,65 |
70,83-71,43 |
63,97 0,85 |
||||
м,n=19 |
3,3-3,5 |
3,80 0,13 |
44-51 |
58,00 2,82 |
30-31 |
37,44 1,78 |
60,78-68,18 |
65,79 1,63 |
||||
ж,n=23 |
3,3-3,5 |
3,86 0,10 |
44-51 |
56,47 2,59 |
32-35 |
36,35 1,24 |
68,63-72,73 |
66,10 1,22 |
||||
м,n=26 |
3,5-3,7 |
3,87±0,07 |
51-58 |
63,76 3,25 |
35-36 |
46,16 1,52 |
62,07-68,63 |
65,52 0,97 |
||||
ж,n=23 |
3,4-3,6 |
3,76 0,07 |
48-54 |
59,33 3,42 |
35-36 |
41,83 2,36 |
66,67-72,92 |
65,94 1,14 |
||||
м,n=15 |
3,8-4,0 |
4,05 0,09 |
62-70 |
72,36 4,42 |
42-43 |
46,75 2,58 |
61,43-67,74 |
65,83 1,64 |
||||
ж,n=24 |
3,6-3,8 |
3,96 0,05 |
54-62 |
69,11 1,96 |
40-42 |
43,86 1,65 |
64,52-74,07 |
65,81 0,99 |
||||
м,n=15 |
4,0-4,5 |
4,22 0,11 |
70-92 |
78,00 4,89 |
48-62 |
50,25 3,29 |
67,39-68,57 |
64,25 0,86 |
||||
ж,n=28 |
3,7-4,0 |
4,05 0,05 |
58-70 |
74,04 2,42 |
40-48 |
49,63 1,59 |
68,57-68,97 |
66,48 0,73 |
||||
м,n=14 |
4,4-4,7 |
4,27 0,14 |
88-102 |
82,91 3,06 |
63-70 |
53,73 2,27 |
68,63-71,59 |
64,91 1,35 |
||||
ж,n=16 |
4,0-4,3 |
4,43 0,14 |
70-83 |
85,38 3,98 |
50-53 |
53,57 2,47 |
63,86-71,43 |
63,50 1,51 |
||||
м,n=12 |
4,4-4,8 |
4,50 0,19 |
88-108 |
96,00 7,08 |
61-73 |
63,38 6,46 |
67,59-69,32 |
65,63 3,36 |
||||
ж,n=23 |
4,0-4,3 |
4,37 0,11 |
70-83 |
88,05 3,13 |
48-53 |
57,86 2,31 |
63,86-68,57 |
65,67 0,91 |
||||
м,n=14 |
4,5-4,8 |
4,69 0,17 |
92-108 |
100,91 5,14 |
65-73 |
69,08 2,20 |
67,59-70,65 |
64,54 0,73 |
||||
ж,n=8 |
4,2-4,5 |
4,43 0,20 |
79-92 |
91,17 4,77 |
56-62 |
59,33 3,13 |
67,39-71,79 |
63,00 2,54 |
||||
м,n=23 |
4,7-4,9 |
5,10 0,10 |
102-113 |
119,22 4,17 |
72-78 |
78,10 4,12 |
69,03-70,59 |
63,90 0,94 |
||||
ж,n=8 |
4,4-4,8 |
4,60 0,25 |
83-97 |
100,80 5,59 |
58-65 |
61,20 2,22 |
67,01-69,88 |
61,00 1,81 |
||||
 Раздел 4
Раздел 4  СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
Таблица 3.
Гемодинамические показатели обследованных детей в зависимости от площади поверхности тела (М m)
Основные гемодинамиче- |
Площадь поверхности тела, м2 |
||||
|
ские показатели |
|
0,6-1,0 |
1,1-1,5 |
1,5 и более |
|
|
|
|||
|
|
|
n=169 |
n=149 |
n=72 |
|
Основная группа |
40,72 3,98 |
44,66 2,50 |
46,44 0,62 |
|
КДР, |
|
|
n=150 |
n=123 |
n=63 |
мм |
Контрольная |
груп- |
33,9 1,07 |
46,05 3,23 |
44,50 1,50 |
|
па |
|
n=19 |
n=26 |
n=9 |
|
Основная группа |
55,60 1,37 |
79,63 1,41 |
115,95 1,35 |
|
КДО, |
|
|
n=150 |
n=123 |
n=63 |
мл |
Контрольная |
груп- |
50,28 2,64 |
64,00 1,69 |
87,67 4,67 |
|
па |
|
n=19 |
n=26 |
n=9 |
|
Основная группа |
36,85 0,84 |
52,00 0,94 |
66,98 1,86 |
|
УО, мл |
|
n=150 |
n=123 |
n=63 |
|
|
Контрольная |
груп- |
31,65 1,36 |
35,67 5,55 |
53,67 1,45 |
|
па |
|
n=19 |
n=26 |
n=9 |
Примечание: где, - р 0,001 |
- р 0,05 |
- р 0,01 |
|
||
Таким образом, сердечно-сосудистая система у детей с соединительнотканной дисплазией сердца напряженно функционирует в условиях покоя. Об этом свидетельствует высокая частота нарушений сердечного ритма, тенденция к увеличению электрической систолы предсердий и удлинению времени прохождения импульса от СА- к АВ-узлу, что позволяет отнести этих детей к угрожаемым по возникновению у них сердечно-сосудистых изменений во взрослом состоянии.
Список литературы
1.Яковлев, В.М. Терминология, определенная с позиции клиники, классификация врожденной дисплазии соединительной ткани / В.М. Яковлев, Г.И. Нечаева, И.А. Викторова [и др.] // Врожденные дисплазии соединительной ткани: Тезисы симпозиума. — Омск, 1990. — С. 3–5.
2.Baker, P. Floppy mitral valve chordae tendineae: histopathologic alterations / P. Baker, G. Bansal, H. Boudoulas [et al.] // Hum. Pathology. — 1998. — V.
19, № 5. — Р. 507–512.
233

 Раздел 4
Раздел 4  СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
3.Гнусаев, С.Ф. Классификация малых аномалий сердца / С.Ф. Гнусаев, Ю.М. Белозёров, А.Ф.Виноградов // Вестн. аритмологии. – 2000. - № 18. – С. 76.
4.Кадурина, Т.И. Поражение сердечно-сосудистой системы у детей с различными вариантами наследственных болезней соединительной ткани / Т.И. Кадурина // Вестн. аритмологии. – 2000. - № 18. – С. 87.
5.Boudoulas, H. Mitral valve prolapse: cardiac arrest with long-term survival / H. Boudoulas, S.F. Schaal, J.M. Stang [et al.] // Int. J. Cardiol. — 1990. — V. 26, № 1. — Р. 37–44.
6.Singh, J. Prevalence and clinical determinants of mitral, tricuspid and aortic regurgitation (The Framingham Heart Study) / J. Singh, J. Evans, D. Levy [et al. ] // Amer. J. Cardiology. — 1999. — V. 83, № 6. — Р. 897–902.
7.Wroblewska-Kaluzewska, M. Arrhythmia and repolarization in children with mitral valve prolapse / M. Wroblewska-Kaluzewska, A. Piorecka-Makula, A. Tomik // Wiad. Lek. — 2000. — V. 53, № 9–10. — Р. 13–517.
8.Гнусаев, С.Ф. Клиническое значение малых аномалий сердца у детей / С.Ф. Гнусаев, Ю.М. Белозеров, А.Ф. Виноградов // Российский вестник перинатологии и педиатрии. — 2006. — № 4. — С. 20–25.
9.Мартынов, А.И. Характеристика клинической картины у больных с идиопатическим пролабированием митрального клапана и аномально расположенными хордами / А.И. Мартынов // Клин. медицина. – 1996. - № 2. – С. 16-20.
234

 Раздел 5
Раздел 5  РЕСПИРАТОРНАЯ СИСТЕМА
РЕСПИРАТОРНАЯ СИСТЕМА
РАЗДЕЛ 5
Респираторная система
Е.Ю. Брыксина, В.С. Брыксин, А.В. Почивалов
ПАТОГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ СОЕДИНИТЕЛЬНОТКАННОГО РЕМОДЕЛИРОВАНИЯ ПРИ БРОНХОЛЕГОЧНОЙ ДИСПЛАЗИИ ГОУ ВПО ВГМА им. Н.Н. Бурденко Росздрава, Воронеж
ГУЗ ВОДКБ №1, Воронеж
Резюме: согласно современным представлениям об этиологии и патогенетических механизмах формирования бронхолегочной дисплазии, важную роль в ремоделировании ткани легких с нарушением их функции играют эндогенные факторы, к которым относится, в частности, синдром дисплазии соединительной ткани. Учитывая полисистемность локализации данного вида ткани, развивается разнообразная коморбидная патология, негативно влияющая на характер течения бронхолегочной дисплазии, что обосновывает необходимость комплексного диагностического и лечебного подхода.
Бронхолегочная дисплазия (БЛД) является одной из важных проблем современной неонатальной пульмонологии. Одним из основных морфологических изменений в бронхолегочной системе при БЛД является очаговое фиброзное перерождение структурных компонентов легких с развитием деформации бронхиального дерева и гиперинфляцией соседних участков. Согласно современной концепции патогенеза БЛД важную роль в соединительнотканном ремоделировании бронхолегочной системы играет группа эндогенных факторов, в которую входит, помимо сурфактантной недостаточности и недоношенности, генетическая предрасположенность к диспластическим процессам [1]. На наследственный генез указывают комбинации генетически детерминируемых признаков, таких как расовая принадлежность (европейская раса), мужской пол, высокая частота бронхолегочных и атопических заболеваний у родственников детей, страдающих БЛД. Согласно проведенным эпидемиологическим исследованиям, в семьях детей с бронходиспластическими процессами достаточно часто встречается такая бронхообструктивная патология как бронхиальная астма, что указывает на наследуемую предрасположенность к гиперреактивности бронхов [2, 3, 4]. Генетически детерминируемый синтез функционально неполноценного сурфактанта за счет недостаточности его структурного компонента - протеина В, приводит к снижению активности сурфактантной системы, предрасполагая к
235

 Раздел 5
Раздел 5  РЕСПИРАТОРНАЯ СИСТЕМА
РЕСПИРАТОРНАЯ СИСТЕМА
развитию ателектазов и респираторных расстройств раннего неонатального периода с необходимостью проведения искусственной вентиляции легких (ИВЛ), развитием фиброзной перестройки паренхимы легких. Данная ситуация связана
смутациями генов SFTPB, SFTPC, A3ABCA3 [4, 5, 6]. Необходимо отметить, что недостаточность сурфактантной системы генетического генеза имеет крайне неблагоприятный прогноз и часто приводит к летальному исходу, в отличие от снижения активности или разрушения сурфактанта в результате действия внитриутробных инфекционных, гипоксических или постнатальных факторов [6, 7]. Точный этиологический механизм генетического влияния на формирование БЛД
суказанием причинно значимых генов на данный момент полностью не изучен, но существует предположение, что в процессе ремоделирования легочной ткани участвуют гены, ответственные за процессы репарации. В результате повреждающего действия патологических факторов, восстановление ткани легких может протекать по пути реконструкции структурных компонентов органа с сохранением его адекватной функции, либо стимуляцией фиброзных процессов с замещением функционально активной ткани соединительной, деформацией трахеобронхиального дерева и вентиляционно-перфузионными нарушениями. Следовательно, у детей, сформировавших БЛД генетический дефект связан с дисфункцией процессов репарации с замедлением и снижением их активности, а также тенденцией к фиброзному ремоделированию паренхимы легких. Кроме того установлено, что воспалительный процесс, имеющий место у детей с БЛД способен, посредством медиаторного воздействия, потенцировать дальнейшее фиброзирование за счет экспрессии генов, ответственных за синтез компонентов соединительной ткани. Установлено, что стимулирующие мутации в гене TGFB1, ответственного за синтез трансформирующего фактора роста β1, приводят к мультисистемной стимуляции процессов фиброзирования с ремоделированием легочной ткани в частности [6].
Рассматривая патологию структуры и интенсивности синтеза соединительной ткани как один из основополагающих эндогенных механизмов в развитии БЛД, следует отметить, что в раннем постнатальном периоде этот вид ткани обладает высокой пролиферативной активностью, что в условиях стимулирующего действия медиаторов воспаления и повреждения легких в результате инфекционного процесса, а также проведения респираторной поддержки, приводит к соединительнотканному замещению травмированной легочной паренхимы [5].
Всовременной литературе широко обсуждается роль соединительнотканного дисгенеза в этиопатогенезе БЛД. Частота выявления синдрома дисплазии соединительной ткани (ДСТ) характеризуется широкой вариабельностью в зависимости от исследуемого контингента детей и составляет от 26% до 80%. Морфологически соединительнотканная дисплазия представлена генетически детерминируемой патологией коллагеновых и эластиновых волокон, связанная с нарушением механизмов синтеза и сборки компонентов коллагена и эластина,
236

 Раздел 5
Раздел 5  РЕСПИРАТОРНАЯ СИСТЕМА
РЕСПИРАТОРНАЯ СИСТЕМА
повышенной их деградацией, изменением пространственной организации, дисметаболическими процессами в экстрацеллюлярном матриксе соединительной ткани [4, 5, 8]. Помимо генетических мутаций, в генезе синдрома ДСТ лежат и экзогенные факторы, а именно дефицит Mg2+ , приводящий к стимуляции процессов деградации коллагена и эластина на фоне повышения активности интерстициальных коллагеназ, в частности, матриксных металлопротеиназ (ММП), эластаз, что приводит к расслоению структуры соединительной ткани с уменьшением ее прочности и устойчивости к механическим воздействиям. Дисбаланс в системе биосинтеза белково-углеводных компонентов межклеточного матрикса – гликозаминогликанов, представленный деактивацией гиалуронансинтетаз и стимуляцией гиалуронидаз, при повышении активности ММП, сопровождается выраженной деградацией экстрацеллюлярных структур с последующим дефицитом их синтеза, что совместно с патологией образования коллагеновых и эластиновых фибрилл способствует развитию полисистемных морфофункциональных нарушений [3, 5, 9, 10, 11, 12].
Важную роль в деградации и последующем фиброзном ремоделировании межклеточного матрикса играют ММП-1, ММП-8, ММП-13, выделение и коллагеназная активность которых стимулируются свободными радикалами [13, 14, 15]. ММП участвуют в регуляции гомеостаза синтеза и деградации коллагена I, II, III типов. Установлено, что ММП-1(коллагеназа -1), образуемая макрофагами, эпителиальными и эндотелиальными клетками, инициирует начальные этапы деградации преимущественно коллагена III типа. ММП-8 (коллагеназа-2) вырабатывается плазматическими, эндотелиальными, эпителиальными клетками, синовиальными фибробластами, хондроцитами, нейтрофилами и, главным образом, деградирует коллаген I типа. ММП-13 (коллагеназа-3) участвует в перестройке коллагена II типа, и, с меньшей активностью - коллагена I и III типов. ММП-13 образуется разнообразными клетками, включающими макрофаги, Т-лимфоциты и плазматические клетки [16]. Немаловажное значение в ремоделировании легочной ткани имеет желатиназа-В (ММП-9) и тканевой ингибитор ММП-1 (ТIМР-1), дисбаланс в соотношении которых может привести к развитию фиброза подслизистой основы в бронхолегочной системе. После воздействия на коллаген интерстициальных коллагеназ, он становится чувствительным к деградации другими ММП, что способствует дальнейшему ремоделированию интерстиция [17]. В условиях хронического воспаления при БЛД происходит стимуляция синтеза ММП провоспалительными цитокинами, что на фоне фибропластической направленности репаративных процессов приводит к соединительнотканной трансформации паренхимы легких [3, 9, 14, 18, 19].
Установлено наличие взаимосвязи между уровнем ММП и концентрацией общего оксида азота, фактора роста фибробластов, супероксиддисмутазы. Так, повышение содержания оксида азота, обладающего бронхолитическим и вазодилатирующем эффектом, на фоне активного фиброзного ремоделирования легоч-
237

 Раздел 5
Раздел 5  РЕСПИРАТОРНАЯ СИСТЕМА
РЕСПИРАТОРНАЯ СИСТЕМА
ной ткани является компенсаторно-приспособительной реакцией, улучшающей легочную вентиляцию и микроциркуляцию как в пульмональных, так и в церебральных сосудах. Однако повышение оксида азота усиливает оксидантный стресс за счет выработки пероксинитрита и, тем самым, может повышать экспрессию ММП [4, 18, 19, 20, 21]. Фактор роста фибробластов, влияющий на метаболизм коллагена и, соответственно, играющий важную роль в ремоделировании респираторного тракта, супрессивно действует на образование ММП [18]. Супероксиддисмутаза, подавляющая образование активных форм кислорода посредством превращения супероксидного аниона в гидроксильный радикал повышается у детей с легким течением БЛД. При тяжелом течении БЛД с максимальной экспрессией ММП, имеет место снижение уровня супероксиддисмутазы, как свидетельство истощения системы антиоксидантной защиты в условиях хронического оксидантного стресса [3, 22]. Таким образом, уровень экспрессии ММП свидетельствует о стадии и активности соединительнотканной трансформации в процессе формирования и течения БЛД.
Следует отметить, что гестационно незрелые дети характеризуются наличием дефицита микроэлементов, в том числе и Mg2+ , выраженность которого прямо пропорциональна степени недоношенности. Следовательно, недоношенность предрасполагает к диспластическим изменениям волокнистых структур и основного вещества соединительной ткани с мультисистемным проявлением и предрасположенностью к развитию бронхолегочной патологии в частности [23,
24, 25, 26].
Синдром ДСТ вследствие нарушений синтеза и катаболизма структурных компонентов межклеточного матрикса способствует развитию выраженных ана- томо-функциональных нарушений бронхолегочной системы, способствуя формированию хронической пульмонологической патологии с фиброзом, деформацией трахеобронхиального дерева, бронхообструкцией, синдромом утечки воздуха. Развивитие бронхообструктивного синдрома происходит за счет нарушения дренажной функции легких в результате снижения мукоцилиарного клиренса, а также пролабирования стенок трахеобронхиального дерева на фоне слабости соединительнотканного каркаса воздухопроводящих путей вследствие деградации его эластической основы [18, 19, 27, 28, 29]. В структуру синдрома ДСТ, в зависимости от генетических комбинаций и степени экспрессии отдельных генов, может входить трахеобронхиальная дискинезия, приводящая к патологическими изменениями моторики дыхания в виде повышения сопротивления воздухопроводящих путей и развития обструкции с гиповентиляцией и, соответственно, гипоксией, что сопровождается дыхательной недостаточностью, усугубляемой сочетанной инфекционной патологией. Разрушение межальвеолярных перегородок с последующей гиперпластической фиброзной репарацией способствует выраженному нарушению функции газообмена. Кроме того, при ДСТ
238

 Раздел 5
Раздел 5  РЕСПИРАТОРНАЯ СИСТЕМА
РЕСПИРАТОРНАЯ СИСТЕМА
потенцируются механизмы свободнорадикального повреждения клеток легочной ткани с последующим цитолизом [30, 31].
Сопутствующая дисфункция вегетативной нервной системы, входящая в состав синдрома ДСТ в связи с общим мезенхимальным происхождением, либо развившаяся на фоне гипоксического поражения ЦНС, вызывает дисрегуляцию дыхательной моторики центрального генеза. Установлено, что вегетативная дисрегуляция, имеющая место у детей с недифференцированной ДСТ в 78% случаев, связана не только с эмбриональным родством, но и генетическими мутациями, приводящими к нарушению метаболизма в соединительнотканной основе гипофиза, гипоталамуса, структур симпатико-адреналовой системы, половых желез, участвующих как в процессах вегетативного регулирования функций внутренних органов, так и влияющих на биосинтез компонентов межклеточного матрикса. В частности, патология синтеза и деградации коллагеновых волокон может быть индуцирована изменением характера регулирующих влияний со стороны гипоталамуса [32, 33].
Иммунологическая недостаточность, сопровождающая недифференцированную ДСТ и представленная снижением функциональной активности как клеточного, так и гуморального звена иммунного ответа, приводит к хронизации инфекционно-воспалительного процесса, устойчивости к проводимой терапии, склонностью к рецидивам, что в итоге способствует выраженным необратимым структурным и функциональным изменениям в системе органов дыхания. Иммуносупрессия характеризуется снижением количества и активности Т- хелперов-индукторов, лимфоцитов CD 25+ , выраженность которого определяется степенью экспрессии генов, ответственных за соединительнотканную дисплазию. Недостаточность иммунологических механизмов сочетается с гиперэргической формой ответа на инфекционно-воспалительный процесс (гиперэргический вариант течения сепсиса) и тенденцией к фиброзной трансформации поврежденных тканей, в связи с повышением количества и/или чувствительности рецепторов к провоспалительным цитокинам, в частности к фактору роста фибробластов. Аутоиммунные реакции вызывают непосредственное повреждение компонентов экстрацеллюлярного матрикса с уменьшением его прочности [6, 34, 35,
36].
Повышение проницаемости сосудов микроциркуляторного русла вследствие неполноценности эндотелия, обусловленной синдромом ДСТ, приводит к мультисистемным патологическим процессам, в том числе и в бронхолегочной системе создавая благоприятный фон для развития интерстициального отека легкого с нарастанием тяжести инфекционно-воспалительного и бронходиспластического процессов [4, 5, 6, 18, 19].
В заключении следует отметить, что для БЛД характерна этиопатогенетическая мультифакториальность с немаловажной ролью синдрома ДСТ в развитии бронхообструкции и фиброзной трансформации легочной паренхимы. Соче-
239

 Раздел 5
Раздел 5  РЕСПИРАТОРНАЯ СИСТЕМА
РЕСПИРАТОРНАЯ СИСТЕМА
танная патология метаболизма и синтеза соединительной ткани, учитывая полисистемность ее локализации, определяет полиморфизм и неспецифичность клинических проявлений при БЛД, что требует комплексного подхода в диагностической и лечебной тактике.
Список литературы
1.Complex gene diseases of the connective tissue / Ryu-Ichiro Hata, Kazukito Izukuri, Miko Furue [et al] // Connect. Tissue. – 2001. –V. 33. – N. 1. – P. 9–16.
2.Беляева О.В. Синдром системной дисплазии соединительной ткани у детей с бронхолегочной патологией / О.В. Беляева, О.И. Вишневская // Вестник РГМУ. – 2005. – 3(42) – С.121.
3.Давыдова И.В. Формирование, течение и исходы бронхолегочной дисплазии у детей: дис. … канд. мед. наук / И.В. Давыдова. – Москва, 2010. – 195 с.
4.Кадурина Т. И., Горбунова В. Н. Дисплазия соединительной ткани. Руководство для врачей / Т.И. Кадурина, В.Н. Горбунова. - «ЭЛБИ».- 2009.- 714с.
5.Кадурина Т.И. Дисплазия соединительной ткани у детей: автореф. дис. … д- ра мед. наук / Т.И. Кадурина - СПб., 2003. - 43 с.
6.Кадурина Т. И. Современные представления о дисплазии соединительной ткани / Т.И. Кадурина, В.Н. Горбунова // Казанский медицинский журнал.- 2007. - № 5. - С.- 2-5.
7.Нестеров Е.Н. Сурфактантная система легких и коррекция ее нарушений при бронхолегочных заболеваниях / Е.Н. Нестеров, Г.Н. Паневская // Пульмонология. - 2000. - №3. - С. 19-25.
8.Дисплазия соединительной ткани: Материалы симпозиума, Омск, 1 ноября 2002 г. / Под ред. Г.И. Нечаевой. – Омск, 2002. – 167 с.
9.Давыдова И.В. Матриксные металлопротеиназы как маркеры формирования бронхолегочной дисплазии у детей / И.В.Давыдова, Г.В. Яцык, Т.В. Бершова, М.А. Басаргина, М.И. Баканов // Пульмонология. - 2009. - №4. – С. 80-84.
10.Ультраструктурная взаимосвязь коллагеновых волокнистых компонентов в соединительной ткани человека / Н.П. Омельяненко, Л.Д. Жеребцов, Л.А. Деев // Арх. анат., гистол. и эмбриол. – 1979. – Т. 76. – № 5. – C. 65–70.
11.Юрина Н.А. Морфофункциональная гетерогенность и взаимодействие клеток соединительной ткани / Н.А. Юрина, А.И. Радостина // М.: Изд-во УДН, 1990. – 322 с.
12.Murch S.H. Mucosal tumor necrosis factor-? production and extensive disruption of sulfated glycosaminoglycans begin within hours of birth in neonatal respiratory distress syndrome / S.H. Murch, K. Costeloe, N.J. Klein [et al] // Pediatr Res. – 1996. – V. 40. – P. 484 – 489.
13.Басаргина М.А. Матриксные металлопротеиназы как маркеры формирования бронхолегочной дисплазии у детей / И.В. Давыдова, Г.В. Яцык, Т.В. Бер-
240
